CD44基因多态性对原发性肝癌细胞局部T细胞亚群浸润的影响*
苗凤华,陈晓,石磊,马筱慧
(吉林大学第一医院 肿瘤中心,吉林 长春 130021)
原发性肝癌是中老年人的常见病[1],预后较差[2-4]。CD44是近些年研究较热的一个肿瘤标志物[5-8],其可与组织间隙中微静脉末端的高柱状内皮细胞表面的透明质酸结合,在淋巴细胞回归到黏膜和引流淋巴结中具有重要作用。CD44蛋白可以募集CD8+T细胞等向局部组织转移,而CD8+T细胞可以分化为细胞毒性T细胞,因此可能增强机体对肿瘤细胞的杀伤作用。但目前关于CD44基因多态性与原发性肝癌患者局部组织中T细胞亚群的相关性尚未见报道。
1 资料与方法
1.1 研究对象
前瞻性收集2017年1月-2017年12月吉林大学第一医院收治的原发性肝癌患者临床资料。纳入标准:原发性肝癌(确诊依据为病理诊断);有手术适应证,可行手术治疗;年龄18~75岁;同意参与本研究,并签署知情同意书。排除标准:合并其他恶性肿瘤;复发性肝癌;肝﹑肾﹑心﹑脑﹑肺等重要脏器功能不全;感染性疾病;血液系统疾病;凝血功能障碍;术前接受新辅助化疗等特殊治疗;3个月内曾使用免疫调节剂;免疫功能不全;远处转移,不宜行手术治疗的晚期肝癌患者。研究期间共纳入原发性肝癌患者109例,根据CD44基因rs4756195位点单核苷酸多态性,将患者分为AA组﹑AG组和GG组,分别为67﹑23和19例。
1.2 观察指标
主要观察指标为肿瘤组织中CD4+T细胞﹑CD8+T细胞﹑Treg细胞﹑Th17细胞。次要观察指标为白介素 -2(interleukin-2, IL-2)﹑白介素 -10(interleukin-10,IL-10)﹑肿瘤生长因子-β(tumor growth factor-β,TGF-β)和白介素-17(interleukin-17, IL-17)。
1.3 方法
1.3.1 流式细胞术 术中留取原发性肝癌组织标本(距离肝癌边缘>1 cm的肝癌组织),使用流式细胞仪(美国Beckman coulter公司Epics XL型)检测CD4+T﹑CD8+T﹑Treg及Th17细胞。
1.3.2 免疫组织化学法 采用免疫组织化学法检测IL-2﹑IL-10﹑TGF-β和IL-17,相关单克隆抗体均购自美国Santa Cruz公司,抗体比例1∶80。阳性判定标准:根据染色强度和阳性细胞百分比计算,其中不着色﹑浅黄色﹑棕黄色﹑黄褐色分别为0﹑1﹑2和3分,阳性细胞数为<10%﹑10%~<40%﹑40%~<70%﹑≥70%分别计0﹑1﹑2和3分,两者之和为总分,总分≥2分为阳性,<2分为阴性。
1.3.3 聚合酶链反应(polymerase chain reaction,PCR) 根据HapMap中国人数据库,采用Haploview软件。选定CD44基因rs4756195位点作为检测位点,应用PCR确定个体基因型,相关试剂购自美国Santa Cruz公司。
1.4 统计学方法
数据分析采用SPSS 22.0统计软件,计数资料以构成比表示,比较用χ2检验,计量资料以均数±标准差(±s)表示,比较用方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
3组患者年龄﹑性别﹑TMN分期﹑肿瘤直径及分化程度比较,差异无统计学意义(P>0.05)。见表1。
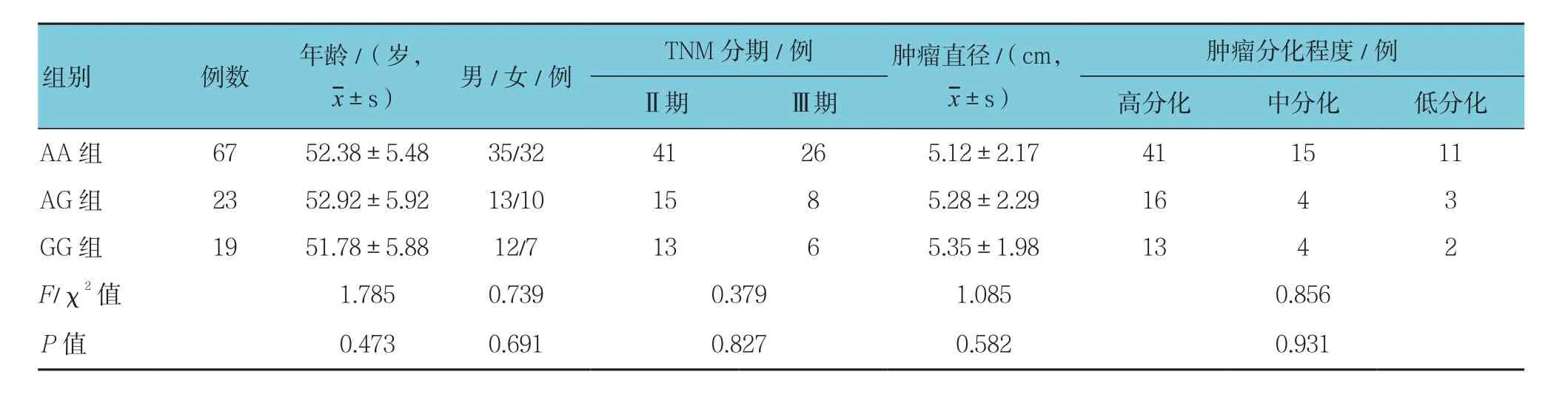
表1 3组患者一般情况比较
2.2 肝癌组织中CD4+ T和CD8+ T细胞的表达
2.2.1 CD4+T细胞 AA组﹑AG组﹑GG组患者CD4+T细胞表达水平比较,经方差分析,差异有统计学意义(F=5.873,P=0.003)。进一步两两比较经LSD-t检验,AG组﹑GG组患者CD4+T细胞表达水平低于AA组(P<0.05);AG组与GG组患者CD4+T细胞表达水平比较,差异无统计学意义(P>0.05)。见表2。
2.2.2 CD8+T细胞 AA组﹑AG组﹑GG组患者CD8+T细胞表达水平比较,经方差分析,差异有统计学意义(F=6.175,P=0.001)。进一步两两比较经LSD-t检验,AG组﹑GG组患者CD8+T细胞表达水平低于AA组(P<0.05);AG组与GG组患者CD8+T细胞表达水平比较,差异无统计学意义(P>0.05)。见表2。
2.3 肝癌组织中Treg和Th17细胞的表达
2.3.1 Treg细胞 AA组﹑AG组﹑GG组患者Treg细胞的表达水平比较,经方差分析,差异有统计学意义(F=7.546,P=0.000)。进一步两两比较经LSD-t检验,AG组﹑GG组患者肝癌组织中Treg水平高于AA 组(P<0.05)。见表 3。
2.3.2 Th17细胞 AA组﹑AG组﹑GG组患者Th17细胞的表达水平比较,经方差分析,差异无统计学意义(F=1.985,P=0.378)。见表 3。
表2 3组患者肝癌组织中CD4+ T和CD8+ T细胞表达水平比较 (%,±s)
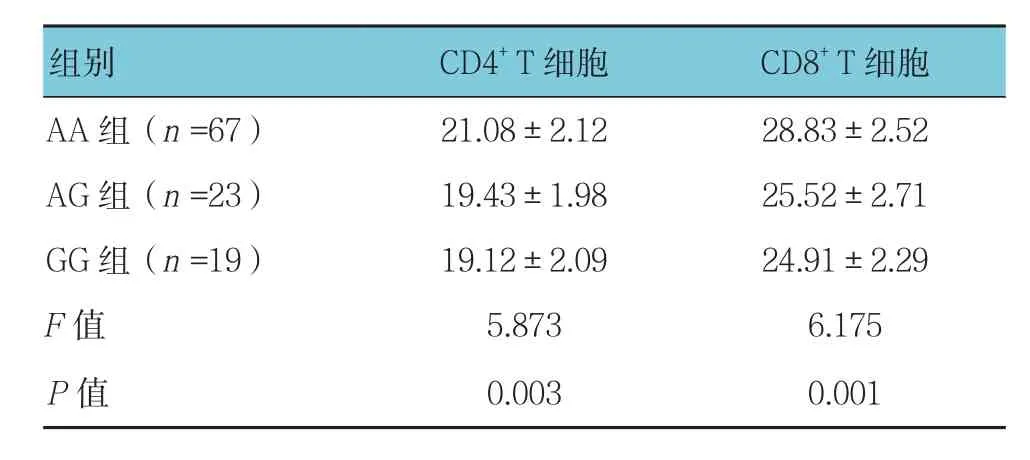
表2 3组患者肝癌组织中CD4+ T和CD8+ T细胞表达水平比较 (%,±s)
AA组(n =67) 21.08±2.12 28.83±2.52 AG组(n =23) 19.43±1.98 25.52±2.71 GG组(n =19) 19.12±2.09 24.91±2.29 F值 5.873 6.175
表3 3组患者肝癌组织中Treg和Th17细胞表达水平比较 (%,±s)
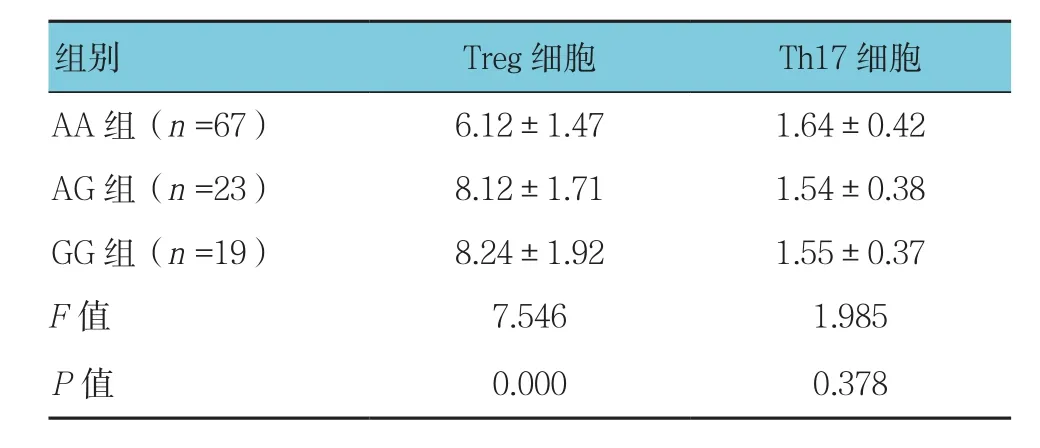
表3 3组患者肝癌组织中Treg和Th17细胞表达水平比较 (%,±s)
AA组(n =67) 6.12±1.47 1.64±0.42 AG组(n =23) 8.12±1.71 1.54±0.38 GG组(n =19) 8.24±1.92 1.55±0.37 F值 7.546 1.985
2.4 肝癌组织中IL-2、IL-10、TGF-β及IL-17的阳性表达
AA组﹑AG组﹑GG组 患 者 的 IL-2﹑IL-10﹑TGF-β阳性表达率比较,经χ2检验,差异有统计学意义(P<0.05)。3组患者IL-17阳性表达率比较,经χ2检验,差异无统计学意义(P>0.05)。见表4。
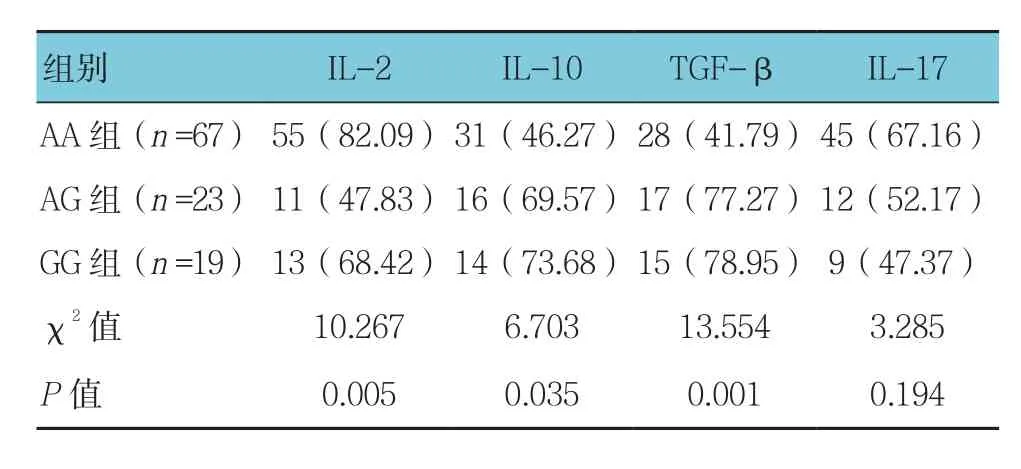
表4 3组患者肝癌组织中IL-2、IL-10、TGF-β及IL-17的阳性表达率比较 例(%)
3 讨论
肿瘤细胞的生物学特性决定肿瘤细胞的生长能力和转移能力,对患者预后具有重大影响。医学的进步虽然使原发性肝癌患者的死亡率有所下降,生存质量有所提高,但是其临床预后仍不理想。目前已知原发性肝癌组织中免疫状态对癌细胞的生长和转移过程具有重大影响,多数肝癌组织中表现为免疫抑制状态,为癌细胞的免疫逃脱提供了良好的条件。T细胞亚群是肿瘤组织中的重要免疫成分,良好的免疫功能状态可以有效杀灭肿瘤细胞,抑制其生长和转移。目前研究较热的肿瘤相关的T细胞亚群主要包括CD4+T﹑CD8+T﹑Treg和Th17细胞。研究证实,在原发性肝癌患者中上述T细胞亚群功能失衡,例如Treg细胞升高,可以抑制免疫系统对肝癌细胞的杀伤作用[9-10]。
CD44基因rs4756195位点多态性对原发性肝癌患者的影响主要通过影响CD44蛋白的合成,从而发挥生理作用。CD44蛋白是一种细胞黏附分子,在肿瘤细胞和T细胞表面表达,主要通过结合细胞外基质,包括胶原蛋白﹑层黏连蛋白﹑硫酸软骨素等,从而发挥其生理作用,介导淋巴细胞的归巢﹑淋巴细胞向炎症部位和黏膜相关淋巴组织归位﹑黏附细胞外基质。CD44蛋白可以募集CD8+T细胞等向局部组织转移[11-12]。而CD8+T细胞可以分化为细胞毒性T细胞,其是杀伤肿瘤细胞的重要免疫细胞[13-14],因此可能增强机体对肿瘤细胞的杀伤作用。另外,CD44还可以通过促进T细胞向抗原呈递细胞迁移﹑增强T细胞与抗原呈递细胞的反应,发挥抗肿瘤效应;其还可以通过调节TCR/CD复合体信号通路,以T细胞活化的共刺激因子身份,参与T细胞的活化。最后,CD44还可以通过延长T细胞的寿命,发挥抗肿瘤细胞效应。目前尚无研究探讨CD44基因rs4756195位点多态性与肝癌组织中T细胞亚群相关性的报道。本研究结果显示,CD44基因rs4756195的多态性分布与原发性肝癌组织中T细胞亚群的分布有关,表现为CD44 rs4756195基因型为AG﹑GG的野生型患者CD4+T﹑CD8+T细胞表达降低,Treg升高,IL-2降低,而TGF-β﹑IL-10升高。IL-2是促炎因子,由活化的免疫性T细胞分泌,又可刺激T活性细胞的募集和增殖;TGF-β﹑IL-10则是免疫抑制因子,可以抑制体内炎症反应。IL-2降低,TGF-β﹑IL-10升高表明机体处于一种免疫抑制状态,提示原发性肝癌组织中CD44 rs4756195基因型为AG﹑GG的野生型患者局部免疫抑制状态更严重。在结肠癌肝转移﹑原发性肝癌等患者中,也证实CD44基因的多态性对肿瘤的生物学特性有重要影响[15-19]。我国学者周鑫等[20]在乳腺癌的研究中也证实,CD44 rs4756195基因型为AG﹑GG的野生型人群更容易发生乳腺癌,且发展更快,预后更差。
综上所述,原发性肝癌患者CD44基因rs4756195位点呈多态性分布,与肝癌组织中的免疫抑制有关。
参 考 文 献:
[1]KIM B H, PARK J W. Epidemiology of liver cancer in South Korea[J]. Clin Mol Hepatol, 2017, 12(3): 784-788.
[2]WILD S H, WALKER J J, MORLING J R, et al. Cardiovascular disease, cancer, and mortality among people with type 2 diabetes and alcoholic or nonalcoholic fatty liver disease hospital admission[J]. Diabetes Care, 2018, 41(2): 341-347.
[3]WONG M C, JIANG J Y, GOGGINS W B, et al. International incidence and mortality trends of liver cancer: a global profile[J].Sci Rep, 2017, 7(4): 5846-5851.
[4]MORALES SORIANO R, MORON CANIS J M, MOLINA ROMERO X, et al. Inf l uence of simultaneous liver and peritoneal resection on postoperative morbi-mortality and survival in patients with colon cancer treated with surgical cytoreduction and intraperitoneal hyperthermic chemotherapy[J]. Cir Esp, 2017,95(4): 214-221.
[5]LI W, MA H, ZHANG J, et al. Unraveling the roles of CD44/CD24 and ALDH1 as cancer stem cell markers in tumorigenesis and metastasis[J]. Sci Rep, 2017, 7(1): 13856-13861.
[6]LI W, QIAN L, LIN J, et al. CD44 regulates prostate cancer proliferation, invasion and migration via PDK1 and PFKFB4[J].Oncotarget, 2017, 8(39): 65143-65151.
[7]LI X, GRIGALAVICIUS M, LI Y, et al. MtDNA depletion influences the transition of CD44 subtypes in human prostate cancer DU145 cells[J]. Tumour Biol, 2017, 39(8): 1010-1014.
[8]MAO M, ZHENG X, JIN B, et al. Effects of CD44 and E-cadherin overexpression on the proliferation, adhesion and invasion of ovarian cancer cells[J]. Exp Ther Med, 2017, 14(6): 5557-5563.
[9]LI F, GUO Z, LIZEE G, et al. Clinical prognostic value of CD4+CD25+FOXP3+regulatory T cells in peripheral blood of barcelona clinic liver cancer (BCLC) stage B hepatocellular carcinoma patients[J]. Clin Chem Lab Med, 2014, 52(9): 1357-1365.
[10]PEDROZA-GONZALEZ A, VERHOEF C, IJZERMANS J N, et al. Activated tumor-infiltrating CD4+regulatory T cells restrain antitumor immunity in patients with primary or metastatic liver cancer[J]. Hepatology, 2013, 57(1): 183-194.
[11]YAO Y, WANG X, ZHOU H, et al. MHC class II peptides induce CD8(+) CD44(+) Ly49(+) regulatory T cells in C57BL/6 mice[J].Cell Immunol, 2017, 312(12): 71-77.
[12]LEE-SAYER SSM, MAESHIMA N, DOUGAN M N, et al.Hyaluronan-binding by CD44 reduces the memory potential of activated murine CD8 T cells[J]. Eur J Immunol, 2018, 12(5):7895-7899.
[13]ZAREI O, YAGHOOBI M M. Cytotoxic effects of fritillaria imperialis L. extracts on human liver cancer cells, breast cancer cells and fibroblast-like cells[J]. Biomed Pharmacother, 2017,94(21): 598-604.
[14]BURANRAT B, MAIRUAE N, KANCHANARACH W.Cytotoxic and antimigratory effects of Cratoxy formosum extract against HepG2 liver cancer cells[J]. Biomed Rep, 2017, 6(4):441-448.
[15]ROZEIK M S, HAMMAM O A, ALI A I, et al. Evaluation of CD44 and CD133 as markers of liver cancer stem cells in Egyptian patients with HCV-induced chronic liver diseases versus hepatocellular carcinoma[J]. Electron Physician, 2017, 9(7):4708-4717.
[16]FANG C, FAN C, WANG C, et al. Prognostic value of CD133(+)CD54(+) CD44(+) circulating tumor cells in colorectal cancer with liver metastasis[J]. Cancer Med, 2017, 6(12): 2850-2857.
[17]PARK N R, CHA J H, JANG J W, et al. Synergistic effects of CD44 and TGF-beta1 through AKT/GSK-3beta/beta-catenin signaling during epithelial-mesenchymal transition in liver cancer cells[J]. Biochem Biophys Res Commun, 2016, 477(4): 568-574.
[18]FANG C, FAN C, WANG C, et al. CD133+CD54+CD44+circulating tumor cells as a biomarker of treatment selection and liver metastasis in patients with colorectal cancer[J]. Oncotarget,2016, 7(47): 77389-77403.
[19]HAN S, GUO J, LIU Y, et al. Knock out CD44 in reprogrammed liver cancer cell C3A increases CSCs stemness and promotes differentiation[J]. Oncotarget, 2015, 6(42): 44452-44465.
[20]周鑫, 吴诚义. CD44基因多态性与乳腺癌遗传易感性及临床病理参数的关系[J]. 四川大学学报(医学版), 2012, 43(6):807-811.

