右美托咪定在大鼠脊髓缺血再灌注损伤中的保护作用及机制研究
江亚楠 梁永新,施彩凤 孙一笑 李少娜

摘 要:目的 探討右美托咪定对大鼠脊髓缺血/再灌注损伤的保护作用及PI3K/Akt传导通路在其中的作用。方法 30只成年雄性大鼠随机分为假手术组、模型组和右美托咪定治疗组,每组10只。建立大鼠脊髓缺血/再灌注损伤模型,对再灌注损伤后6 h、12 h、24 h、48 h实验大鼠后肢运动功能进行评分,检测缺血脊髓前角组织中P-AKT的表达水平及神经元的凋亡指数。结果 右美托咪定可改善脊髓缺血/再灌注损伤后实验大鼠的后肢运动功能(P<0.05);提高脊髓前角P-AKT的表达水平(P<0.05),抑制缺血/再灌注损伤所致的脊髓神经元的凋亡(P<0.05)。结论 右美托咪定对脊髓缺血/再灌注损伤有一定的保护作用,其机制可能与激活PI3K/Akt传导通路,从而抑制神经元的凋亡有关。
关键词:右美托咪定; 再灌注损伤;细胞凋亡;脊髓; PI3K/Akt
中图分类号:R614 文献标识码:A DOI:10.3969/j.issn.1006-1959.2018.07.022
文章编号:1006-1959(2018)07-0069-03
Protective Effects and Mechanism of Dexmedetomidine on Spinal Cord Ischemia-Reperfusion Injury in Rats
JIANG Ya-nan,LIANG Yong-xin,SHI Cai-feng,SUN Yi-xiao,LI Shao-na
(Department of Anesthesiology,Affiliated Hospital of Qingdao University,Qingdao 266003,Shandong,China)
Abstract:Objective To investigate the protective effect of dexmetomidine on spinal cord ischemia/reperfusion injury in rats and the role of PI3K/Akt pathway in it.Methods 30 adult male rats were randomly divided into the sham operation group,the model group and the right metomomidine treatment group,with 10 rats in each group.A rat model of spinal cord ischemia/reperfusion injury was established.The hindlimb motor function was scored at 6 h,12 h,24 h,and 48 h after reperfusion,and the expression of P-AKT in the anterior horn of ischemic spinal cord was detected.Levels and neuronal apoptosis index.Results Dexmedetomidine can improve the hindlimb motor function in rats after spinal cord ischemia/reperfusion injury(P<0.05),increase the expression level of P-AKT in the anterior horn of spinal cord(P<0.05),and inhibit the apoptosis of spinal cord neurons induced by ischemia/reperfusion(P<0.05). Conclusion Dexmedetomidine has a protective effect on spinal cord ischemia/reperfusion injury,and its mechanism may be related to activation of PI3K/Akt conduction pathway and inhibition of neuronal apoptosis.
Key words:Dexmetomidine;Reperfusion injury;Apoptosis;Spinal cord;PI3K/Akt
脊髓供血动脉本身疾患、主动脉手术、脊髓内显微外科手术均可引起脊髓缺血再灌注损伤(reperfusion injury,RI),一般预后较差,致残率很高。右美托咪定(DEX)是一种高选择性的α2肾上腺素受体激动剂,对中枢神经有很多作用,比如镇静、镇痛和麻醉药节俭作用。有研究表明DEX可以改善大鼠短暂缺血脑组织的损伤[1,2],其机制可能与抑制神经元凋亡有关[3]。本研究采用大鼠腹主动脉阻断建立脊髓RI模型,探讨右美托咪定对脊髓RI的保护作用及其机制,为临床应用提供实验依据。
1材料与方法
1.1一般材料 清洁级健康成年雄性Wistar大鼠30只,体质量250~300 g,由青岛市动物实验中心提供;盐酸右美托咪定为江苏新晨制药有限公司提供,(批号H20091256);P-AKT抗体由北京博奥森生物技术有限公司提供;原位细胞死亡检测试剂盒(TUNEL)由武汉博士德公司提供。
1.2方法
1.2.1 实验分组 随机分为3组, A 组:假手术组10例,打开腹腔将腹主动脉暴露,然后关闭腹腔;B组:模型组10例,阻断腹主动脉,30 min后,将腹主动脉开放再灌注; C组:DEX处理组10例,阻断腹主动脉,30 min后将腹主动脉开放再灌注,关闭腹膜前DEX (10 μg/kg)腹腔内注射。
1.2.2動物模型 采用Zivin[3]法复制大鼠脊髓RI模型: 2%戊巴比妥钠40 mg/kg体质量腹腔麻醉,腹正中切口,在无菌条件下打开腹腔,暴露腹主动脉,手术分离腹主动脉至肾动脉水平,用无创伤血管夹在肾动脉起始部远端将腹主动脉夹闭,阻断脊髓血供。30 min后移去血管夹,使脊髓血液再灌注,关闭腹腔,即制成脊髓RI模型。术后常规给予青霉素40万单位肌肉注射,2次/d。
1.2.3 神经功能评分 再灌注6 h、12 h、24 h和48 h,由一名对分组情况不知晓的观察者对大鼠后肢神经功能进行评分。评估标准依据Behrmann (1993) 5点分级法[4]评价大鼠后肢功能。
1.2.4脊髓组织P-AKT的表达及神经元细胞凋亡的检测 再灌注48 h后取L5部位脊髓前角灰质进行检测。采用抗P-AKT多克隆抗体进行免疫组化染色,并采用评分量化表[5]来评价各实验组P-AKT的表达程度。评分标准:0(无表达)、1(阳性)、2(强阳性)。另用末端脱氧核苷酸转移酶(terminal deoxyribonucleotidyl transferase, TdT)介导的带生物素dUTP缺口末端标记(TdTmediated dUTPbiotin nick end labeling, TUNEL)法原位检测缺血再灌注后脊髓组织细胞凋亡的情况,以神经元细胞核染色呈黄色或棕黄色时即为阳性,以凋亡指数(apoptosis index,AI)作为评定标准。凋亡指数判定:每张脊髓组织切片中至少1000个细胞中出现的凋亡细胞的百分数。
1.3统计学处理 本次研究数据采用SPSS 13.0统计软件统计分析,计量资料以(x±s)表示,采用t检验判定各实验组与相应对照组间差异显著性;等级资料采用wilcxon秩和检验;评分给出各分值的例数,组间比较采用非参数(Kruska-Walis)检验。P<0.05表示差异有统计学意义。
2结果
2.1右美托咪定对神经运动功能的影响 假手术组实验大鼠后肢运动功能无异常。模型组和右美托咪定治疗组实验大鼠于缺血再灌注后均出现不同程度的瘫痪。右美托咪定治疗组实验大鼠后肢运动功能的恢复情况要优于模型组(P<0.05),见表1。
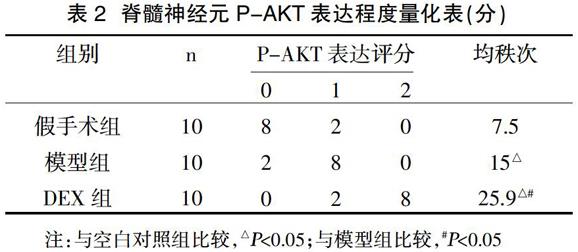
2.2 脊髓神经元P-AKT表达程度 实验结果表明,DEX组P-AKT表达水平强于其它两组,差异有统计学意义(P<0.05)。见表2。
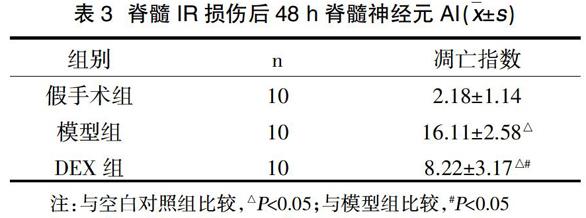
2.3 脊髓神经元凋亡指数的比较 空白对照组脊髓组织未见神经元凋亡,模型组脊髓组织可见大量凋亡神经元。DEX组凋亡神经元较模型组减少,差异有统计学意义(P<0.05),见表3。
3讨论
既往认为,脊髓缺血后神经元的死亡方式为缺血坏死。但近年来研究认为,细胞凋亡可能是脊髓缺血后神经元死亡的主要方式[6]。细胞凋亡,是指机体细胞在发育过程中或在某些因素作用下,通过细胞内基因及其产物的调控而发生的一种程序性细胞死亡。细胞凋亡与细胞坏死不同,细胞凋亡不是一件被动的过程,而是主动过程。细胞凋亡形态学变化的基本特征是:细胞质凝聚,细胞核浓缩,凋亡小体形成。大鼠脊髓缺血再灌注损伤后6 h出现神经元的凋亡,24 h达到高峰,主要出现在脊髓前、后角[7]。常规组织切片染色不易检测出凋亡细胞,而TUNEL法是生物素标记的dUTP在脱氧核糖核苷酸末端转移酶(TdT Enzyme)的作用下,可以连接到凋亡细胞中断裂DNA的3'-OH末端,并与连接辣根过氧化酶(HRP,horse-radish peroxidase)的链霉亲和素streptavidin特异性结合,后者又与POD底物H2O2、二氨基联苯胺(DAB)产生深棕色反应,特异准确地定位正在凋亡的细胞,因而在光学显微镜下即可观察凋亡细胞;由于正常的或正在增殖的细胞几乎没有DNA断裂,因而没有3'-OH形成,很少能够被染色。TUNEL法敏感性和特异性极高,是目前国际上公认的检测凋亡细胞的手段[8]。
细胞凋亡所涉及的因素及信号传导途径非常复杂。最近的研究表明,PI3K / Akt信号通路是细胞重要的生存信号,其激活对保护神经元免受缺血和缺氧损伤至关重要[9-11]。PI3K / Akt信号通路也是膜受体信号转导入细胞的主要途径,可以在维持细胞存活和抑制细胞凋亡中发挥重要作用。通过影响细胞凋亡相关蛋白,细胞周期控制蛋白的激活过程,抑制细胞凋亡和促进细胞增殖[12,13]。PI3K可被细胞外信号激活,如酪氨酸激酶受体,非酪氨酸激酶受体,胰岛素受体,活化的PI3K位于细胞膜中,可进一步激活一系列下游蛋白激酶,如PKA,AKT和PKC,并调控多种病理生理过程,包括增殖,凋亡,迁移和恶性转化。Akt是PI3K信号通路中的下游靶标激酶之一。当细胞被细胞外信号刺激时,活化的PI3K可产生PIP3,其可与Akt的PH结构相互作用,将Akt转移到细胞膜并将其激活成p-Akt,从而增加信号通路的级联反应调节凋亡[14]。AKT也可以对凋亡通路上的其他因子进行磷酸化、抑制细胞凋亡、促进细胞生存。脑缺血再灌注后,通过激活PI3K-AKT通路可减少神经元凋亡,起到神经保护作用。
有研究证实,DEX可以通过PKCα和CREB信号通路激活星形胶质细胞分泌GDNF[15],而后者可以改善损伤后神经元的恢复。本次研究发现,大鼠脊髓RI后,模型组脊髓前角神经元内P-AKT表达强假手术组,表明脊髓发生缺血再灌注损伤后,机体内存在抗细胞凋亡的自我保护机制;与模型组比较,DEX组P-AKT表达水平增高,脊髓神经元凋亡减少,可见DEX可以抑制缺血再灌注后脊髓神经元的凋亡,其机制可能与激活PI3K-AKT通路有关。
本研究表明,DEX可以抑制大鼠脊髓RI后神经元的凋亡,提高再灌注后大鼠后肢6,12,24,48 h的神经功能评分,表明DEX对大鼠脊髓缺血RI有保护作用,其机制可能是DEX刺激脊髓星形胶质细胞分泌GDNF,而后者激活了PI3K-AKT通路,从而抑制了脊髓RI后神经元的凋亡。
参考文献:
[1]Luo C,Ouyang M W,Fang Y Y,et al.Dexmedetomidine Protects Mouse Brain from Ischemia-Reperfusion Injury via Inhibiting Neuronal Autophagy through Up-Regulating HIF-1a[J].Frontiers in Cellular Neuroscience,2017(11):197.
[2]李波,吕国义,邓迺封.右美托咪啶预先给药对大鼠局灶性脑缺血再灌注损伤的影响[J].中华麻醉学杂志,2011,31(11):1381-1383.
[3]Farag E,Argalious M,Sessler DI.Use of α2-Agonists in Neuroanesthesia:An Overview[J].Ochsner J,2011,11(1):57-69.
[4]Behrmann D L,Bresnahan J C,Beattie M S.A comparison of YM-14673,U-50488H,and nalmefene after spinal cord injury in the rat[J].Experimental Neurology,1993,119(2):258-67.
[5]Tsurutani H,Ohkuma H,Suzuki S.Effects of thrombin inhibitor on thrombin-related signal transduction and cerebral vasospasm in the rabbit subarachnoid hemorrhage model[J].Stroke,2003,34(6):1497-1500.
[6]Guo Z D,Sun X C,Zhang J H.Mechanisms of early brain injury after SAH:matrix metalloproteinase 9[J].Acta Neurochirurgica Supplement,2011,110(Pt 1):63.
[7]Momeni H R,Nasimi P.Caspase-dependent apoptosis in motor neurons of adult mouse spinal cord slices[J].Iranian Journal of Science&Technology; Transaction A Science,2014,38(A1):55-60.
[8]Fayzullina S,Martin L J.Detection and analysis of DNA damage in mouse skeletal muscle in situ using the TUNEL method[J].Journal of Visualized Experiments Jove,2014(94):e52211-e52211.
[9]许艺超,石松生.PI3K/Akt信号通路在脑缺血神经元凋亡中作用的研究进展[J].国际神经病学神经外科学杂志,2012,39(6):530-533.
[10]Buck C R,Seburn K L,Cope T C.Neurotrophin expression by spinal motoneurons in adult and developing rats[J].Journal of Comparative Neurology,2015,416(3):309-318.
[11]Renfu Q,Rongliang C,Mengxuan D,et al.Anti-apoptotic signal transduction mechanism of electroacupuncture in acute spinal cord injury[J].Acupunct Med 2014(32):463-471.
[12]Ersahin T,Tuncbag N,Cetin-Atalay R.The PI3K/AKT/mTOR interactive pathway[J].Molecular Biosystems,2015,11(7):1946.
[13]Martinez-Morales PL,Revilla A,Ocana I,et al.Progress in stem cell therapy for major human neurological disorders[J].Stem Cell Rev,2013(9):685-699.
[14]Yu Z H,Cai M,Xiang J,et al.PI3K/Akt pathway contributes to neuroprotective effect of Tongxinluo against focal cerebral ischemia and reperfusion injury in rats[J].Journal of Ethnopharmacology,2016,181:8.
[15]Yan Min,Dai Haibin,Ding Tingting,et al.Effects of dexmedetomidine on the release of glial cell line-derived neurotrophic factor from rat astrocyte cells[J].Neurochemistry international,2011,58(5):549-557.
收稿日期:2017-11-23;修回日期:2018-1-21
編辑/李桦

