一例由后备猪引进导致的猪蓝耳病
杜丽飞,邱美珍,*,李 杰,王 慧 , 杨 俊 , 周望平
(1.湖南省畜牧兽医研究所,湖南长沙 410100;2.湖南鑫广安农牧股份有限公司)
高致病性猪蓝耳病(porcine reproductive and respiratory syndrome,PRRS)的流行曾给养猪业造成了巨大的经济损失,它的出现还导致猪场长期不稳定,保育仔猪育成率降低,育肥猪饲料回报少。随着蓝耳病弱毒苗的广泛多次使用,该疾病得到了有效的控制,但是该病毒一直在猪场循环,小规模的低毒力的猪蓝耳病时有发生,它不仅容易被忽视,而且造成的经济损失和猪场的不稳定也同样不容乐观。现将一起由后备猪引进导致的蓝耳病疫情,诊治过程报告如下,旨在为猪场蓝耳病防治提供一些借鉴。
1 发病情况
湖南岳阳某规模猪场基础母猪900头,2017年8月13日从某蓝耳病阳性猪场(该场在2月份发生过蓝耳病)引种后备母猪100头,放大栏隔离,隔离期间大栏还关有肥猪;因引进后备猪已经达到配种条件,1周后开始配种,转定位栏;8月28日开始有母猪流产,2周内流产12胎,怀孕前期流产4胎、中期流产2胎、后期流产6胎,伴有母猪体温升高,空怀返情母猪增多。猪场蓝耳病免疫情况:江西株蓝耳病疫苗每年4次。
2 临床特征
流产母猪低烧(38.8~39.2℃),食欲下降,发病期大约为4~5 d,最先流产母猪为怀孕早期(怀孕35 d),流产4头,流产胎儿除皮肤颜色较红,其他正常,母猪外阴稍微红肿。随后流产母猪为怀孕后期(怀孕期90 d),流产胎儿外观正常。最后流产的为怀孕中期(孕60 d),流产胎儿皮肤暗红色,全身广泛性出血,头部有淤血。当月流产率为7.8%,期间返情母猪和空怀母猪数量增加。
3 病理剖检变化
对流产胎儿进行剖检,早期流产胎儿看不出病变,中期流产胎儿皮肤暗红色,心、肝,脾、肺等内脏出血严重,头部有淤血,大脑果冻样。后期流产胎儿仅皮肤略红,脐带部位出血,解剖内脏没有明显病变。
4 病原检测
无菌采集5份流产胎儿(取其肝、脾、肺、肾、脑等组织器官研磨备用)、6份公猪精液、5份流产母猪血清进行分子生物学检测,检测项目有猪蓝耳病毒、猪伪狂犬病毒、猪瘟病毒、乙脑病毒、猪细小病毒,结果显示16份样品中仅1份血清检测到蓝耳病毒阳性,流产胎儿和公猪精液中没有检出蓝耳病毒。所有样品均未检出猪伪狂犬病毒、猪瘟病毒、乙脑病毒、猪细小病毒。
5 血清学检测
全群包括空怀流产母猪,空怀母猪,怀孕母猪,哺乳母猪,后备母猪,育肥猪,进行蓝耳病(PRRSV)抗体检测。由表1可知,流产母猪,蓝耳S/P平均值都大于3.0;怀孕母猪S/P平均值大于3.0的比例占17%;引进后备猪S/P平均值大于3.0的比例占20%;从抗体水平判断,蓝耳波动较大,处于不稳定阶段;S/P平均值:流产母猪(3.1)>空怀母猪(2.76)>后备猪(2.6)>定位栏怀孕母猪(2.0)> 断奶母猪(1.70)>哺乳母猪(1.18);S/P值>2.5占比例:流产母猪(100%)>=空怀母猪(100%)>后备猪(80%)>返情母猪(50%) >定位栏怀孕母猪(39.1%)> 断奶母猪(20%)>哺乳母猪(0)。从以上数据推测蓝耳病毒在猪场的感染流行过程,后备猪→定位栏怀孕母猪→断奶母猪→育肥(待售种猪)。
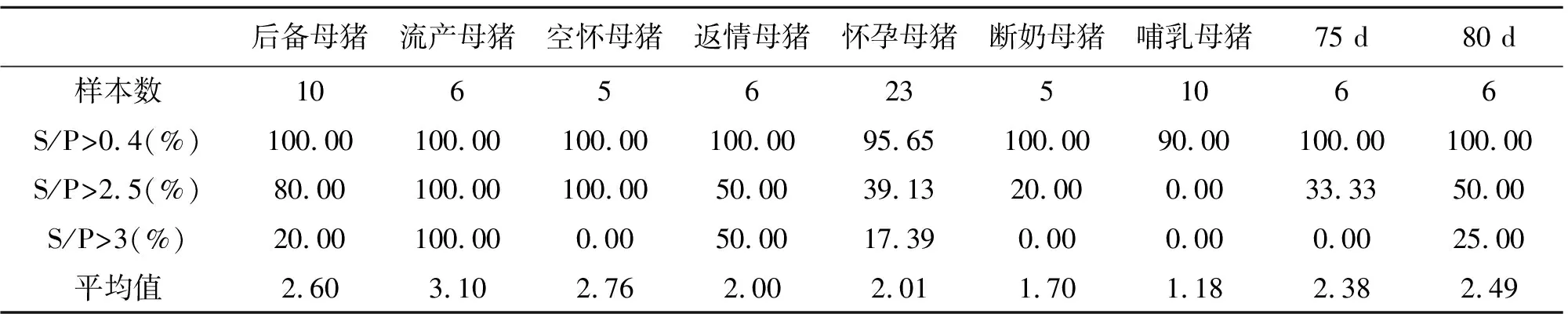
表1 蓝耳病抗体检测结果
6 诊断
通过临床症状,病理变化、实验室检测及发病特点分析,诊断该猪场母猪流产的主要原因是蓝耳病。
7 防治措施
猪场发现流产开始全群保健,400g/T泰万菌素连用7d,停药;对该疫情反应及时,尽量减少了大面积流产,因是蓝耳病毒引起的疾病,未能完全控制流产情况。2周后生产才逐渐恢复正常。
8 讨论与建议
8.1 引进猪隔离观察时间段
后备猪引进须隔离至少35 d以上确保混群前蓝耳抗体水平一致,蓝耳病是PRRSV引起的繁殖与呼吸障碍综合征,各个阶段猪都易感,每个阶段感染蓝耳病的临床特点不一样,目前的弱毒疫苗接种能控制疫病大面积流行,但病毒始终在猪场循环、变异、重组,猪群具有持续感染的特点,可通过唾液、精液、乳汁和排泄物等传播。当猪场有引种、断奶、转群、并群等不利因素影响时,蓝耳病的控制重点应放在生产管理和生物安全上。本案例显示了由后备母猪引进(引进场2月份发生蓝耳病)造成流产,更应引起猪场生物安全管理的思考。建议:①后备母猪引种隔离至少35 d以上,做好常规苗的补免工作;②混群前,检测本场和引种后备猪蓝耳抗体情况,抗体水平尽量控制在同一水平;③混群前,后备猪与待配断奶母猪做相应保健,防止病原交叉感染;④如果后备猪过大,急需配种,做到隔离饲养,不能与本场配种母猪混群。
8.2 蓝耳病毒检测阴性仍会发生疫情
一般来说,临床疾病的发生以及病理损伤程度与病毒最高滴度出现的时间和组织有关,蓝耳病感染后7~14 d引起肺脏和淋巴结的病毒滴度最高,高的病毒血症可能还在此之前,出现时间一般为猪体温升高时,血清中病毒达到高峰后迅速降低。Wills在报告中指出一般猪只在感染后28 d不会再出现病毒血症,通过PCR方法检测病原的阳性率也很低,本案例结果显示流产胎儿和精液中都没有检测到蓝耳病原阳性,5份血清中仅1份蓝耳病原阳性也证实了这一点。同时,Fairbank研究表明高病毒血症时期蓝耳抗体水平不足够清除病毒,PRRSV在敏感细胞内复制几个月并不表现出临床症状,形成持续感染。还有PRRSV在低抗体水平情况下会导致产生抗体依懒性增强(ADE),病毒逃避抗体动物主动免疫反应的机制尚不清楚。这提醒蓝耳病阳性猪场尽管有蓝耳抗体,病原检测阳性率很低,但当有外界抗原进入时,蓝耳病仍然还会发生。
8.3 流产胎儿或者精液中可能检不到病原
从本次病原的检测结果还看出,精液和流产胎儿中没有检测到病原。
Chirstopher-Hennings证实PRRSV的排毒时间很长,公猪精液的排毒时间甚至达到92 d,但本次结果中公猪精液没有检测到PRRSV,可能公猪并不在PRRSV的排毒期。猪病学指出PRRSV能在母猪怀孕14 d以后的胎儿体内复制,但大多数PRRSV仅能在怀孕后期通过胎盘屏障进入胎儿体内,因此怀孕前期和中期一般很难检测到病原。就算母猪感染PRRSV后产下的同窝仔猪中,也是有些仔猪感染PRRSV,有些仔猪不感染PRRSV。这充分说明了流产胎儿PRRSV病原检出率低。母体感染PRRSV后,在怀孕不同阶段病毒通过母体胎盘的机理和母体感染病毒引起流产的机制是很有意思的课题,值得深入研究。
参考文献:
[1] 马健,陈永刚,李珊倩,等.猪蓝耳病的诊断和防治[J].畜牧兽医杂志,2017 , 36 (1) :140-142.
[2] wills R,Doster A,Galeota J,et al. Duration of infection and proportin of pigs persistently infected with poricne reproductive and respiratory syndrome virus[J]. J Clin Microbiol, 2003, 41:58-62.
[3] Fairbanks K,Chase C,Benfield DA.Tonsil biopsies and polymerase chain reaction assay for detection of breeding age gilts persistently infected with poricne reproductive and respiratory syndrome virus[J].J Swine Health Prod,2002,10(2):87-88.
[4] Chirstopher-Hennings J,Nelson EA,Nelson JK,et al .Effects of a modified-live vaccine against poricne reproductive and respiratory syndrome in boars[J].Am J Vet Res,1997,58:40-45.
[5] Straw BE, Zimmerman JJ, Allaire SD,et al. Disease of swine.[M]。赵德明,张仲秋,沈建忠,译.猪病学[M],北京:中国农业出版社,2008:423-445.

