CIMMYT小麦种质C615抗叶锈病QTL分析
李玉玲 蒋正宁 胡文静 李东升 程婧晔 裔 新 程晓明 吴荣林 程顺和,,*
CIMMYT小麦种质C615抗叶锈病QTL分析
李玉玲1蒋正宁2胡文静2李东升2程婧晔3裔 新1程晓明2吴荣林2程顺和1,2,*
1南京农业大学, 江苏南京 210095;2江苏里下河地区农业科学研究所 / 国家小麦改良中心扬州分中心, 江苏扬州 225007;3扬州大学农学院, 江苏扬州 225009
由引起的叶锈病是小麦主要病害之一, 引进种质C615具有叶锈病成株期抗性, 但其抗病性遗传机制尚不清楚。本研究以抗病亲本C615与高感叶锈病亲本宁麦18构建的F2:7代重组自交系群体为材料, 利用337对多态性SSR标记构建遗传连锁图谱, 结合2016、2017连续两年的叶锈病鉴定结果进行复合区间作图, 结果在1BL、2DS、3BS、4DL和6BS染色体上共发现了5个抗性QTL, 暂命名为、、、和。其中,、和在两年均被检测到, 分别解释10.1%~15.7%、10.9%~13.5%和8.2%~9.0%的表型变异; 另2个QTL只在一年被检测到, 解释6.2%和9.2%的表型变异。除外的4个抗性QTL均来源于抗病亲本C615。和分别与已报道的慢病性基因、在同一区域,可能为一个新的抗叶锈病QTL。此外, 本研究在C615/扬麦13 (轮回亲本)BC4F5回交群体中选出了15个农艺性状优良且抗叶锈病的株系, 利用与C615所含抗性QTL紧密连锁的7个SSR标记对其进行基因型检测, 结果显示所有这15个株系均含有来自C615的抗性QTL, 且有3个株系聚合了全部抗性位点, 表明C615可作为抗源亲本用于高产、抗病育种。本研究结果将为分子标记选育抗叶锈品种提供材料和技术支撑。
小麦; 叶锈病; QTL; 标记辅助选择育种
小麦叶锈病是由叶锈菌()引起的真菌性病害, 是世界范围内分布最广泛的小麦病害之一。该病害主要侵染小麦叶片, 进而影响光合作用, 导致感病品种灌浆不足、粒重下降, 严重时可使小麦减产40%以上[1]。近年来, 由于全球气候变暖, 气候条件更加适合小麦叶锈菌的生长与繁殖, 小麦叶锈病的发生日益严重[2]。选育和种植抗病品种是应对叶锈病危害的最经济、安全的途径。
小麦对叶锈病的抗性按照其生长发育阶段可分为苗期抗性和成株抗性。苗期抗性一般为主基因控制, 多表现为小种专化性抗性, 在全生育期表现抗病。与苗期抗性对应的是成株抗性, 一般受微效多基因控制, 在苗期表现感病, 但在成株期表现较好的耐病性[3]。与苗期抗性相比, 成株抗性减少了对病原小种的选择压力, 不易引起病原菌变异, 因而表现出更好的持久抗性[4]。目前国际上已发现了100多个小麦抗叶锈病基因, 其中正式命名的有76个, 具有成株抗性的仅有[5-10][11-13]、[14-15]、[16]等11个[17]。利用成株期抗性基因容易做到兼抗与持久抗性的结合, 已经定名的、和等慢病基因都具有这一特点, 即表现出对叶锈、条锈、白粉及秆锈病的兼抗性。除此之外, Rosewarne等[18]、Crossa等[19]和Ren等[20]还在2BS、3BS、4BL和6BS染色体上发现了多个兼抗小麦叶锈、条锈和白粉病的基因簇。这些基因的发现为培育兼抗多种病害的持久抗病品种提供了可能。
20世纪80年代中期以后我国长江下游麦区叶锈病较少发生, 即使发生范围也较小, 严重度较轻。但最近几年, 叶锈病危害呈急剧上升势头, 严重度显著高于常年, 对小麦产量造成重大损失[21-22]。由于本麦区小麦品种大多不具有叶锈病抗性, 发掘利用新的抗叶锈病基因资源具有重要意义。从国际玉米小麦改良中心(CIMMYT)引进的小麦种质C615成株期对叶锈病表现出较好的抗性, 但尚未见其抗病位点和染色体分布等报道。本研究旨在通过构建C615/宁麦18组合的RIL群体, 结合田间叶锈病严重度鉴定, 发掘C615中叶锈病抗性QTL及其紧密连锁标记, 为进一步利用该抗病资源及标记辅助抗叶锈病育种提供技术支撑。
1 材料与方法
1.1 试验材料及田间试验
以高感叶锈病品种宁麦18为母本, C615 (系谱为SABUF/3/BCN//CETA/AE.SQUARROSA(895))为父本进行杂交, F1代用单粒传法得到包含112个家系的RIL群体(F2:7代)。此外, 以C615为供体亲本, 综合性状优良但高感叶锈病品种扬麦13为轮回亲本构建了包含255个家系的BC4F5回交群体, 经过两年表型鉴定, 获得15个农艺性状较好的抗病株系(编号BL-1~BL-15)。2015—2016和2016— 2017连续2个生长季(简称为2016年和2017年), 将亲本、RIL群体及回交群体种植于江苏里下河地区农业科学研究所万福基地试验田, 采用随机区组设计, 3次重复, 行长1.3 m, 行距0.3 m, 每行点播40粒。
1.2 田间抗叶锈性鉴定
采用田间自然发病鉴定叶锈病, 在小麦成株期目测植株叶片上叶锈菌孢子堆占叶片总面积的百分比[23], 将每个家系叶锈病平均严重度分为1%、5%、10%、25%、40%、65%、80%和100%共8个等级。待感病亲本宁麦18的发病严重度达到80%时, 进行第一次严重度调查记录; 当宁麦18发病严重度达到100%时进行第二次调查, 此发病高峰时所达到的严重度称为最终严重度(final disease severity, FDS)。用SPSS 22软件进行统计分析和显著性比较。
1.3 SSR标记分析
苗期进行田间取样, 采用改良的CTAB法提取基因组DNA[24]。利用2423对SSR引物对两亲本基因组DNA进行扩增, 其中357对的扩增产物存在多态性, 从中筛选出条带清晰且均匀分布于21条染色体上的337个标记检测RIL群体112个家系。
为明确15个BC4F5回交株系的叶锈病抗性QTL组成, 利用与C615抗性QTL紧密连锁的7个SSR标记进行基因型检测。其中,的连锁标记有、和,的连锁标记有和,的连锁标记为,的连锁标记为。
1.4 连锁图谱的构建及QTL定位
利用JoinMap 4.0软件构建连锁图谱, 按照Kosambi作图函数将标记间的重组交换率转化成遗传图距单位(cM)[25], 获得由238对SSR标记组成的48个连锁群, 总长1196.53 cM, 覆盖小麦21条染色体, 标记间平均距离为5.03 cM。结合田间叶锈病FDS表型数据, 使用Win QTLCart 2.5软件以复合区间作图法进行小麦成株期抗叶锈性QTL分析[26], LOD阈值设置为2.5。
2 结果与分析
2.1 亲本及RIL群体的抗病性表现
2016年总体发病较2017年重, 但发病趋势一致。抗病亲本C615成株期叶锈病FDS为5%, 而感病亲本宁麦18、扬麦13两年FDS均达到100%, 发病充分(图1)。两年的群体平均FDS分别为55.41%和46.72%, 家系FDS范围分别为5%~100%和3%~ 100%, 均呈连续性分布(表1和图2), 符合数量遗传特征。

图2 RIL群体2016年和2017年叶锈病最终严重度频次分布
亲本C615和宁麦18的最终病害严重度分别为5%和100%。
The final disease severities of parents were 5% for C615 and 100% for Ningmai 18.
2.2 叶锈病抗性QTL分析
两年共发现5个抗叶锈病QTL, 分布在5条染色体上(表2和图3), 单个位点的表型贡献率为6.2%~15.7%, 除的抗性等位基因来自宁麦18 (加性效应为正)外, 其余4个QTL的抗性等位基因来自C615 (加性效应为负)。有3个QTL被两年重复检测到, 分别是、和, 效应较大且稳定; 另外2个QTL仅在一年被检测到, 并且表型贡献率较小(表2)。

表2 叶锈病抗性QTL定位结果

图3 C615/宁麦18 RIL群体中检测到的叶锈病抗性QTL在染色体上的分布
2.3 抗性QTL可靠性分析
根据、和基因型, 将112个家系分为8种类型(表3), 分别用两年的FDS及其平均值进行类型间差异分析。有9个家系同时含有这3个QTL, 其发病严重度显著低于其他类型; 49个家系含有任意2个抗性QTL, 以同时含有和的家系抗病性较高; 含有1个抗性QTL的家系FDS普遍较高(50.6%~79.8%); 不含有抗性QTL的家系发病最重, 平均FDS在80%左右。说明聚合2个或2个以上抗性位点对降低叶锈病严重度效果明显。

表3 C615/宁麦18 RIL群体中聚合不同稳定QTL家系的抗性效应
数据后不同字母表示不同基因型间差异显著(< 0.05)。
Different letters after data indicate significant difference among genotypes (< 0.05).
此外, 利用与紧密连锁的分子标记检测所有家系显示, 没有该位点的家系平均FDS为65.2%, 变化范围是15%~100%; 而具有该位点的家系, 其平均FDS为36.9%, 变化范围是1%~80% (图4)。可见, 该QTL在两年自然发病的情况下均能明显降低病害严重度, 推测是一个稳定有效的抗病QTL。
2.4 C615中的抗性QTL在15个BC4F5回交株系中的聚合
利用与C615抗性QTL紧密连锁的7个SSR标记检测15个表现抗病的BC4F5株系, 结果所有株系均含有C615的抗性等位基因, 其中3个株系聚合了4个来自C615的抗性位点, 仅有1个株系含单个抗性位点。13个株系为基因型, 且其中9个株系为+基因型。表明对降低叶锈病严重度发挥了重要作用, 且其与的聚合能有效提高抗病性(表4), 与RIL群体检测结果相吻合。
3 讨论
3.1 定位结果与已知抗病基因的比较
在C615和宁麦18中共检测到5个抗叶锈病QTL, 其中位于1BL、3BS和4DL染色体上的QTL两年环境下均能被检测到, 是稳定的QTL。其中, 来源于抗病亲本C615的主效QTL, 标记区间为, 根据系谱推测该位点很可能来自硬粒小麦CETA, 并与墨西哥小麦Pavon76中发现的(贡献率为55.8%)[27-28]非常接近, 但是在本试验中的表型贡献率较小。另外, C615 (系谱为SABUF/3/BCN//CETA/AE. SQUARROSA(895))与Pavon76 (系谱为Vicams71// Cianof67/Siete Cerrost66/3/Kalyansona/Bluebird)没有亲缘关系, 二者是否存在等位关系还需进一步验证。本研究发现在降低叶锈病严重度上有重要作用, 可作为有效的抗病基因应用于本麦区抗叶锈病育种。

图4 含有和不含QLr.njau-3BS家系的最终病害严重度比较
最终病害严重度为两年平均值。RIL群体中含有和不含家系数分别是53和59。
Final disease severity was the mean value of two years. In the RIL population, 53 and 59 lines wereand non-genotype, respectively.
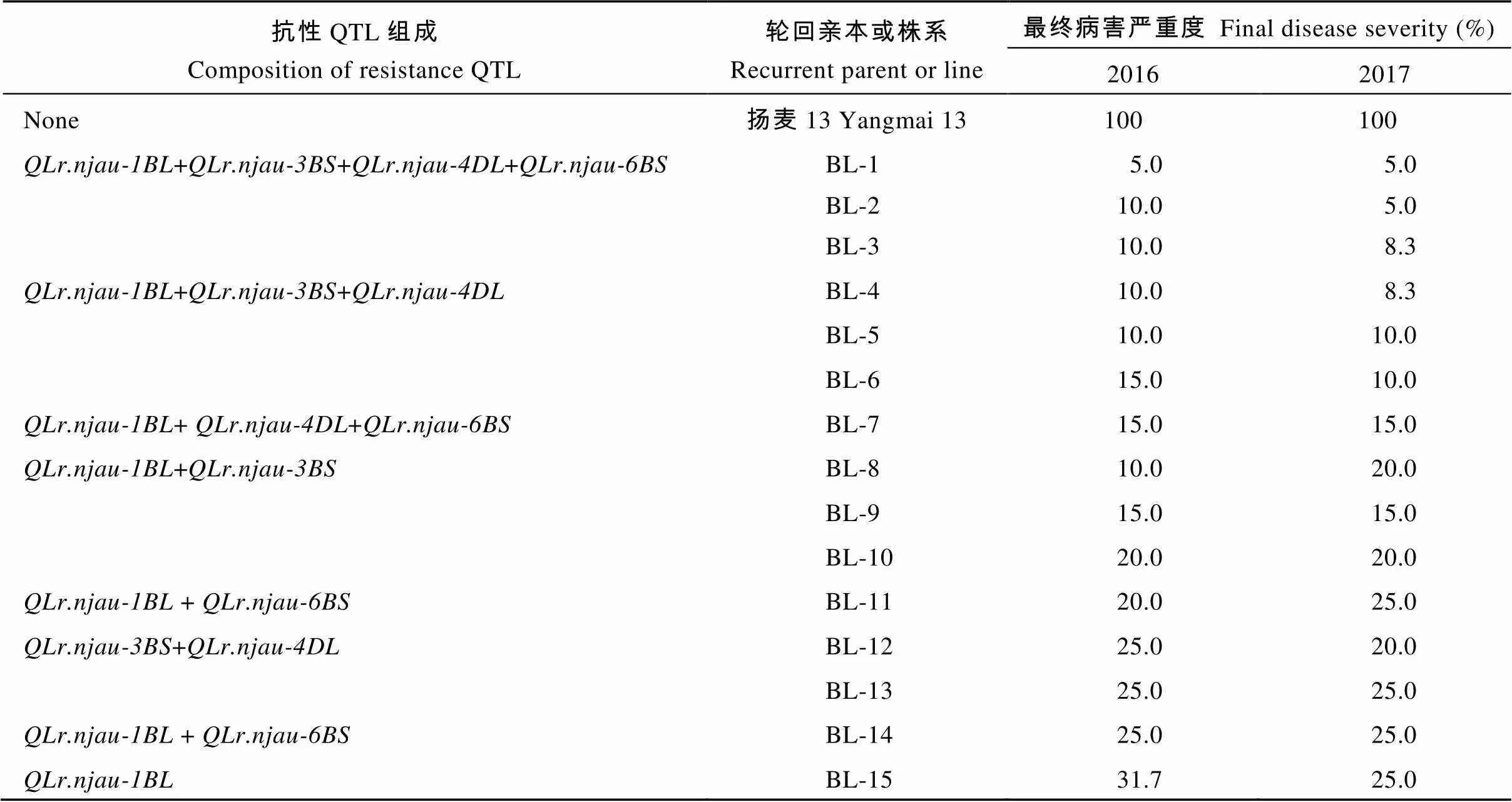
表4 15个回交株系的抗性QTL组成及叶锈病抗性
Herrera等[14]和Hiebert等[15]将定位在4DL染色体上, 并发现与其紧密连锁的标记和。本研究定位的, 其标记区间为, 两标记间的遗传距离为3 cM, 包含与紧密连锁的, 推测这个位点的抗性可能由提供, 其关系有待进一步验证。
位于3BS染色体上的, 标记区间为–, 贡献率为10.9%~13.5%。该染色体上已定位了4个抗叶锈QTL, 分别是[29]、[30]、[31]和[3]。其中,位于着丝粒附近;为小种专化性抗病基因, 与均位于3B染色体短臂末端;位于标记和之间, 与的遗传距离超过20 cM。因此推测,可能是一个新的抗叶锈病位点。此外, 本研究发现与的聚合能有效降低病害严重度, 说明在抗叶锈育种中可能具有较大的应用潜力。本试验并没有对C615进行苗期鉴定, 因而是否为成株抗性基因值得进一步研究。
位于2DS和6BS染色体上的QTL只能在一年环境下被检测出来, 受环境因子影响较大, 但效应较大, 能解释表型变异的9.2%, 其有效性还需进一步验证。
3.2 QTL聚合效应分析
本研究发现对降低病害严重度有重要作用。当该位点单独存在时, 多数家系的FDS在50%以上, 但当它与其他QTL聚合, 特别是与聚合时, 病害严重度明显降低, 并且聚合包含的3个稳定QTL的家系具有较好的叶锈病抗性, FDS变化范围为11.1%~21.1%, 显著低于含有2个或2个以下抗性QTL家系的FDS。利用15个回交系检测, 也得到相似结论, 说明多个抗病基因的聚合能表现出基因的互作与累加效应。Singh等[32]报道基因单独存在时可致产量损失31%~52%, 而与3~4个微效基因聚合时产量损失小于10%。因而, 利用与、等抗病基因紧密连锁的分子标记对抗病品种或品系进行辅助选择, 从而将多个抗病基因聚合到同一品种中, 对于持久抗病品种的选育具有重要意义。
3.3 抗叶锈资源的选育
近3年小麦叶锈病危害急剧上升, 长江下游麦区逐渐成为易感区, 本麦区品种大多不具有叶锈病抗性, 如果长期使用单基因抗性势必面临强大的寄主选择压力, 抗病基因会逐步丧失抗性。因而有针对性地培育多基因聚合的持久抗锈品种显得十分迫切且重要。多年来, C615对小麦叶锈病一直保持着较好的抗性水平, 是一个很好的抗病资源。为改良感叶锈病栽培品种扬麦13, 本研究以C615为供体亲本构建回交群体, 结合分子标记检测结果, 获得了15个聚合不同抗病QTL且农艺性状均优于扬麦13的株系, 可作为优质、抗叶锈材料用于进一步的育种研究。同时该工作也表明C615作为抗病性强的种质资源, 在抗病品种的选育中具有较大的应用价值, 可利用本研究获得的与抗病基因紧密连锁的分子标记辅助选择, 将其用于现有品种的改良或培育新的持久抗叶锈品种。
4 结论
利用CIMMYT抗叶锈病种质C615与感病品种构建分离群体, 鉴定出5个抗病QTL, 其中位于1BL、4DL和3BS上的QTL效应较强, 对标记辅助选择抗叶锈病育种价值较大。3BS上的可能是一个新的抗病位点, 其与的聚合能明显降低病害严重度, 可作为有效的抗病基因用于育种研究。以C615为供体, 对扬麦13进行抗锈病性状回交改良, 获得了15个农艺性状优于扬麦13的抗病株系, 说明C615在抗锈品种的选育中具有较大的应用潜力, 可结合本研究中获得的与抗病基因紧密连锁的分子标记, 将其用于选育具有持久抗性的小麦新品种。
[1] Khan M H, Bukhari A, Dar Z A, Rizvi S M. Status and strategies in breeding for rust resistance in wheat., 2013, 4: 292–301
[2] Singh D, Mohler V, Park R F. Discovery, characterization and mapping of wheat leaf rust resistance gene., 2013, 190: 131–136
[3] Zhang P P, Yin G H, Zhou Y, Qi A Y, Gao F M, Xia X C, He Z H, Li Z F, Liu D Q, QTL mapping of adult-plant resistance to leaf rust in the wheat cross Zhou 8425B/Chinese Spring using high-density SNP markers., 2017, 8: 793–805
[4] Do Vale F X R, Parlevliet J E, Zambolim L. Concepts in plant disease resistance., 2001, 26: 577–589
[5] Spielmeyer W, Mcintosh R J, Lagudah E. Powdery mildew resistance andgenes for durable resistance to leaf and stripe rust cosegregate at a locus on the short arm of chromosome 7D of wheat., 2005, 111: 731–735
[6] Bariana H S, Hayden M J, Ahmed N U, BellJ A, Sharp P J, McIntosh R A. Mapping of durable adult plant and seedling resistances to stripe rust and stem rust diseases in wheat., 2001, 52: 1247–1255
[7] Suenaga K, Singh R P, Huertaespino J, William H M. Microsatellite markers for genesand other quantitative trait loci for leaf rust and stripe rust resistance in bread wheat., 2003, 93: 881–890
[8] Schnurbusch T, Paillard S, Schori A, Messmer M, Schachermayr G, Winzeler M, Keller B. Dissection of quantitative and durable leaf rust resistance in Swiss winter wheat reveals a major resistance QTL in thechromosomal region., 2004, 108: 477–484
[9] Schnurbusch T, Bossolini E, Messmer M, Keller B. Tagging and validation of a major quantitative trait locus for leaf rust resistance and leaf tip necrosis in winter wheat cultivar Forno., 2004, 94: 1036–1041
[10] Zhang P P, Zhang Y Q, Han B, Gao P, Liu L, Xing L, Li Z F, Liu D Q. QTL mapping of adult-plant resistance genes to leaf rust and stripe rust in CIMMYT wheat Kingbird and PBW343., 2014, 54: 1907–1925
[11] William M, Singh R P, Huerta-Espino J, Islas S O, Hoisington D. Molecular marker mapping of leaf rust resistance geneand its association with stripe rust resistance genein wheat., 2003, 93: 153–159
[12] Singh R P, Mujeebkazi A, Huertaespino J.: a gene conferring slow-rusting resistance to leaf rust in wheat., 1998, 88: 890–894
[13] Lan C, Basnet B R, Singh R P, Huerta-Espino J, Herrera-Foessel S A, Ren Y, Randhawa M S. Genetic analysis and mapping of adult plant resistance loci to leaf rust in durum wheat cultivar Bairds., 2017, 130: 609–619
[14] Herrera-Foessel S A, Lagudah E S, Huertaespino J, Hayden M J, Bariana H S. New slow-rusting leaf rust and stripe rust resistance genesandin wheat are pleiotropic or closely linked., 2011, 122: 239–249
[15] Hiebert C W, Thomas J B, McCallum B D, Humphreys D G, De Pauw R M, Hayden M J, Mago R, Schnippenkoetter W, Spielmeyer W. An introgression on wheat chromosome 4DL in RL6077 (Thatcher*6/PI 250413) confers adult plant resistance to stripe rust and leaf rust ()., 2010, 121: 1083–1091
[16] Herrera-Foessel S A, Singh R P, Huerta-Espino J, Rosewarne G M, Periyannan S K, Viccars L, Calvo-Salazar V, Lan C, Lagudah E S.: a new gene conferring slow rusting resistance to leaf rust in wheat., 2012, 124: 1475–1486
[17] Li Z F, Lan C X, He Z H, Singh R P, Rosewarne M R, Chen X M, Xia X C. Overview and application of QTL for adult plant resistance to leaf rust and powdery mildew in wheat., 2014, 54: 1907–1925
[18] Rosewarne G M, Singh R P, Huerta-Espino J, Rebetzke G J. Quantitative trait loci for slow-rusting resistance in wheat to leaf rust and stripe rust identified with multi-environment analysis., 2008, 116: 1027–1034
[19] Crossa J, Burgueño J, Dreisigacker S, Vargas M, Herrera-Foessel S A, Lillemo M, Singh R P, Trethowan R, Warburton M, Franco J, Reynolds M, Crouch J H, Ortiz R. Association analysis of historicalbread wheat germplasm using additive genetic covariance of relatives and population structure., 2007, 177: 1889–1913
[20] Ren Y, Li Z, He Z H, W Ling, Bai B, Lan C X, Wang C F, Zhou G, Zhu H Z, Xia X C. QTL mapping of adult-plant resistances to stripe rust and leaf rust in Chinese wheat cultivar Bainong 64., 2012, 125: 1253–1262
[21] Zhou H X, Xia X C, He Z H, LI X, Wang C F, Li Z F, Liu D Q. Molecular mapping of leaf rust resistance genein Chinese wheat line Neijiang 977671., 2013, 126: 2141–2147
[22] 彭红, 吕国强, 王江蓉. 河南省2015 年小麦主要病害发生特点及原因分析. 中国植保导刊, 2016, 36(4): 29–33 Peng H, Lyu G Q, Wang J R. Analysis on the characteristics and causes of main diseases of wheat in Henan province in 2015., 2016, 36(4): 29–33 (in Chinese)
[23] Peterson R F, Campbell A B, Hannah A E. A diagrammatic scale for estimating rust intensity on leaves and stems of cereals., 1948, 26: 496–500
[24] 张晓祥, 王玲, 寿路路. 一种快速提取小麦基因组DNA的改良CTAB方法. 中国农学通报, 2012, 28(36): 46–49 Zhang X X, Wang L, Shou L L. A rapid modified CTAB method of extracting genomic DNA from wheat leaf.., 2012, 28(36): 46–49 (in Chinese with English abstract)
[25] 张利军, 李在峰, Morten L, 夏先春, 刘大群, 杨文香, 罗家传, 王海燕. CIMMYT小麦品种Saar的叶锈成株抗性QTL分析. 中国农业科学, 2009, 42: 388–397 Zhang L J, Li Z F, Morten L, Xia X C, Liu D Q, Yang W X, Luo J C, Wang H Y. QTL Mapping for adult-plant resistance to leaf rust in CIMMYT wheat cultivar Saar., 2009, 42: 388–397 (in Chinese with English abstract)
[26] Li H, Ribaut J M, Li Z, Wang J. Inclusive composite interval mapping (ICIM) for digenic epistasis of quantitative traits in biparental populations., 2008, 116: 243–260
[27] William H M, Singh R P, Huertaespino J, Palacios G, Suenaga K. Characterization of genetic loci conferring adult plant resistance to leaf rust and stripe rust in spring wheat., 2006, 49: 977–990
[28] Rosewarne G M, Singh R P, Huerta-Espino J, Herrera-Foessel S A, Forrest K L, Hayden M J, Rebetzke G J., 2012, 124: 1283–1294
[29] Messmer M M, Seyfarth R, Keller M,Schachermayr G, Winzeler M, Zanetti S, Feuillet C, Keller B. Genetic analysis of durable leaf rust resistance in winter wheat., 2000, 100: 419–431
[30] Singh R P, Mcintosh R A. Complementary genes for reaction toin: I. Genetic and linkage studies., 2011, 26:723–735
[31] Calvo-Salazar, SinghR P, Huerta-Espino J, Cruz-Izquierdo S, Lobato-Ortiz, Sandoval-Islas S, Vargas-Hernandez M, German S, Silva P, Basnet B R, Lan C X, Herrera-Foessel S A. Genetic analysis of resistance to leaf rust and yellow rust in spring wheat cultivar Kenya Kongoni., 2015, 99: 1153–1159
[32] Singh R P, Huerta-Espino J, William H M. Genetics and breeding for durable resistance to leaf and stripe rusts in wheat., 2005, 29: 121–127
Mapping QTLs against Leaf Rust in CIMMYT Wheat C615
LI Yu-Ling1, JIANG Zheng-Ning2, HU Wen-Jing2, LI Dong-Sheng2, CHENG Jing-Ye3, YI Xin1, CHENG Xiao-Ming2, WU Rong-Lin2, and CHENG Shun-He1,2,*
1Nanjing Agricultural University, Nanjing 210095, Jiangsu, China;2Lixiahe Institute of Agriculture Sciences of Jiangsu Province / Branch of National Wheat Improvement Center, Yangzhou 225007, Jiangsu, China;3Agricultural College of Yangzhou University, Yangzhou 225009, Jiangsu, China
Leaf rust, caused by, is an important wheat disease. The introduced wheat line C615 shows adult resistance to leaf rust, but its mechanism is not clear. In this study, the quantitative trait loci (QTLs) for leaf rust resistance were identified and located in a linkage map constructed with 337 SSR markers using a recombinant inbred line (RIL) population (112 lines of the F2:7generation) derived from CIMMYT wheat C615 (resistant) and Ningmai 18 (highly susceptible). Final disease severity (FDS) of leaf rust was evaluated in 2016 and 2017. Five QTLs were detected on chromosomes 1BL, 2DS, 3BS, 4DL, and 6BS, designated,,,,and, respectively. All the resistance alleles were contributed by the resistant parent C615, except for. Three QTLs,,, and, were detected in both years, which explained phenotypic variance by 10.1%–15.7%, 10.9%–13.5%, and 8.2%–9.0%, respectively. The remaining two QTLs were detected in one year with smaller contributions (6.2% and 9.2%, respectively).andwere located in the same regions of the known resistance genesand, respectively.in the marker interval–is probably a novel QTL for leaf rust resistance. Fifteen BC4F5lines derived from the cross of C615/Yangmai 13 (recurrent parent) were genotyped for leaf rust resistance using seven SSR markers closely linked to the QTLs from C615. All the 15 lines had QTLs donated by C615 and three of them pyramided four QTLs, indicating that C615 can serve as an elite donor parent in wheat breeding aiming at high-yield and high-resistance to leaf rust. These results provide a basis of marker-assisted selection and providing breeding materials.
wheat (L.); leaf rust; QTL mapping; marker-assisted selection
2017-09-26;
2018-03-25;
2018-04-08.
10.3724/SP.J.1006.2018.00836
程顺和, E-mail: yzcsh1939@126.com
E-mail: liyuling0817@126.com
本研究由国家现代农业产业技术体系建设专项(CARS-03-03B, CARS-3-2-11), 江苏省农业科技自主创新资金项目[CX(14)5080]和江苏省自然科学基金项目(BK20171279)资助。
This study was supported by the China Agriculture Research System (CARS-03-03B, CARS-3-2-11), the Independent Innovation Fund for Agricultural Science and Technology in Jiangsu Province [CX(14)5080], and the Natural Science Foundation of Jiangsu Province (BK20171279).
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20180406.1106.004.html

