39份外引小麦种质的抗叶锈病基因检测及其抗性鉴定
董 娜,王玉泉,陈向东,胡铁柱,吴晓军,张亚娟,茹振钢
(河南科技学院小麦中心/河南省杂交小麦重点实验室/现代生物育种河南省协同创新中心,河南新乡453003)
小麦叶锈病是由专性寄生真菌小麦叶锈病菌(Pucciniatriticina)引起的一种真菌性气传病害,在世界各小麦生产国均有发生,分布比条锈病、秆锈病更广。在中国,小麦叶锈病是影响小麦生产的重要病害之一,短期内可造成大面积流行,严重时可导致小麦减产5%~15%,甚至绝收[1]。近年来,由于气候变暖、播种密度大等因素的影响,各麦区叶锈病有加重发生的趋势。
发掘和利用抗病基因是控制小麦叶锈病最经济、有效且安全的方法。迄今为止,国际上已发现100多个小麦抗叶锈病基因[2-7],在除5A和6D以外的其他染色体上都有分布。由于小麦抗叶锈病基因小种专化性强,抗病基因容易随叶锈病菌毒力频率的变化或新毒力小种的出现而丧失功能,目前Lr1、Lr3、Lr10、Lr11、Lr16、Lr26等基因单独存在时已基本丧失抗性[8-10]。因此,广泛开展种质资源抗性评价以及抗病基因鉴定,对小麦抗叶锈病育种具有重要意义[11]。
国外种质资源的引进和合理利用是丰富我国小麦品种抗病遗传多样性、促进小麦生产发展的有效途径之一[12]。近年来,伍 玲等[13]利用分子标记对CIMMYT 273个小麦品种的抗病基因Lr34/Yr18/Pm38进行检测,筛选出含有该位点的材料43份,在不同地点对条锈病、叶锈病和白粉病具有不同程度的抗性;郑慧敏等[14]通过对70份国外小麦品种(系)进行苗期和成株期抗叶锈病鉴定,鉴定出15个抗叶锈病基因,筛选出慢锈性材料39份;焦 悦等[15]从50个国外小麦品种(系)中检测到7个抗叶锈病基因,筛选出慢锈性材料19份;王思曼等[16]在69份国外小麦品种(系)中检测到6个抗叶锈病基因,筛选出慢锈性材料46份。这些研究表明,国外小麦品种中含有丰富的抗叶锈病基因,可作为我国小麦抗叶锈病育种的抗病资源加以利用。
本研究利用已开发的与抗叶锈病基因(Lr1、Lr10、Lr20、Lr24、Lr26、Lr34、Lr37和Lr38)紧密连锁或共分离的分子标记,对本课题组保存的39份国外小麦种质进行抗叶锈病基因检测,筛选出叶锈病抗性表现突出的材料,以期为小麦抗病材料的合理利用提供参考依据。
1 材料与方法
1.1 供试材料
供试39份小麦种质材料(表2)由河南科技学院小麦中心收集和保存,分别引自智利、墨西哥、澳大利亚、俄罗斯等10个国家。叶锈病菌为小麦生产上流行小种PHT和THT混合菌株,购自中国农业科学院植物保护研究所。
1.2 方法
1.2.1 田间接种及叶锈病抗性鉴定
供试小麦种质材料秋播于河南科技学院百泉校区试验基地的种质圃中,种质圃行长4 m,每份材料种植两行,常规田间管理,于第二年春季小麦返青后取幼嫩叶片,用于基因组DNA提取。于拔节期采用注射法接种叶锈病菌孢子悬液,每行接种1个分蘖,于灌浆中期调查叶锈病病害等级,调查两次,间隔7 d,按0~4级法进行病级划分[17]。划分标准:0级(免疫型),叶上无可见症状;0;级(近免疫型),叶上产生小枯斑,无孢子堆;1级(高抗型),夏孢子堆小,周围有枯斑;2级(中抗型),夏孢子堆小到中等,生在绿色组织上,周围有枯斑;3级(中感型),夏孢子堆较大,周围组织有褪绿现象;4级(高感型),夏孢子堆大,周围不褪绿。叶锈病抗性鉴定于2018-2021连续三年进行,取发病最重的等级作为最终抗性结果。
1.2.2 小麦抗叶锈病基因分子标记检测
小麦叶片用液氮研磨后,采用CTAB法提取基因组DNA,通过紫外分光光度计和0.8%的琼脂糖凝胶电泳进行DNA质量检测,DNA原液稀释至50 ng·μL-1,备用。利用与抗叶锈病基因连锁的分子标记在S1000型梯度PCR仪(Bio-Rad,美国)上进行抗病基因分子检测。PCR反应体系为10 μL,包括模板DNA 50 ng,2×Taq Master Mix(康为世纪,北京)5 μL,上、下游引物(10 μmol·L-1)各0.5 μL,ddH2O补足至10 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性50 s,45~65 ℃退火50 s,72 ℃延伸45 s至2 min(退火温度和延伸时间参照文献进行),38个循环;72 ℃终延伸10 min,4 ℃保存。扩增产物经1%的琼脂糖凝胶(含goldview),在110 V下电泳40 min,利用凝胶成像仪(Bio-Rad,美国)进行观察并拍照保存。所用引物序列见表1,由上海英潍捷基贸易有限公司合成。

表1 本研究所用的标记引物
2 结果与分析
2.1 抗叶锈病基因的分子标记检测结果
利用与小麦抗叶锈病基因Lr1共分离的STS标记引物WR003F和WR003R对其进行分子标记检测,发现含有该基因的材料能扩增出753 bp的特异条带(图1)。在39份种质材料中,KPL-1、OK.95571、野猫等12份材料能扩增出该条带,说明这些材料携带Lr1,频率为30.77%(表2)。
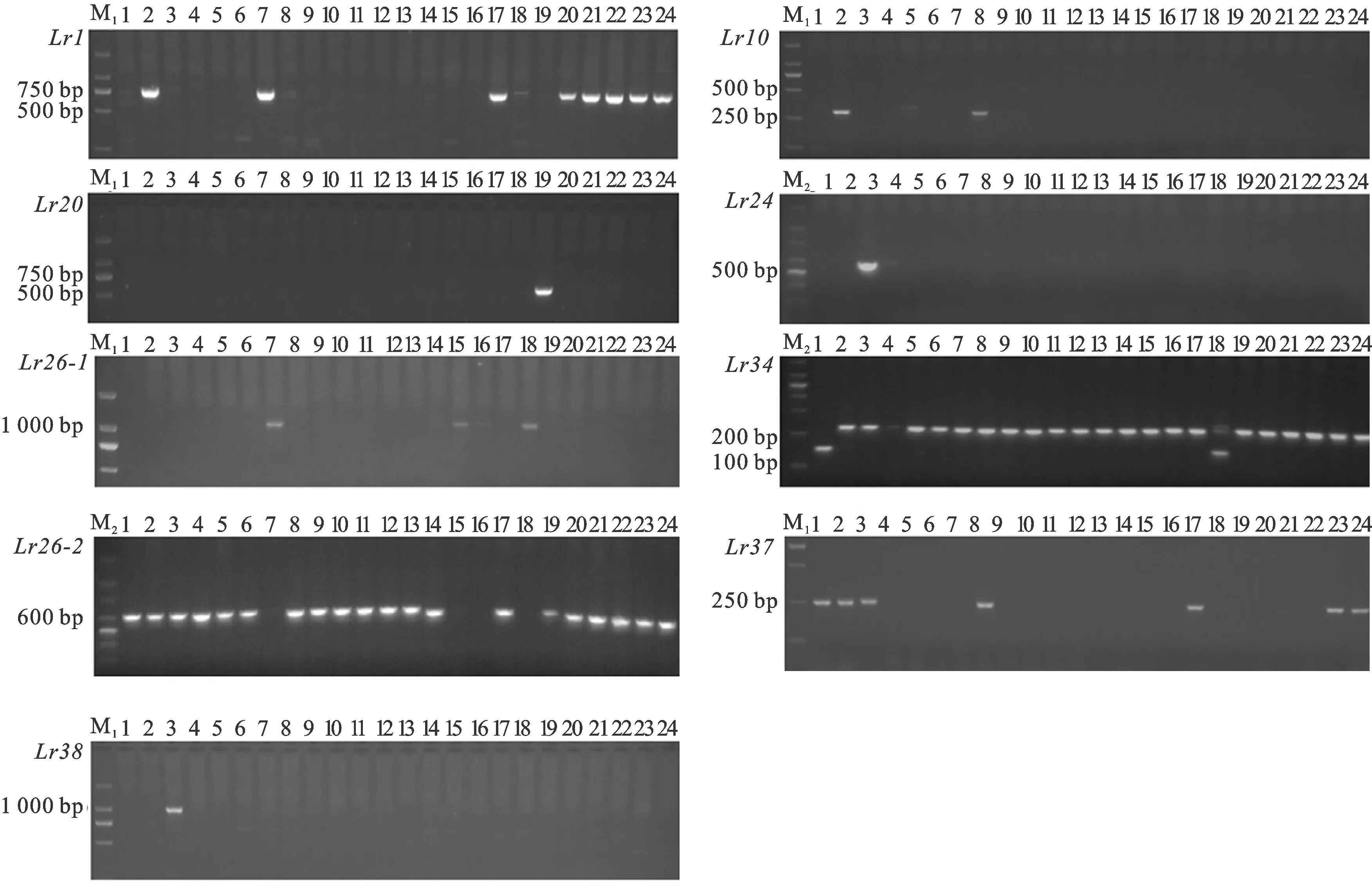
M1:DL2000 DNA marker;M2:100 bp DNA ladder;Lr26-1:利用标记ω-secalinF和ω-secalinR的检测结果; Lr26-2:利用标记O11B5和O11B3的检测结果;1:澳阿优1号; 2:KPL-1;3:KPL-3;4:阿大学AGT-②;5:鸟麦;6:攀道拉;7:智矮早;8:硬质博莱特;9:CL0401;10:CL0407(早);11:CL0419;12:CL0438;13:CL0442;14:墨特大;15:MRYC;16:墨176;17:墨S139;18:CMT-3(T88);19:萨尔斯堡;20:意大利白麦;21:Ciava;22:法国材料;23:bermude;24:鲁昂-10。箭头所指为目标条带。

表2 外引小麦种质携带的抗叶锈病基因及其抗病性
利用与小麦抗叶锈病基因Lr10共分离的STS标记引物Fl.2245和Lr10-6/r2对其进行分子标记检测,发现含有该基因的材料能扩增出310 bp的特异条带(图1)。在39份种质材料中,KPL-1、野猫、TAMOI等7份材料能扩增出该条带,说明这些材料携带Lr10,频率为17.95%(表2)。
利用与小麦抗叶锈病基因Lr20共分离的STS标记引物STS638-L和STS638-R对其进行分子标记检测,发现含有该基因的材料能扩增出542 bp的特异条带(图1)。在39份种质材料中,仅萨尔斯堡能扩增出该条带,说明该材料携带Lr20,频率为2.56%(表2)。
利用与小麦抗叶锈病基因Lr24共分离的SCAR标记引物S1302-609F和S1302-609R对其进行分子标记检测,发现含有该基因的材料能扩增出607 bp的特异条带(图1)。在39份种质材料中,KPL-3和OK.95571两份材料能扩增出该条带,说明这两份材料携带Lr24,频率为5.13%(表2)。
利用与小麦抗叶锈病基因Lr26共分离的STS标记引物ω-secalinF和ω-secalinR以及O11B5和O11B3对其进行分子标记检测,发现含有该基因的材料利用ω-secalinF和ω-secalinR能扩增出1 067 bp的特异条带,不含该基因的材料利用O11B5和O11B3能扩增出636 bp的特异条带(图1)。在39份种质材料中,HUAYUN、 智矮早、MRYC等5份材料能扩增出1 067 bp的条带,而不能扩增出636 bp的条带,说明这5份材料携带Lr26,频率为12.82%(表2)。
利用与小麦抗叶锈病基因Lr34紧密连锁的STS标记引物csLv34F和csLv34R(遗传距离为0.4 cM)对其进行分子标记检测,发现含有该基因的材料能扩增出150 bp的特异条带,不含该基因的材料能扩增出229 bp的特异条带(图1)。在39份种质材料中,澳阿优1号、OK.95571、Jaggar-1等12份材料能扩增出150 bp的条带,说明这12份材料携带Lr34,频率为30.77%(表2)。
利用与小麦抗叶锈病基因Lr37共分离的STS标记引物VENTRIUP和LN2对其进行分子标记检测,发现含有该基因的材料能扩增出259 bp的特异条带(图1)。在39份种质材料中,澳阿优1号、KPL-1、KPL-3等9份材料能扩增出该条带,说明这9份材料携带Lr37,频率为23.08%(表2)。
利用与小麦抗叶锈病基因Lr38共分离的SCAR标记引物Y38SCAR982F和Y38SCAR982R对其进行分子标记检测,发现含有该基因的材料能扩增出982 bp的特异条带(图1)。在39份种质材料中,KPL-3和OK.95571两份材料能扩增出该条带,说明这2份材料携带Lr38,频率为5.13%(表2)。
2.2 抗叶锈病基因的分布及种质抗性评价
从表2可知,29份材料至少携带1个所检测的抗叶锈病基因。聚合两个抗叶锈病基因的材料13份,其中携带Lr1+Lr10、Lr1+Lr26、Lr10+Lr37、Lr34+Lr37的材料各1份;携带Lr26+Lr34的材料2份;携带Lr1+Lr37的材料3份;携带Lr10+Lr34的材料4份。聚合3个抗叶锈病基因的材料2份,为KPL-1和KPL-3,分别携带Lr1+Lr10+Lr37和Lr24+Lr37+Lr38。OK.95571携带的抗叶锈病基因最多,有5个,分别为Lr1、Lr24、Lr34、Lr37和Lr38。叶锈病抗性鉴定结果表明,39份种质材料中,表现为近免疫和中抗的材料分别为4份和8份,频率分别为10.26%和20.51%,其余27份材料均表现为中感或高感,频率为69.23%。聚合两个抗叶锈病基因的种质材料中,携带Lr1+Lr10和Lr10+Lr37的材料对叶锈病表现为高感,携带Lr1+Lr26和Lr1+Lr37的材料表现为中感,携带Lr34+Lr37和Lr26+Lr34的材料表现为中抗,而携带Lr10+Lr34的材料抗性表现不一致,其中两份表现为中抗,两份表现为中感。聚合3个抗叶锈病基因的种质材料中,携带Lr1+Lr10+Lr37的材料(KPL-1)对叶锈病表现为近免疫,携带Lr24+Lr37+Lr38的材料(KPL-3)表现为中抗。聚合5个抗叶锈病基因的材料(OK.95571)对叶锈病表现为近免疫。
进一步分析发现,Lr1、Lr20、Lr37单独存在时,种质材料基本丧失抗性,虽然携带Lr1的两份材料(莫斯科39和非黑土地24)抗性很好,达到0;级,但是从携带Lr1种质材料的总体抗性来看,这两份材料的叶锈病抗性应该是由其他未检测到的抗叶锈病基因引起。本研究未检测到仅携带Lr10、Lr24或Lr38的材料,Lr24和Lr38与其他抗叶锈病基因聚合时,种质材料表现为中抗或近免疫;Lr10与Lr1或Lr37聚合时,种质材 料表现为高感,与Lr34聚合时,种质材 料表现为中感或中抗。另外,聚合3个及3个以上抗叶锈病基因的材料对叶锈病均表现为中抗或近免疫,说明聚合多个抗叶锈病基因有利于提高小麦种质材料的叶锈病抗性。
3 讨论
基于PCR的分子标记技术为种质资源中抗病基因的准确鉴定提供了有效工具,利用与抗病基因紧密连锁或共分离的分子标记对目标基因进行分子检测,不受组织器官类型和生长发育时期的限制,操作简便快速,而且可有效鉴定种质材料中抗病基因的组成。本研究所用的与抗叶锈病基因Lr1、Lr10、Lr20、Lr24、Lr26、Lr34、Lr37和Lr38紧密连锁或共分离的分子标记,在辅助抗病育种和种质资源鉴定中已有广泛应用,具有良好的特异性和稳定性[14-16],通过对39份外引小麦种质进行抗叶锈病基因检测和田间接种鉴定,对种质材料的叶锈病抗性进行了评价。
Lr1、Lr10、Lr20、Lr24、Lr26和Lr38为全生育期抗叶锈病基因。Lr24和Lr38分别来源于小麦近缘物种长穗偃麦草和中间偃麦草,对我国叶锈菌生理小种具有很强的抗性。陈万权等[9]研究表明,中国小麦叶锈菌群体对Lr24和Lr38的无毒基因频率达100%。王 志等[27]对小麦抗叶锈病材料的Lr24、Lr38基因进行分子标记检测和抗性鉴定,结果表明,单独含Lr24或Lr38以及二者聚合的材料对叶锈病抗性均表现为免疫或近免疫。姚宏鹏等[28]对小麦抗叶锈病基因聚合材料的抗性鉴定也有类似的结果。本研究中含有Lr24和Lr38的两份种质分别表现中抗和近免疫,与前人结果基本一致。Lr26来源于小麦-黑麦1BL/1RS易位系,陈万权等[29]、袁军海等[10]、郑慧敏等[14]的研究结果均表明,Lr26单独应用时,材料已丧失抗性。本研究中,MRYC、墨176只检测到Lr26基因,对叶锈病分别表现为中感和中抗,推测墨176的抗性可能由其他未检测的抗叶锈病基因引起。
来源于普通小麦的Lr34以及来源于偏凸山羊草的Lr37为成株期抗性基因。陈万权等[9]研究表明,Lr34成株期侵染型表现为中感,但终期病害比率小于10%,具有明显的慢叶锈病特征;Lr37成株期侵染型表现为中感及以上水平,终期病害比率在65%以上。本研究发现,Lr34和Lr37单独存在时,材料对叶锈病分别表现为中感和高感,但两者聚合时表现为中抗,说明Lr34和Lr37聚合时能提高载体种质的抗性水平。这与Kloppers等[30]的研究结果一致。
本研究检测到聚合3个及3个以上抗叶锈病基因的种质,即KPL-1(Lr1+Lr10+Lr37),KPL-3(Lr24+Lr37+Lr38)和OK.95571(Lr1+Lr24+Lr34+Lr37+Lr38),其对叶锈菌均表现为中抗或近免疫,说明聚合较多的抗叶锈病基因有利于提高叶锈病抗性,抗病基因聚合是开展小麦抗病育种的有效途径,同时这些种质也为抗叶锈病育种提供了重要抗源。另外,莫斯科39和非黑土地24两份材料对叶锈病抗性均表现为0;级,但分子标记检测结果显示,这两份材料仅携带Lr1,说明这两份材料可能含有其他抗叶锈病基因,有待对其进行深入分析。

