固相微萃取-气相色谱-串联质谱法测定水生蔬菜中35种多氯联苯
谢思思,卢俊文,李蓉,张朋杰,容裕棠,陈丽斯
(中山出入境检验检疫局,广东 中山,528400)
多氯联苯[1-3](polychlorinated biphenyls,PCBs)又称氯化联苯,是联苯苯环上的氢原子为氯所取代而形成的一类氯化物,为扔合成有机物,在工业上被广泛使用,造成了全球性环境污染。PCBs具有致癌、致畸、致突变的“三致”作用[4],因其难降解性、生物毒性、生物蓄积性及远距离迁移性等特点,给人体健康和生态系统造成潜在的威胁。由于其性质稳定,难分解,会在生物体内富集,可通过食物链放大逐级传递,危害人类及动物的健康[5]。目前在水质、土壤、大气、动植物等介质中均发现PCBs污染。
水生蔬菜[6]是指在淡水中生长的、其产品可供作蔬菜食用的维管束植物。我国水生蔬菜包括莲藕、茭白、慈姑、水芹、菱角、荸荠、芡实、蒲菜、莼菜、豆瓣菜、水芋和水蕹菜等,广受消费者喜爱。水生蔬菜对生产环境和生产过程要求较高,一旦相关环节发生污染,则极易引入污染。目前仅国家标准GB 2762—2017中明确了水产动物及其制品中PCBs限量要求,最大限量为0.5 mg/kg,没有蔬菜中PCBs的相关限量;现有研究文献中,郑群雄等[7]使用气相色谱-质谱法检测蔬菜中19种多氯联苯,测得蔬菜中PCBs含量为0.30~9.79 μg/kg,但暂时没有水生蔬菜中PCBs含量的测定数据。水生蔬菜类植物源性食品的PCBs残留检测也应引起足够的重视。
目前关于PCBs 的检测标准主要有GB 5009.190—2014《食品安全国家标准 食品中指示性多氯联苯含量的测定》、HJ 715—2014《水质 多氯联苯的测定 气相色谱-质谱法》、GB/T 8381.8—2005《饲料中多氯联苯的测定 气相色谱法》等,其中测定方法主要采用气相色谱法(gas chromatography,GC)[8-9]或气相色谱-质谱法(gas chromatography-mass spectrometry,GC-MS)[10]。而PCBs由于氯原子在联苯上的取代位置的不同,同一分子式下含多种同分异构体,而大多数的同分异构体均具有相似的化学性质,单纯地利用气相色谱法或气相色谱-质谱法进行分离测定很容易出现假阳性的结果。串联质谱法具有组分分离、结构解析同步完成的特点,可以直接分析混合组分,有高度的选择性和可靠性,比单级质谱具有更高的灵敏度,因此串联质谱常用于复杂样品的痕量分析中。目前鲜见使用固相微萃取结合气相色谱-串联质谱法(gas chromatography-tandem mass spectrometry,GC-MS/MS)[11-13]进行测定水生蔬菜中多氯联苯残留量研究的相关文献报道。
固相微萃取(solid-phase microextraction,SPME)[14-17]是在固相萃取技术上发展起来的一种微萃取分离技术,是一种集采样,萃取,浓缩和进样于一体的无溶剂样品微萃取新技术。与索氏提取、加速溶剂萃取[18]、超声波提取[19-20]、微波萃取[12-22]、固相萃取等传统前处理技术相比,固相微萃取操作更简单,携带更方便,操作费用也更加低廉;另外克服了固相萃取回收率低、吸附剂孔道易堵塞的缺点。本研究采用固相微萃取对样品进行前处理,利用GC-MS/MS法分别得到PCBs的一、二级质谱图以及相对应的母离子、子离子,建立测定蔬菜中PCBs残留量的方法。
1 材料与方法
1.1 材料与试剂
丙酮(色谱纯,上海飞世尔公司);30 μm、100 μm聚二甲基硅氧烷(polydimethylsiloxane,PDMS)萃取头、65 μm聚二甲基硅氧烷/二乙烯基苯((polydimethylsiloxane/divinylbenzene,PDMS/DVB)萃取头、65 μm聚乙二醇/二乙烯基苯(carbowax/divinylbenzene,CW/DVB)萃取头、20mL SPME样品瓶(配磁性铝盖和内衬聚四氟乙烯隔垫,美国SUPELCO公司);35种PCBs标准品(纯度>95.0 %),德国Dr.Ehrenstorfer公司。
豆瓣菜、水芹、菱角、芡实、莲藕、荸荠6种水生蔬菜样品来自国内市场。
1.2 仪器与设备
TSQ 8000 Evo气相色谱-串联质谱联用仪(配TRIPLUS RSH三合一自动进样器),美国Thermo公司);8893型超声波清洗机,美国Cole-Parmer公司;ST 40R离心机,美国Thermo公司;MS3 basic旋涡混合器,德国IKA公司;Mill-Q超纯水器,美国Millipore公司;GM200捣磨仪,德国Retsch公司。
1.3 实验方法
1.3.1 标准溶液的配制
1.3.1.1 PCBs标准储备液
准确称取各PCBs标准品适量,用正己烷配制成200 μg/mL的标准储备液。
1.3.1.2 PCBs标准工作液
准确量取各PCBs标准储备液1 mL,用正己烷配制成2 μg/mL的混合标准工作液。
1.3.1.3 混合标准工作系列溶液
准确量取PCBs混合标准工作液0.005、0.01、0.025、0.05、0.1、0.25、0.5、1.0 mL,用正己烷稀释,配制成混合标准系列工作溶液。
1.3.2 仪器方法
1.3.2.1 色谱方法
色谱柱:TR-Pesticide(30 m×0.25 mm×0.25 μm);进样方式:SSL,不分流进样,分流流量:60 mL/min,不分流时间:1 min;流速1.3 mL/min,进样体积1 μL;进样口温度:280 ℃;升温程序:初始温度100 ℃,保持2 min,以30 ℃/min升到200 ℃,以3 ℃/min升到265 ℃,以20 ℃/min升到310 ℃。
1.3.2.2 质谱方法
电子轰击离子源;电离电压70 eV;离子源温度300 ℃,传输线温度300 ℃;溶剂延迟时间5 min;扫描模式:选择反应监测(selective reaction monitoring,SRM)模式,其具体参数见表1;定量方法:峰面积外标法定量。
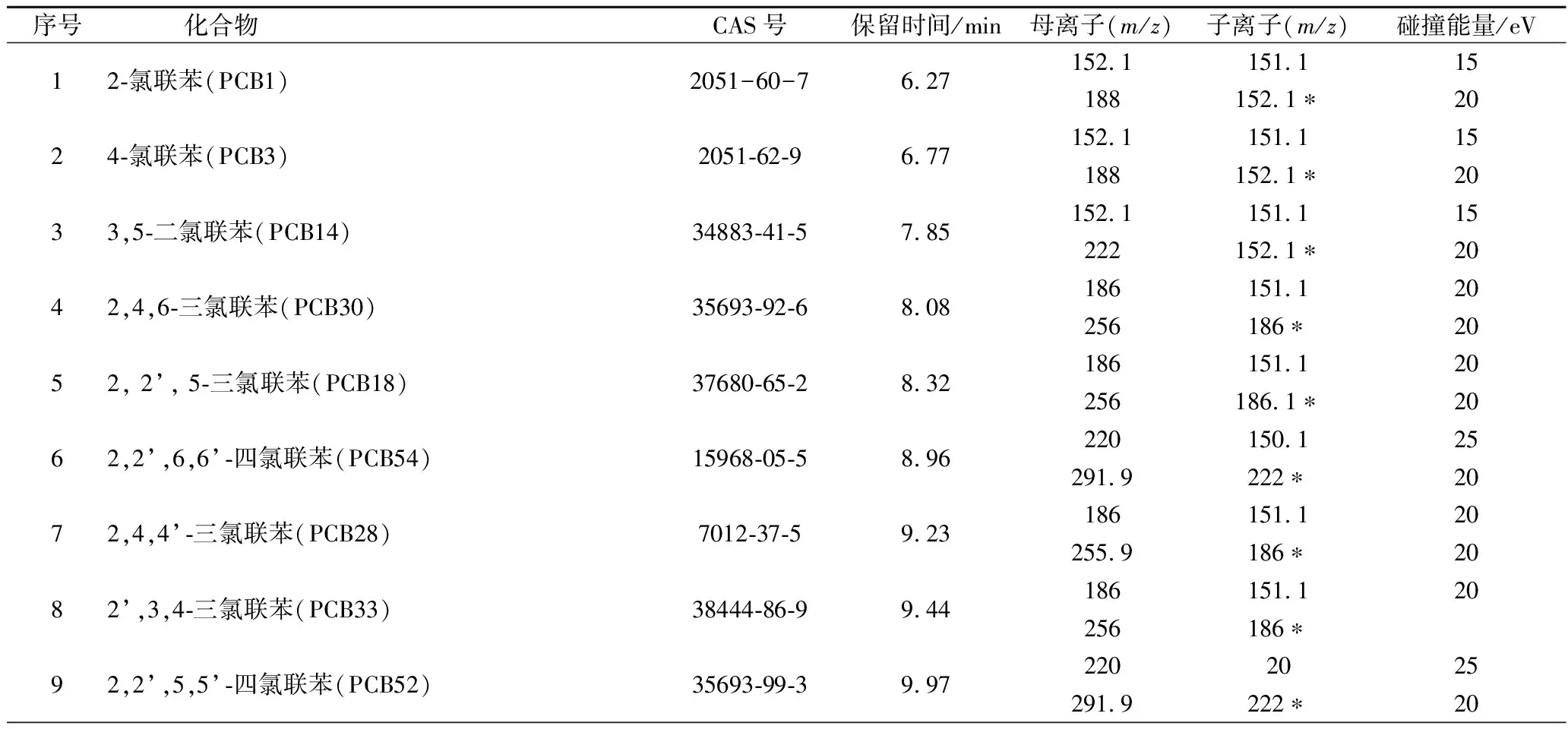
表1 35种PCBs的SRM分析参数Table 1 Parameters of SRM for 35 PCBs
续表1

序号化合物CAS号保留时间/min母离子(m/z)子离子(m/z)碰撞能量/eV102,2’,4,6,6’-五氯联苯(PCB104)56558-16-810.40253.918425325.9256∗20112,2’3,5’-四氯联苯(PCB44)41464-39-510.51220150.125291.9257∗10123,4,4’-三氯联苯(PCB37)38444-90-510.63186151.120255.9186.1∗20132,3’,4’,5-四氯联苯(PCB70)32598-11-111.58220150.125291.9220∗20142,2’,4,4’6,6’-六氯联苯(PCB155)33979-03-212.06289.922025359.8289.9∗20152,2’,4,5,5’-五氯联苯(PCB101)37680-73-212.40253.9184.125325.9256∗20163,3’,4,4’-四氯联苯(PCB77)32598-13-313.67220150.125291.9222∗20172,3,3’,4,5’-五氯联苯(PCB108)70362-41-314.39253.918425325.9256∗20182,3’,4,4’,5-五氯联苯(PCB118)31508-00-614.58253.918425325.9256∗20192,2’,4,4’,5,5’-六氯联苯(PCB153)35065-27-115.43289.922030359.9289.9∗20202,3,3’,4,4’-五氯联苯(PCB105)32598-14-415.61253.918425325.9256∗20212,2’,3,4,4’,5’-六氯联苯(PCB138)35065-28-216.55289.922030359.9289.9∗25223,3’,4,4’,5-五氯联苯(PCB126)57465-28-816.96253.918425325.9256∗20232,2’,3,4’,5,5’,6-七氯联苯(PCB187)52663-68-017.24323.925425393.8323.9∗20242,2’,3,3’,4,4’-六氯联苯(PCB128)38380-07-317.71,289.922030359.9289.9∗20252,2’,3,3’,5,5’,6,6’-八氯联苯(PCB202)2136-99-418.62357.8287.925429.8359.8∗20262,2’,3,4,4’,5,5’-七氯联苯(PCB180)35065-29-319.50323.925430393.8323.9∗20273,3’,4,4’,5,5’-六氯联苯(PCB169)32774-16-620.50289.922025359.8289.9∗20282,2’,3,3’,4,4’,5-七氯联苯(PCB170)35065-30-620.86323.9253.930393.8323.9∗25292,2’,3,3’,4,5,5’,6’-八氯联苯(PCB199)52663-75-921.25357.8287.930429.8359.9∗25302,3,3’, 4, 4’, 5, 5’-七氯联苯(PCB189)39635-31-922.24323.9253.930393.8323.9∗20312,2’3,3’,4,5,5’,6,6’-九氯联苯(PCB208)52663-77-122.84391.8321.930463.8393.8∗25322,2’,3,3’,4,4’,5,6-八氯联苯(PCB195)52663-78-222.93357.8287.930429.8359.9∗25332,2’,3,3’,4,4’,5,5’-八氯联苯(PCB194)35694-08-723.93359.8287.930429.8359.8∗25342,2’,3,3’,4,4’,5,5’,6-九氯联苯(PCB206)40186-72-925.75391.8321.930463.7393.8∗25352,2’,3,3’,4,4’,5,5’,6,6’-十氯联苯(PCB209)2051-24-327.22427.8357.825497.8427.8∗25
注:标“*”为定量离子。
1.3.3 样品前处理
取适量样品于捣磨仪中粉碎,准确称取10 g样品,加入10 mL丙酮,涡旋30 s,超声提取20 min,以4 500 r/min离心5 min,吸取上清液于20 mL SPME样品瓶中,SPME萃取瓶由进样杆从样品盘转入孵化炉,平衡10 min后,进样针插入到萃取瓶的中间位置,针管内的纤维完全浸没于萃取溶液中,孵化炉以250 r/mim左右交替转动混匀溶液,在60 ℃下萃取30 min,萃取结束后进样针直接插入气相色谱进样口热解吸8 min,供GC-MS/MS进行分析。
2 结果与分析
2.1 SPME条件的优化
2.1.1 萃取纤维的选择
萃取纤维涂层是固相微萃取的核心,其材料和涂层厚度是影响灵敏度的关键因素,分析物在萃取纤维涂层与样品之间的分配系数影响萃取效率,因此涂层的选择由分析物的极性和挥发性决定,应遵循“相似相容”原则。本试验选用了30 μm PDMS、100 μm PDMS、65 μmPDMS/DVB、65 μm CW/DVB 4种萃取纤维。由纤维的组成可知:PDMS/DVB、CW/DVB的极性大于单一组成的PDMS,厚度为100 μm 的纤维比30 μm的纤维具有更强的吸附能力;多氯联苯属于非极性和半挥发性化合物,结果表明100 μm PDMS对多氯联苯的萃取效率更高,因而选用了100 μm PDMS 萃取纤维。
2.1.2 萃取温度的优化
提高温度对固相微萃取的萃取效果有两方面的影响:一方面高温提高了分析物的扩散系数,另一方面吸附是一个放热过程,温度升高分析物的分配常数降低,降低了纤维的萃取效率。本试验采用0.01mg/kg的样品加标溶液在40~80 ℃下萃取,考察萃取效率与温度之间的关系,结果如图1所示。
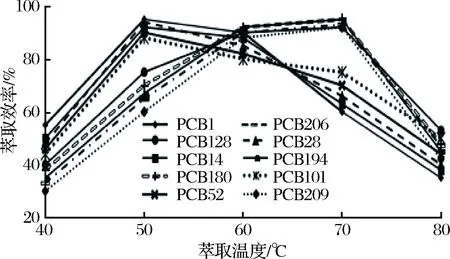
图1 温度对PCBs萃取效率的影响Fig.1 Effect of agitation tempature on the extraction efficiency of PCBs
由图1可看出,分子质量较小、沸点较低的低氯取代联苯(1~5氯取代PCB1、PCB14、PCB28、PCB52和PCB101)随着温度的升高萃取效率急剧上升,在50℃达到峰值,而后逐步下降;高温更有利于高氯代(6~10氯取代PCB128、PCB180、PCB194、PCB206和PCB209)的萃取,温度升高萃取效率增加显著,于70℃达到最大值,而后萃取效率大幅下降。因此 综合考虑温度对各个化合物的影响情况,确定萃取温度为60℃。
2.1.3 萃取时间的选择
选定萃取温度为60 ℃,对0.01 mg/kg加标样品溶液分别萃取10、20、30、40、50 min,考察萃取效率与时间之间的关系,结果如图2所示。
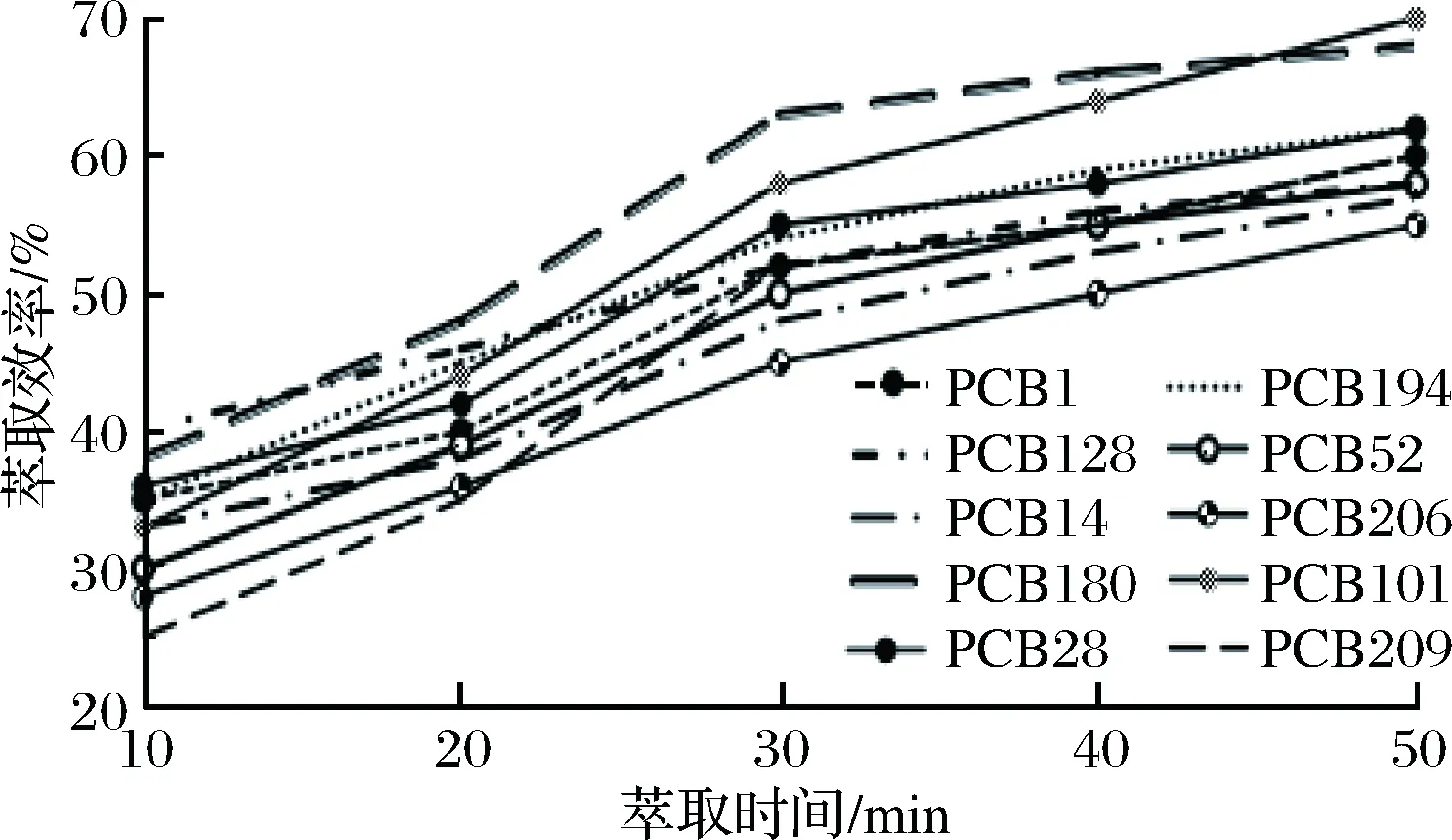
图2 时间对PCBs萃取效率的影响Fig.2 Effect of agitation time on the extraction efficiency of PCBs
结果表明,随着萃取时间的延长, 各PCBs的萃取效率均呈逐渐上升趋势,30 min后增速变缓;随着萃取时间的增加,各PCBs色谱响应值随萃取时间的延长持续增加,但依据SPME的非平衡理论,并且综合考虑分析周期和工作效率,选择30 min作为萃取时间。
2.2 质谱条件的优化
本研究选用TR-Pesticide色谱柱可以实现35种PCBs的良好分离;以全扫描方式对35种目标物进行扫描,获得35种PCBs的保留时间和一级质谱图,从中选择丰度和质荷比(m/z)较高的离子作为母离子,进一步对其进行子离子扫描,选出特征离子对及对应的碰撞能量。图3为优化条件下35种目标物的总离子流色谱图。

图3 35种PCBs在选择反应监测模式下的总离子流图(图中标记的1~35同表1)Fig.3 Total ion chromatogram of 35 PCBs in selected reaction monitoring
2.3 线性范围及方法检出限
准确移取PCBs混合标准工作液,用正己烷定容,配制成各组分质量浓度分别为10、20、50、100、200、500 μg/L的标准工作曲线,按1.3.2所述的仪器方法进行检测,以定量离子的峰面积Y为纵坐标,质量浓度X(μg/L)绘制标准曲线,以3倍信噪比确定各目标物的方法检出限,其线性范围、线性方程、相关系数及方法检出限见表2。
2.4 回收率与精密度
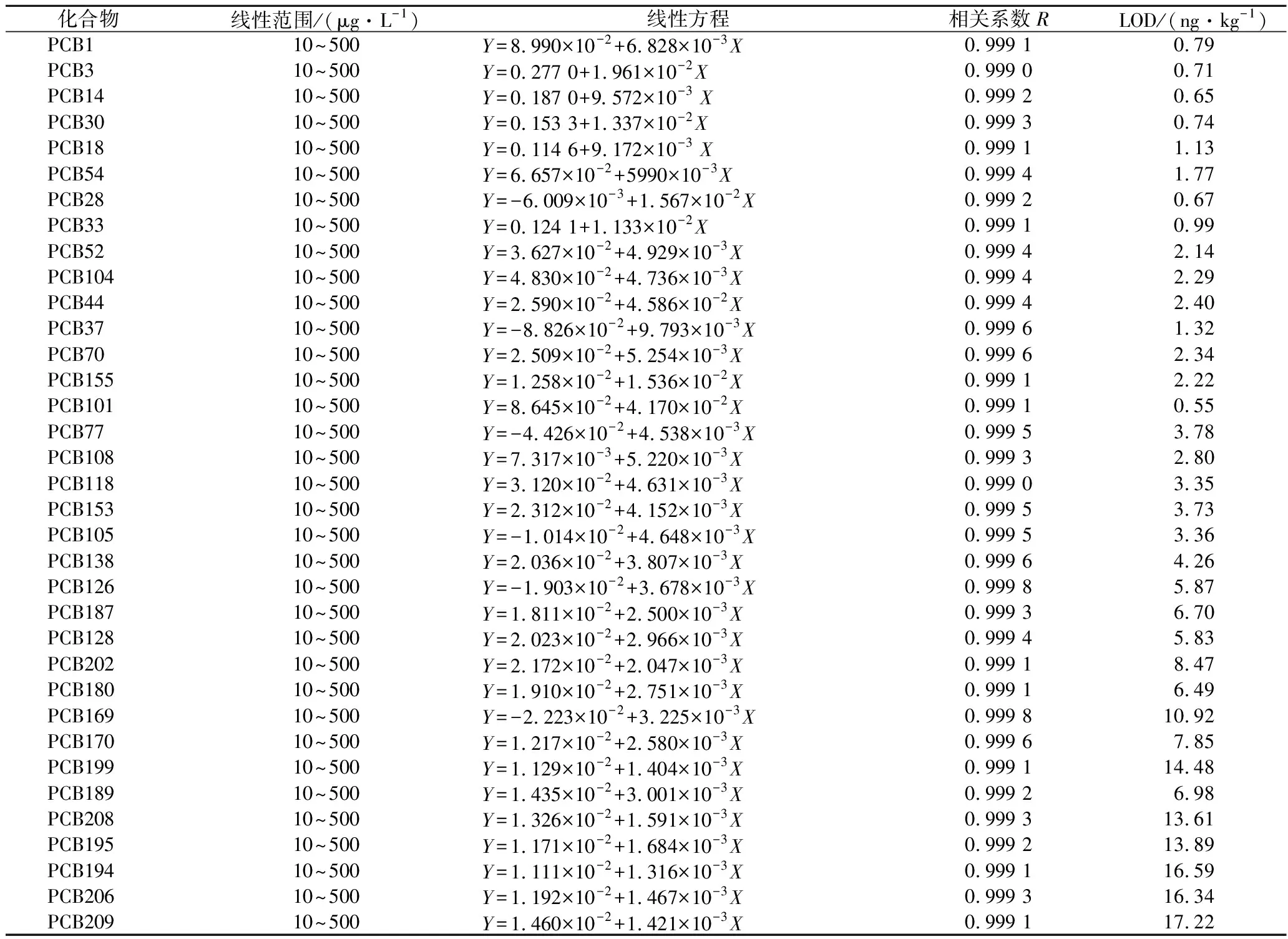
表2 35种多氯联苯的线性范围、线性方程、相关系数、方法检出限(LOD)Table 2 Linear rang, linear equation, correlation coefficients, LOD in method of 35 PCBs
固相微萃取的吸附是不完全吸附,因此文中的回收率是相对回收率,即加标样品固相微萃取后的检测响应值与相应浓度的标准水溶液固相微萃取后的检测响应值的比值。本试验选取莲藕、豆瓣菜、水芹3种样品进行加标回收试验。称取空白样品10 g,添加0.01和0.02 mg/kg的PCBs标准混合溶液,按1.3.3进行前处理后供GC-MS/MS分析测定,外标法计算35种PCBs的相对回收率和相对标准偏差。35种PCBs的平均回收率为72.3%~117.3%,相对标准偏差(RSD)为1.2%~11.2%。实验结果见表3。
2.5 实际样品分析
为考察本方法的实用性,选取豆瓣菜、水芹、菱角、芡实、莲藕、荸荠6种水生蔬菜样品各5批,采用本方法进行分析。上述样品中,采集于电镀厂附近的的水生蔬菜样品中均检出PCBs,其余样品均无检出。具体残留见表4。结果表明,电镀厂附近的土壤和水质已被污染;同时样品中低氯代的PCBs相对含量较大,其原因主要为低氯代的PCBs挥发迁移性和生物积累性。

表3 回收率及精密度实验结果(n=6)Table 3 Results of recovery and precision of the method
续表3
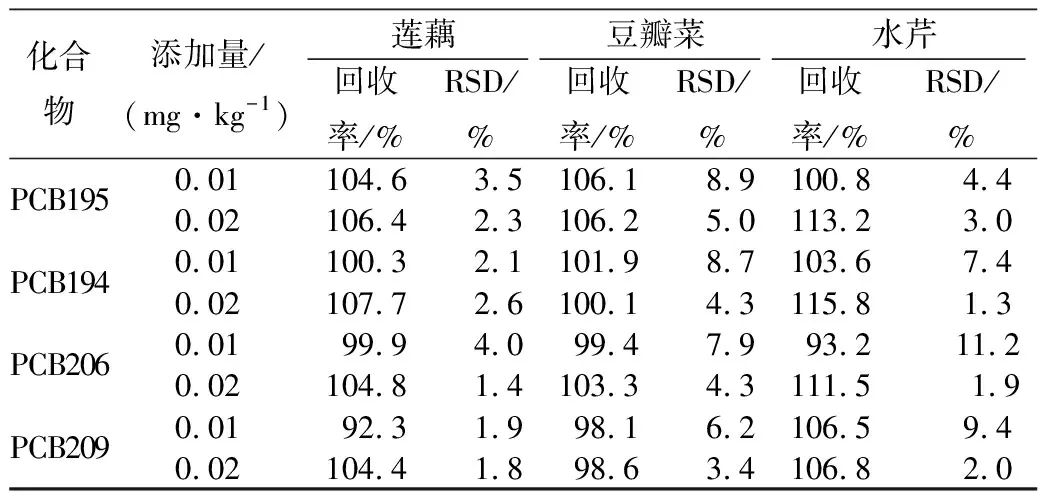
化合物添加量/(mg·kg-1)莲藕豆瓣菜水芹回收率/%RSD/%回收率/%RSD/%回收率/%RSD/%PCB1950.01104.63.5106.18.9100.84.40.02106.42.3106.25.0113.23.0PCB1940.01100.32.1101.98.7103.67.40.02107.72.6100.14.3115.81.3PCB2060.0199.94.099.47.993.211.20.02104.81.4103.34.3111.51.9PCB2090.0192.31.998.16.2106.59.40.02104.41.898.63.4106.82.0
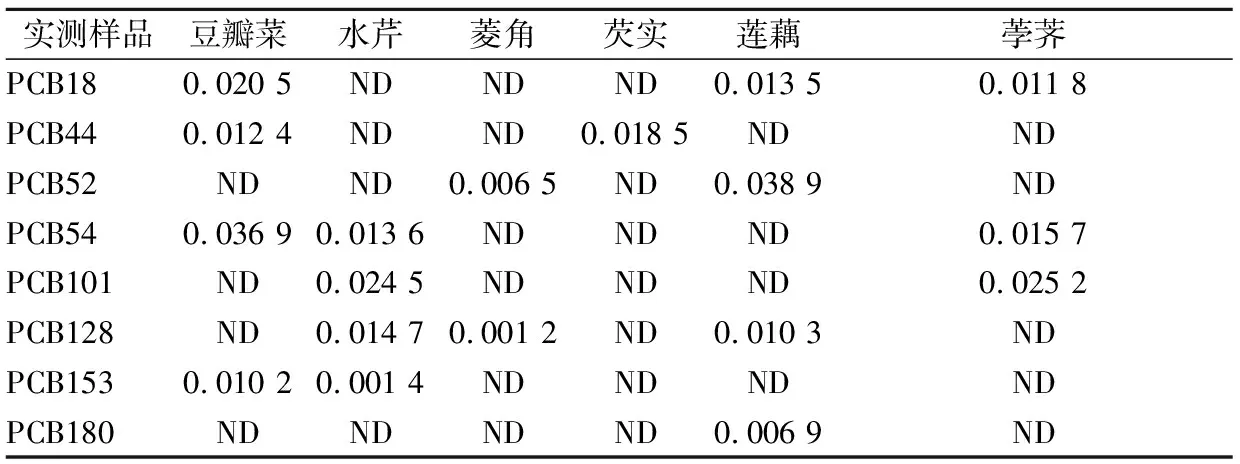
表4 实际样品中PCBs的残留检测结果单位:mg/kg
3 结论
本研究建立了固相微萃取-气相色谱-串联质谱法测定蔬菜中35种PCBs残留量的分析方法。采用100 μm PDMS萃取纤维,在60 ℃萃取30 min,经280 ℃解吸6 min后进样,外标法定量。该方法具有简便、快速、背景干扰低、选择性好、灵敏度高等特点,适用于不同种类水生蔬菜中多种PCBs定性确证和定量分析。
[1] 王飞.持久性有机污染物多氯联苯(PCBs)的研究进展[J].科技资讯,2015,11(20):139-141,143.
[2] 张顺.持久性有机污染物现状及处理方法的研究[J].广州化工,2011,39(9):152-155.
[3] 张微,杨天雄,柯跃建,等.环境中PCBs的污染现状和风险评估[J].能源环境保护,2013,27(5):1-7.
[4] 胡华,王政华.多氯联苯类污染物对人类健康的影响[J].长沙民政职业技术学院学报,2007,14(1):121-126.
[5] 朱晓楼,沈超峰,黄荣浪,等.多氯联苯的膳食暴露及健康风险评价研究进展[J].环境化学,2014,33(1):10-18.
[6] 杨兰,杨慧,王富华,等.水生蔬菜中主要污染物风险项目分析研究[J].湖北农业科学,2013,52(22):5 577-5 580.
[7] 郑群雄,徐小强,刘清辉,等.气相色谱-质谱法检测蔬菜中19种多氯联苯[J].中国食品学报,2012,12(2):151-157.
[8] 胡恩宇,杨丽莉,王美飞,等.气相色谱法同时测定水产品中28种多氯联苯单体[J].环境检测管理与技术,2010,22(1):44-48.
[9] 柯常亮,刘奇,王许诺,等.气相色谱法同时测定水产品中28种多氯联苯同系物[J].食品与发酵工业,2015,41(7):155-159.
[10] 吉仙枝.气相色谱-质谱联用法测定食品中的多氯联苯技术研究[J].三 门 峡 职 业 技 术 学 院 学 报,2014,13(2):109-122,124.
[11] 姚銘栋,王余萍,王冬梅.饮用水中多氯联苯的全自动固相萃取-气相色谱-三重四级杆质谱测定法[J].职业与健康,2015,31(19):2 634-2 636.
[12] 李阿丹,王晶,催宗岩,等.固相微萃取-气相色谱-串联质谱法测定蜂蜜中双甲脒及其代谢产物残留[J].燕山大学农药学学报,2016,40(3):236-240.
[13] 周蓓蕾,赵玲,沈燕,等.气相色谱-串联质谱法测定虾体中18种多氯联苯[J].农药学学报,2017,19(2):223-230.
[14] 徐刚,史铭歌,吴明红,等.固相微萃取的原理及应用[J].上海大学学报,2013,19(4):368-373.
[15] 张秀雯,陆燕,曹建平,等.固相微萃取技术在PCBs分析测定中的应用[J].广州化工,2016,44(19):8-10.
[16] 何迎春,王正虹,李林,等.固相萃取-固相微萃取-气相色谱法测定饮用水中多溴联苯醚[J].食品科学,2012,33(8):236-240.
[17] 张潜,余辉菊,王炼,等.饮水中16种多环芳烃和6种多氯联苯的固相微萃取-气相色谱-三重四级杆质谱同时测定法[J].环境与健康杂志,2014,31(2):173-176.
[18] 傅胜武,林麒,吕华东,等.加速溶剂萃取-气相色谱质谱联用法测定食品中指示性多氯联苯的研究[J].中国卫生检验杂志,2006,16(9):1 025-1 028.
[19] 胡红美,郭远明,郝青,等.超声波萃取-分散固相萃取净化-气相色谱电子捕获法测定土壤或底泥中的多氯联苯[J].分析化学,2016,44(1):88-94.
[20] 胡红美,郭远明,孙秀梅,等.超声波萃取-PSA净化-GC-ECD法测定鲍鱼不同组织中的多氯联苯[J].中国食品学报,2014,14(4):198-203.
[21] 李强,夏静,白彦坤,等.微波辅助提取-固相萃取净化-气相色谱三重四级杆联用测定水产品中17种多氯联苯(PCBs)[J].质谱学报,2012,33(5):295-300.
[22] 张艳,江志彬,焦哲,等.微波辅助-微固相在线萃取/气相色谱质谱联用法对污泥中19种多氯联苯的测定[J].分析测试学报,2016,35(8):1 036-1 040.

