拉莫三嗪抗抑郁作用及其机制研究*
林 娜 柳 洋 祁 晖 周凤玲 辛 勤 王海英△
(1济宁医学院基础医学院, 济宁 272067;2青岛市第九人民医院,青岛 266000;3济宁医学院附属济宁市第一人民医院,济宁 272011)
双向情感障碍是一种常见的精神疾病,全球约有1%~4%的人患有双向情感障碍,在治疗双向情感障碍过程中最主要的问题是抗抑郁药的使用。谷氨酸是一种兴奋性氨基酸,参与调控抑郁的发生及发展[1]。重度抑郁症患者的尸检结果表明,死者的额叶皮质中谷氨酸水平增加[2],额叶皮质中N-甲基-D-天冬氨酸(NMDA)受体表达也产生不同程度的改变[3],并且NMDA受体NMDAR1亚基在海马中的表达减少[4]。给予NMDA受体拮抗剂氯胺酮能够明显缓解抑郁症患者的抑郁情绪[5],说明NMDA受体参与抑郁的产生,并且长期抗抑郁治疗能够改变机体NMDA受体功能[1]。
拉莫三嗪具有明显的抗抑郁作用[6-7],但其机制尚未明确。本文将着重研究拉莫三嗪抗抑郁作用机制。现报道如下。
1 材料与方法
1.1 动物
雄性昆明抑郁模型小鼠,购自山东省鲁抗医药股份有限公司质检中心实验动物室,体重20~30g,饲养于21℃~23℃环境中,12h循环光照,饮食自由。所有实验在12:00至16:00之间完成。
1.2 实验分组
实验分3部分进行。
第一部分:观察拉莫三嗪对抑郁模型小鼠的行为影响。随机选取40只抑郁模型小鼠分为5组(n=8),分别向小鼠腹腔注射拉莫三嗪(7,15,30ml/kg)[8]、生理盐水(7ml/kg)以及氟西汀(20mg/kg)。
第二部分:观察NMDA受体对拉莫三嗪抗抑郁作用的影响。随机选取32只抑郁模型小鼠分为4组(n=8),1)腹腔注射生理盐水(7ml/kg)15min后再腹腔注射生理盐水(7ml/kg);2)腹腔注射生理盐水(7ml/kg)15min后再腹腔注射拉莫三嗪(30mg/kg);3)腹腔注射NMDA(75m/kg)[9]15min后再腹腔注射生理盐水(7ml/kg);4)腹腔注射NMDA(75m/kg)15min后再腹腔注射拉莫三嗪(30mg/kg)。
第三部分:观察NMDA受体拮抗剂对拉莫三嗪抗抑郁作用的影响。随机选取64只抑郁模型小鼠分为8组(n=8),1)腹腔注射生理盐水(7ml/kg)15min后再腹腔注射生理盐水(7ml/kg);2)腹腔注射生理盐水(7ml/kg)15min后再腹腔注射拉莫三嗪(7mg/kg);3)腹腔注射MK-801(0.05m/kg)[10]15min后再腹腔注射生理盐水(7ml/kg);4)腹腔注射MK-801(0.05m/kg)15min后再腹腔注射拉莫三嗪(5mg/kg);5)腹腔注射氯胺酮(1mg/kg)[10]15min后再腹腔注射生理盐水(7ml/kg);6)腹腔注射氯胺酮(1mg/kg)15min后再腹腔注射拉莫三嗪(7mg/kg);7)腹腔注射MgSO4(10mg/kg)[10]15min后再腹腔注射生理盐水(7ml/kg);8)腹腔注射MgSO4(10mg/kg)15min后再腹腔注射拉莫三嗪(7mg/kg)。
以上各组均于完成注射30min后开始进行行为学实验。
1.3 方法
1.3.1旷场实验(OFT) OFT用于评估动物的运动行为[11]。旷场由白色不透明有机玻璃制成(50cm×50cm×30cm),旷场底部均分为12等份。每次都将实验动物放置于旷场中心位置,小鼠4只爪子进入一格、2只前爪腾空或攀附墙壁记录为运动1次。
1.3.2强迫游泳实验(FST) 将动物放置于圆柱形烧瓶(直径10cm,高25cm)中,向烧瓶中充以(24±1)℃的温水,水深19cm。FST通过动物静止时间的改变评估药物的抗抑郁作用[12],FST能够反映受试动物的无助状态[12]。静止是指动物不挣扎,躯体漂浮不扭曲。记录小鼠6 min内静止潜伏期及之后4min内静止持续时间。
1.3.3悬尾实验(TST) 小鼠尾尖部1/3处通过不粘胶固定于50cm高金属杆一端,使用摄像系统记录小鼠6min内静止潜伏期及之后4min内静止持续时间。静止是指动物不挣扎,躯体悬挂不扭曲[12]。
1.4 统计学方法
2 结果
2.1 拉莫三嗪对抑郁型小鼠行为的影响
与生理盐水组相比,拉莫三嗪(15、30mg/kg)组小鼠在FST(图1A)和TST(图1B)实验中静止时间均减少且呈量效依赖关系(P<0.05),表现出与20 mg/kg氟西汀组小鼠相似的静止时间减少(图1A、B)。但在OFT实验中,仅 30 mg/kg拉莫三嗪 组小鼠运动次数减少(P<0.05,图1C),其余各组差异均无统计学意义(P>0.05,图1C)。
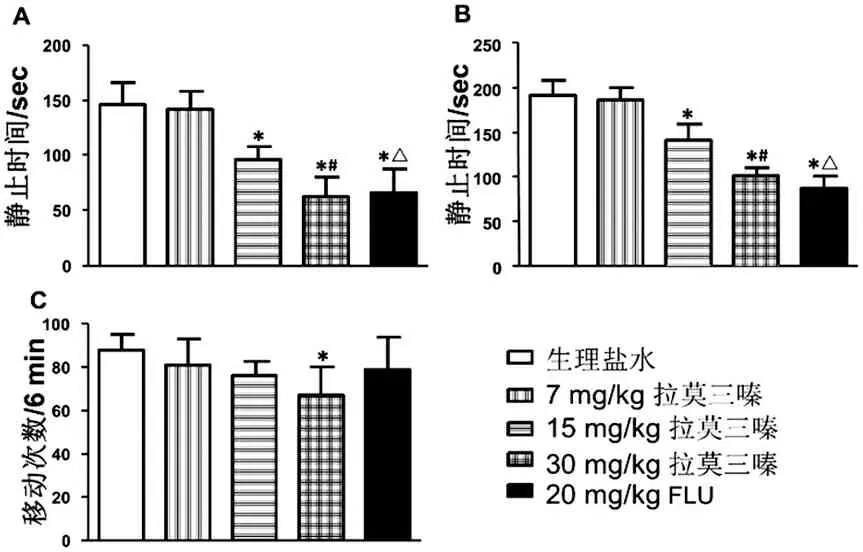
注:A,FST;B,TST;C,OFT;
与7mg/Kg拉莫三嗪组相比,*P<0.05; 与15mg/Kg拉莫三嗪组相比,#P<0.05;
与30mg/Kg拉莫三嗪组相比,△P>0.05
图1 拉莫三嗪对抑郁型小鼠行为的影响
2.2 NMDA受体对拉莫三嗪抗抑郁作用的影响
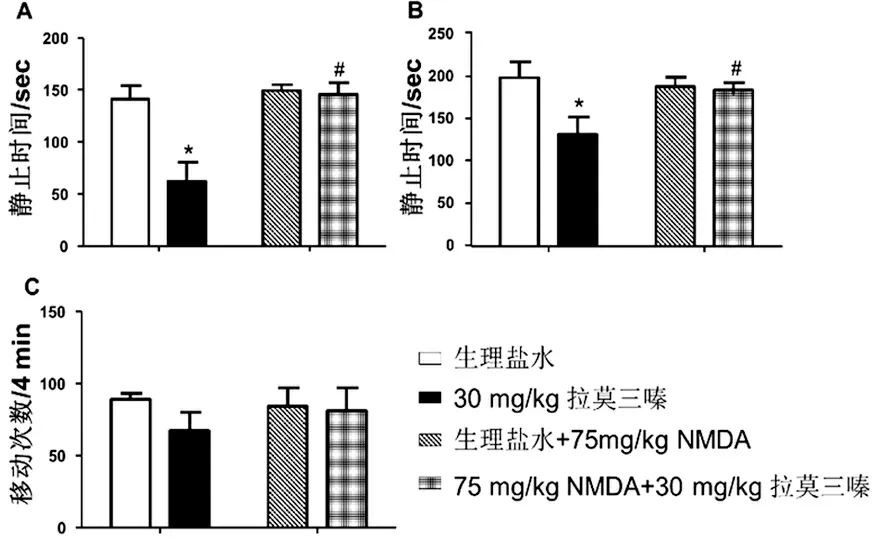
与生理盐水/生理盐水组相比,生理盐水/拉莫三嗪组小鼠在FST(图2A)和TST(图2B)实验中静止时间明显减少(P<0.05),但在OFT实验中,小鼠运动的差异无统计学意义(P>0.05,图2C)。
与生理盐水/拉莫三嗪组相比,NMDA/拉莫三嗪组小鼠在FST(图2A)和TST(图2B)实验中静止时间明显增高(P<0.05),但在OFT实验中,小鼠运动的差异无统计学意义(P>0.05,图2C)。
2.3 NMDA受体拮抗剂对拉莫三嗪抗抑郁作用的影响
与生理盐水/拉莫三嗪组相比,MK/拉莫三嗪组、氯胺酮/拉莫三嗪组以及MgSO4/拉莫三嗪组小鼠在FST(图3 A,D,G)和TST(图3 B,E,H)实验中静止时间明显减少(P<0.05),但在OFT实验中,小鼠运动的差异无统计学意义(P>0.05,图3 C,F,I)。
注:A,D,G:FST;B,E,H:TST;C,F,I:OFT;与生理盐水/拉莫三嗪组相比,*P<0.05
图3 NMDA受体拮抗剂对拉莫三嗪抗抑郁作用的影响
3 讨论
在治疗双向情感障碍过程中最主要的问题是抗抑郁药的使用,尤其是三环抗抑郁药,这些抗抑郁药能够增加躁狂的发作[13]。因此,如何稳定在治疗双向情感障碍中出现的情绪就成为研究的热点。拉莫三嗪不但能够治疗多种类型的癫痫还能够有效缓解双向情感障碍患者的重度抑郁,并且与其他一些抗抑郁药物相比,使用拉莫三嗪的抑郁症患者较少表现出躁狂[14]。但是到目前为止,拉莫三嗪抗抑郁的确切机制尚未明确。目前已经有大量研究证实,NMDA受体参与抑郁症的发生发展。有研究发现,封闭NMDA受体后能够产生抗抑郁样反应[1],抗抑郁类药物能够明显抑制NMDA受体的活化,抑制NMDA受体功能并且抑制NMDA受体的结合能力以及表达[1]。为了探究拉莫三嗪抗抑郁作用是否与NMDA受体有关,故在本文中使用了NMDA受体激动剂以及多种拮抗剂,用于探究NMDA受体在拉莫三嗪抗抑郁效果中的作用。
FST以及TST是常用的评估药物抗抑郁作用的实验[11-12],抗抑郁药物能够明显减少动物在FST以及TST中的静止时间。本文结果显示低剂量拉莫三嗪(7mg/kg)不能减少动物在FST以及TST中的静止时间,而中剂量(15mg/kg)以及高剂量拉莫三嗪(30mg/kg)能够减少动物的静止时间,表明拉莫三嗪的抗抑郁效应具有剂量依赖性。虽然在研究中发现大剂量的拉莫三嗪(30mg/kg)能够明显降低小鼠在FST以及TST中的静止时间,但是有研究表明大剂量的拉莫三嗪能够影响啮齿类动物的运动活性[6-7],推测高剂量的拉莫三嗪产生的抗抑郁作用是通过镇静作用产生的。
NMDA受体是谷氨酸受体的一种亚型,研究表明NMDA受体有多个独立受点,位于受体表面的甘氨酸受点以及锌离子受点,还有位于离子通道内的镁离子受点以及苯环哌啶(PCP)受点,药物可以直接作用于这些受点从而影响NMDA受体的功能[10]。MgSO4、氯胺酮以及MK-801均为非竞争性NMDA受体拮抗剂[10]。镁离子在低于正常细胞外液浓度时就能选择性地阻断NMDA受体,这种作用是电位依赖性的,当膜处于更负电位时,其阻断受体的作用最强,作用出现快,是非竞争性的。氯胺酮能够通过PCP受点非竞争性阻断NMDA受体,并且大剂量的NMDA以及谷氨酸均不能翻转其作用。MK-801可以非竞争性特异性拮抗NMDA受体作用,减少谷氨酸的毒性。虽然拉莫三嗪抗抑郁作用主要是通过阻断神经元表面的电压依赖性钠通道,但是拉莫三嗪的抗谷氨酸作用也能够产生一定的抗抑郁效应[15]。同样,拉莫三嗪也能够阻断神经元表面的电压依赖性钙通道[15]。拉莫三嗪除了能够阻断神经元表面的电压依赖性钙通道以及钠通道以外,还能够抑制谷氨酸的释放,进一步增强拉莫三嗪对神经元表面电压依赖性钙通道以及钠通道的抑制作用[15]。本文发现NMDA受体兴奋剂NMDA能够扭转高剂量(30mg/kg)拉莫三嗪的抗抑郁作用,而NMDA受体拮抗剂能够增强拉莫三嗪的抗抑郁作用使原本无抗抑郁作用的低剂量(7mg/kg)拉莫三嗪产生抗抑郁效应,表明拉莫三嗪可能通过NMDA受体发挥抗抑郁作用。这与先前关于NMDA受体拮抗剂参与药物抗抑郁过程的研究相一致[1]。
综上所述,本文证实拉莫三嗪能够产生抗抑郁效应,并且NMDA受体参与这一过程。这一发现不但能够进一步探究抗抑郁药物的作用机制,还为抑郁症的治疗提供了新的策略。
[1] Sanacora G,Zarate CA,Krystal JH,et al.Targeting the glutamatergic system to develop novel,improved therapeutics for mood disorders[J].Nat Rev Drug Discov,2008,7(5):426-437.DOI:10.1038/nrd2462.
[2] Hashimoto K,Sawa A,Iyo M.Increased levels of glutamate in brains from patients with mood disorders[J].Biol Psychiatry,2007,62(11):1310-1316.DOI:10.1016/j.biopsych.2007.03.017.
[3] Volke V,Wegener G,Bourin M,et al.Antidepressant-and anxiolytic-like effects of selective neuronal NOS inhibitor 1-(2-trifluoromethylphenyl)-imidazole in mice[J].Behav Brain Res,2003,140(1-2),141-147.DOI:10.1016/ S0166-4328(02)00312-1.
[4] Harkin A,Connor TJ,Burns MP,et al.Nitric oxide synthase inhibitors augment the effects of serotonin re-uptake inhibitors in the forced swimming test[J].Eur Neuropsychopharmacol,2004,14(4):274-281.DOI:10.1016/ j.euroneuro.2003.08.010.
[5] Zarate CA Jr,Singh JB,Carlson PJ,et al.A randomized trial of an N-methyl-D-aspartate antagonist in treatment-resistant major depression[J].Arch Gen Psychiatry,2006,63(8):856-864.DOI:10.1001/archpsyc.63.8.856.
[6] Bourin M,Prica C.The role of mood stabilisers in the treatment of the depressive facet of bipolar disorders[J].Neurosci Biobehav Rev,2007,31(6):963-975.DOI:10.1016/j.neubiorev.2007.03.001.
[7] Consoni FT,Vital MA,Andreatini R.Dual monoamine modulation for the antidepressant-like effect of lamotrigine in the modified forced swimming test[J].Eur Neuropsychopharmacol,2006,16(6):451-458.DOI:10.1016/ j.euroneuro.2006.01.003.
[8] Haj-Mirzaian A,Kordjazy N,Ostadhadi S,et al.Fluoxetine reverses the behavioral despair induced by neurogenic stress in mice:role of N-methyl-d-aspartate and opioid receptors[J].Can J Physiol Pharmacol,2016,94(6):599-612.DOI:10.1139/cjpp-2015-0429.
[9] Ostadhadi S,Khan MI,Norouzi-Javidan A,et al.Involvement ofnmDA receptors and L-arginine/nitric oxide/cyclic guanosine monophosphate pathway in the antidepressant-like effects of topiramate in mice forced swimming test[J].Brain Res Bull,2016,122:62-70.DOI:10.1016/j.brainresbull.2016.03.004.
[10] Haj-Mirzaian A,Kordjazy N,Haj-Mirzaian A,et al.Evidence for the involvement ofnmDA receptors in the antidepressant-like effect of nicotine in mouse forced swimming and tail suspension tests[J].Psychopharmacology(Berl),2015,232(19):3551-3561.DOI:10.1007/s00213-015-4004-0.
[11] Kordjazy N,Haj-Mirzaian A,Amiri S,et al.Involvement of N-methyl-d-aspartate receptors in the antidepressant-like effect of 5-hydroxytryptamine 3 antagonists in mouse forced swimming test and tail suspension test[J].Pharmacol Biochem Behav,2016,141:1-9.DOI:10.1016/j.pbb.2015.11.009.
[12] Kordjazy N,Haj-Mirzaian A,Amiri S,et al.Elevated level of nitric oxide mediates the anti-depressant effect of rubidium chloride in mice[J].Eur J Pharmacol,2015,762:411-418.DOI:10.1016/j.ejphar.2015.06.030.
[13] Gould TD,Einat H.Animal models of bipolar disorder and mood stabilizer efficacy:a critical need for improvement[J].Neurosci Biobehav Rev.2007;31(6):825-831.
[14] Goldberg JF,Truman CJ.Antidepressant-induced mania:an overview of current controversies[J].Bipolar Disord,2003,5(6):407-420.DOI:10.1016/j.neubiorev.2007.05.007.
[15] Ghasemi M,Montaser-Kouhsari L,Shafaroodi H,et al.nmDA receptor/nitrergic system blockage augments antidepressant-like effects of paroxetine in the mouse forced swimming test[J].Psychopharmacology(Berl),2009,206(2):325-333.DOI:10.1007/s00213-009-1609-1.

