精子核蛋白成熟度与精液常规参数的相关性分析*
杨雪梅,李俊,谭宇哲,王新雪,宋亚曼
(河北医科大学第一医院 生殖医学科,河北 石家庄 050031)
精子细胞成熟为精子时,核内组蛋白被过渡蛋白取代,而后过渡蛋白又被鱼精蛋白取代,形成环形染色质结构。DNA包裹程度加强,染色质凝集水平可达体细胞的6倍,这种特殊的染色质结构可在精子游行于生殖道时保护父源基因组信息[1]。核蛋白成熟度是评价染色质凝集程度的重要参数,可作为评价受精及妊娠的预测指标[2]。常规精液检查是评估男性生育力的重要依据,精液体积、精子浓度、精子总数、前向运动精子比例及正常形态精子等参数常用来评估精液质量,通常认为常规精液参数与受精能力存在相关性[3]。目前,精子核蛋白成熟度与常规精液参数的相关性尚无定论,本研究旨在明确精子核蛋白成熟度与精液体积、精子浓度、精子总数、前向运动精子比例及正常形态精子比例等常规参数的关系。
1 资料与方法
1.1 标本
选取2013年12月-2014年12月该院就诊的371例不育男性患者精液样本。患者平均年龄(30.30±5.76)岁,无精症患者除外,无遗传病家族史。依据精子核蛋白成熟度分为正常组(156例)和异常组(215例)。
1.2 仪器与试剂
精液计算机辅助分析系统由北京伟力公司生产,Diff-Quick染液和精子核蛋白组型转换试剂盒购于深圳博锐德生物科技有限公司。
1.3 方法
1.3.1 精液常规分析 严格按照世界卫生组织第5版人类精液实验室手册[4]行标本检测。患者禁欲2~7 d,手淫法将精液标本完全收集于广口采集杯中,并置于37℃水浴锅中,待标本液化后测量pH值、称量精液体积。使用计算机辅助分析系统检测精子浓度、前向运动精子比例等参数。采用Diff-Quick法行精子染色,分析正常形态精子比例。
1.3.2 精子核蛋白组型转换检测 精子核蛋白组型转换采用苯胺蓝染色法(深圳博锐德公司)分析精子核蛋白成熟度,操作步骤详见试剂盒说明书。正常参考值为核蛋白成熟度≥70%。
1.4 统计学方法
数据分析采用SPSS 16.0统计软件,两独立样本采用t检验,相关性分析采用Pearson法。以各精液参数为检验变量,以核蛋白成熟度(正常或异常)为状态变量,使用MedCalc数据分析软件(V15.8)绘制受试者工作特征曲线(receiver operating characteristic curve, ROC),检验变量曲线下面积(area under the cure,AUC),比较采用Z检验,P<0.05为差异有统计学意义。
2 结果
2.1 精子核蛋白成熟度正常组和异常组精液参数的比较
比较两组各精液参数的差异,结果显示,两组的精子浓度、精子总数、前向运动精子比例及正常形态精子比例比较,差异有统计学意义(P<0.05)。见附表。
2.2 核蛋白成熟度与常规精液参数的关系
相关性分析结果显示,核蛋白成熟度与精子浓度(r=0.335,P=0.000)、精子总数(r=0.346,P=0.000)、前向运动精子比例(r=0.240,P=0.000)及正常形态精子比例(r=0.260,P=0.000)呈正相关。见图1。
附表 核蛋白成熟度正常组和异常组各精液参数的比较 (±s)
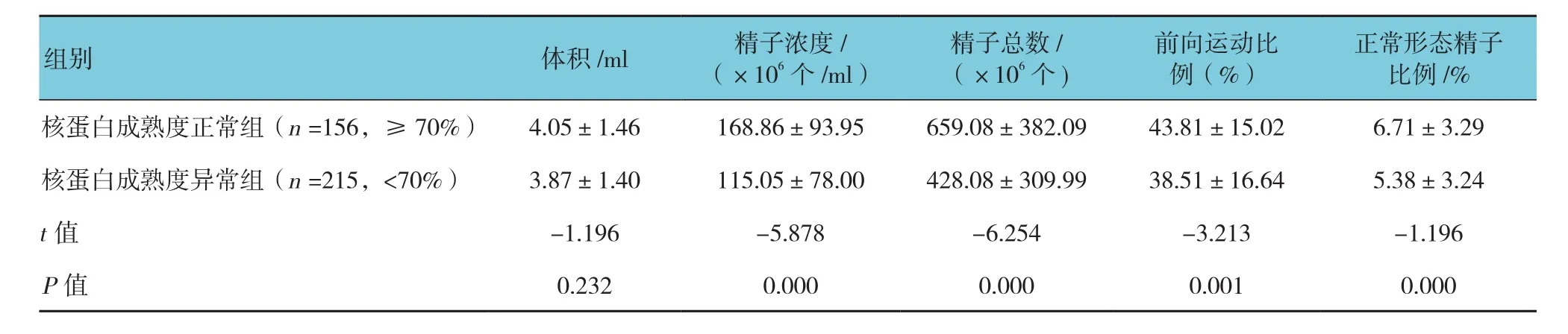
附表 核蛋白成熟度正常组和异常组各精液参数的比较 (±s)
正常形态精子比例/%核蛋白成熟度正常组(n =156,≥70%) 4.05±1.46 168.86±93.95 659.08±382.09 43.81±15.02 6.71±3.29核蛋白成熟度异常组(n =215,<70%) 3.87±1.40 115.05±78.00 428.08±309.99 38.51±16.64 5.38±3.24 t值 -1.196 -5.878 -6.254 -3.213 -1.196 P值 0.232 0.000 0.000 0.001 0.000组别 体积/ml 精子浓度/(×106个 /ml)精子总数/(×106个)前向运动比例(%)
2.3 精液常规参数对核蛋白成熟度的预测价值
精子浓度 [AUC=0.679(95%CI:0.625,0.734),P=0.000]、精子总数 [AUC=0.691(95%CI:0.636,0.746),P=0.000]、前向运动精子比例[AUC=0.594(95%CI:0.536,0.652),P=0.002]及正常形态精子比例[AUC=0.624(95%CI:0.567,0.681),P=0.000]均大于机会参考线下面积(见图2),提示精液常规参数可预测核蛋白成熟度。精子浓度、精子总数的临界值分别为 124.02×106个 /ml、421.72×106个 /ml,前向运动精子比例、正常形态精子比例的临界值分别为35.27%、5.00%;敏感性分别为63.33%、62.38%、46.47%及62.11%;特异性分别为65.22%、70.81%、74.53%及62.11%。综合敏感性和特异性2个指标后,精子总数预测核蛋白成熟度的准确性最高。
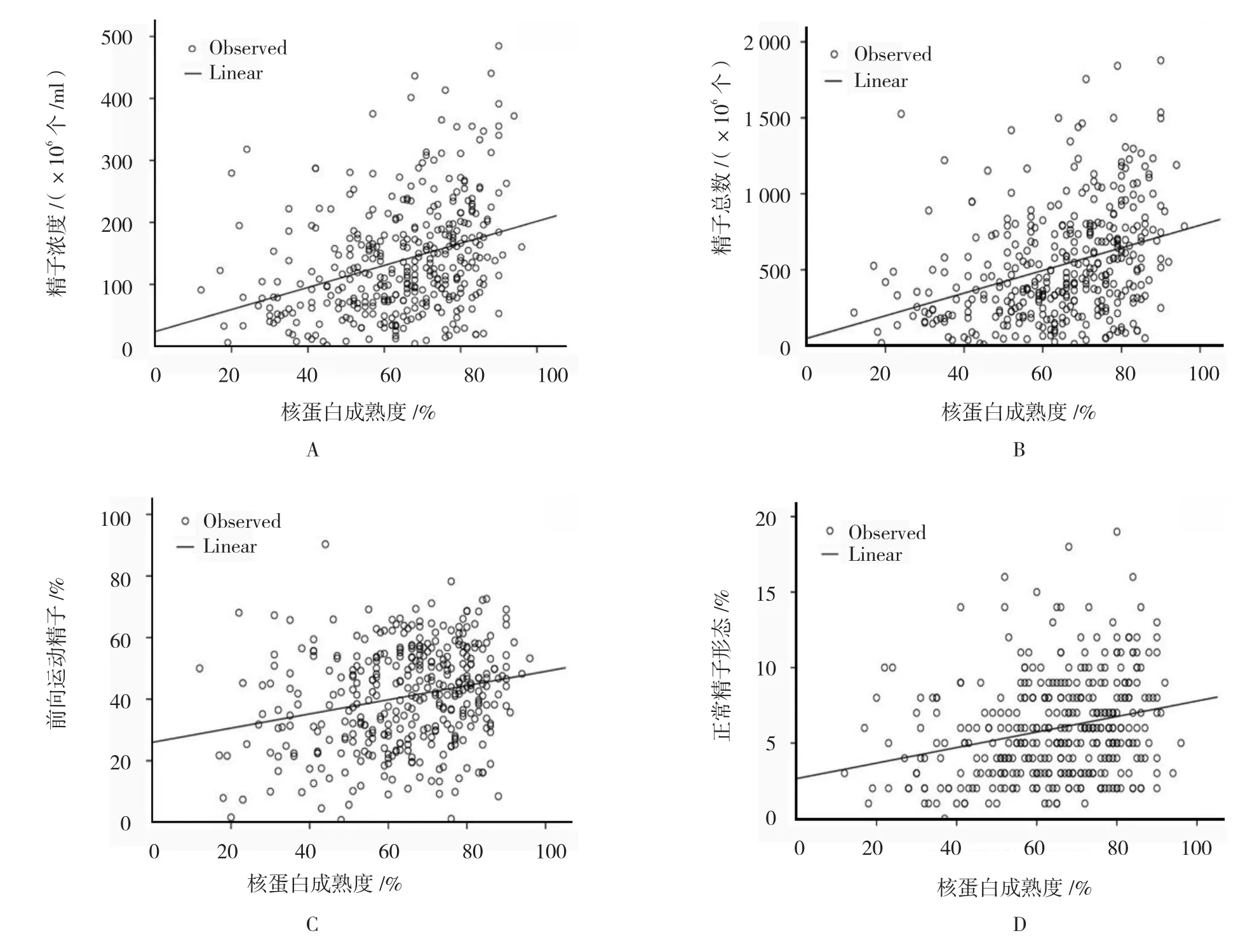
图1 核蛋白成熟度与常规精液参数的相关性分析
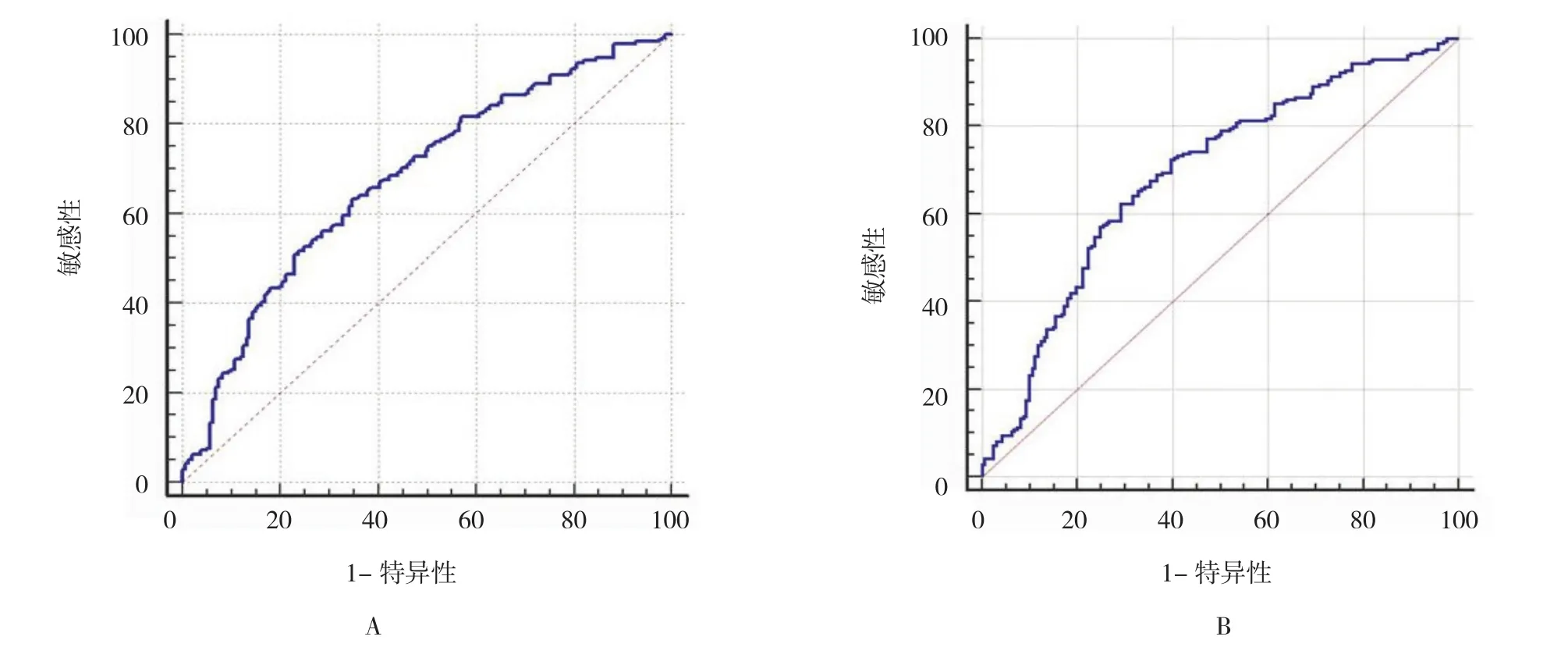
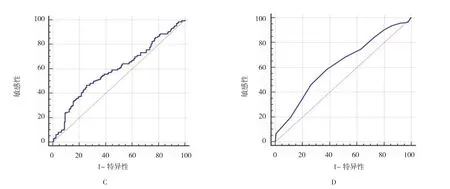
图2 常规精液参数对核蛋白成熟度的预测价值
3 讨论
据报道,全世界有15%的夫妇患有不孕不育症,其中男性因素造成的不育约占50%[5]。对各项预测生育力指标的准确分析是不育症诊断和治疗的基础。常规精液分析是探索男性不育的基本手段,核蛋白成熟度是近年来发现衡量精子功能的重要指标。研究发现,精子染色质成熟度可影响胚胎发育[6],精子染色质凝集异常比例升高时流产率升高[7]。
精子发生过程中,精子核完全重组,经历以染色质凝集为特征的重排,染色质凝集过程包括组蛋白被过渡蛋白取代,过渡蛋白被碱性鱼精蛋白取代,鱼精蛋白与精子核DNA紧密结合成为高度凝集的染色质。基于苯胺蓝染色的核蛋白成熟度检测可有效评估精子染色质致密化情况,苯胺蓝可使富含赖氨酸的组蛋白染色。精子核中组蛋白含量的升高说明组蛋白-过渡蛋白-鱼精蛋白取代异常,影响DNA链折叠,使DNA碎片比例升高,导致精子受精能力下降[8]。
目前,精子核蛋白成熟度与精子浓度、活力的关系尚无定论。研究发现,前向运动精子比例与核蛋白成熟异常呈负相关[9];弱精症患者核蛋白组型转换异常率高于正常活力组[10]。精子总数、活动力与鱼精蛋白含量缺乏呈负相关[3];精子核蛋白对鱼精蛋白比例与精子活力、存活、浓度及总数呈负相关[11],精子核蛋白成熟异常与精子总数、前向运动率降低密切相关[12]。本研究结果显示,精子核蛋白成熟度与精子浓度、总数及前向运动精子比例呈正相关,与上述结论一致。但也有报道认为精子核蛋白成熟度是影响男性不育的独立因素,与精子浓度、活力无关[2,13],分析样本量、分组标准及检测方法可能是导致结果差异的原因。本实验显示核蛋白成熟度与正常形态精子比例呈正相关,与前人研究一致[14-16],说明精子形态异常可能是由精子核致密化不充分造成。
ROC曲线分析表明,精子浓度、前向运动精子比例、精子总数及正常形态精子比例可在一定程度上预测核蛋白成熟度,说明精子发生是一连续过程,核蛋白成熟度降低造成的染色质凝集异常可进一步影响精子浓度、精子总数、前向运动精子比例及正常形态精子比例等常规精液参数,而精液参数的异常又可反映染色质凝集不充分,其参与调控的细胞及分子生物学机制有待于进一步探讨。
综上所述,本研究表明精子核蛋白成熟度与常规精液参数具有相关性,常规精液参数可在一定程度上预测核蛋白成熟度是否正常。
[1]FRANCIS S, YELUMALAI S, JONES C, et al. Aberrant protamine content in sperm and consequential implications for infertility treatment[J]. Hum Fertil, 2014, 17(2): 80-89.
[2]SELLAMI A, CHAKROUN N, BEN ZARROUK S, et al.Assessment of chromatin maturity in human spermatozoa: useful aniline blue assay for routine diagnosis of male infertility[J]. Adv Urol, 2013, 2013(4): 578631.
[3]IRANPOUR F G. Impact of sperm chromatin evaluation on fertilization rate in intracytoplasmic sperm injection[J]. Adv Biomed Res, 2014, 3(1): 229.
[4]World Health Organization. WHO laboratory mannual for the examination and processing of human semen[M]. New York.Cambridge University Press: 2010.
[5]FANG J, WANG S, WANG H, et al. The Cytochrome P4501A1 gene polymorphisms and idiopathic male infertility risk: a metaanalysis[J]. Gene, 2014, 535(2): 93-96.
[6]郑九嘉, 肖仕金, 杨旭, 等. 精子核蛋白组型转换与精液参数、胚胎发育的相关性分析[J]. 中华泌尿外科杂志, 2013, 34(9):694-698.
[7]MOHAMED E E, MOHAMED M A. Effect of sperm chromatin condensation on the outcome of intrauterine insemination in patients with male factor infertility[J]. J Reprod Med, 2012,57(9/10): 421-426.
[8]SATI L and HUSZAR G. Methodology of aniline blue staining of chromatin and the assessment of the associated nuclear and cytoplasmic attributes in human sperm[J]. Methods Mol Biol,2013, 927(927): 425-436.
[9]KAZEROONI T, ASADI N, JADID L, et al. Evaluation of sperm's chromatin quality with acridine orange test, chromomycin A3 and aniline blue staining in couples with unexplained recurrent abortion[J]. J Assist Reprod Genet, 2009, 26(11/12): 591-596.
[10]周宇林, 陈康, 余波澜, 等. 吸烟对男性不育患者精子核蛋白成熟度的影响[J]. 中华男科学杂志, 2013, 19(9): 794-797.
[11]YU B, QI Y, LIU D, et al. Cigarette smoking is associated with abnormal histone-to-protamine transition in human sperm[J].Fertil Steril, 2014, 101(1): 51-57.
[12]孙永. 男性不育患者精子核蛋白组型转换实验的检测与分析[J].山东医学高等专科学校学报, 2013, 35(5): 367-369.
[13]刘居理, 罗明, 卢雪芳, 等. 男性不育患者精子核蛋白组型转换与精子密度及活力分析[J]. 检验医学与临床, 2009, 6(13):1061-1062.
[14]UTSUNO H, MIYAMOTO T, OKA K, et al. Morphological alterations in protamine-deficient spermatozoa[J]. Hum Reprod,2014, 29(11): 2374-2381.
[15]ZINI A, PHILLIPS S, COURCHESNE A, et al. Sperm head morphology is related to high deoxyribonucleic acid stainability assessed by sperm chromatin structure assay[J]. Fertil Steril, 2009,91(6): 2495-2500.
[16]BOITRELLE F, FERFOURI F, PETIT J M, et al. Large human sperm vacuoles observed in motile spermatozoa under high magnification: nuclear thumbprints linked to failure of chromatin condensation[J]. Hum Reprod, 2011, 26(7): 1650-1658.

