早期卵巢癌患者血浆D-二聚体、血清白蛋白联合HE4检测的临床意义*
刘丽丹,吴春林,贺漪,黄浩梁
(湖北省武汉市第一医院 妇科,湖北 武汉 430022)
卵巢癌居女性恶性肿瘤发病率第3,死亡率居高不下[1]。临床中常用检查方式有影像学检查、盆腔检查、CA125和人附睾蛋白(human epididymis protein,HE4)等。传统抗原抗体标志物CA125在卵巢癌患者体内有较高表达,对于晚期卵巢癌的诊断有较高特异性和敏感性,但是对于早期卵巢癌的诊断效能低下,因其在良性卵巢肿瘤、盆腔炎以及消化道肿瘤患者中亦有较高表达[2-3]。HE4是一种分泌蛋白,在正常人卵巢上皮中几乎不表达,仅表达在卵巢癌患者体内,结合卵巢癌特殊临床表现有较高诊断价值[4-5]。上述两种指标均为临床中常用的检测标准,目前临床中新出现两种检测方式:D-二聚体和血清白蛋白。D-二聚体是人体凝血系统产物,在卵巢癌的发病过程中由于肿瘤组织增长血管过度增生,导致人体内D-二聚体浓度增高[6]。吴雪峰等[7]发现卵巢癌患者体内D-二聚体高度表达,不同分期之间表达有差异。血清白蛋白作为新出现的临床检测指标在临床开始应用,恶性肿瘤会引起人体低蛋白血症,故通过检测血清白蛋白进行协助诊断[8]。目前,通过研究发现单一检测指标对于卵巢癌诊断效能较低,而联合两种检测物及以上指标能在一定程度上提高检测效能,值得临床研究。因此,本研究以卵巢癌患者为研究对象,旨在探讨新旧指标对卵巢癌早期诊断的临床意义,为临床诊断早期卵巢癌提供理论依据。
1 资料与方法
1.1 一般资料
选取2015年6月-2016年12在本院妇科经B超或其他影像学检查存在盆腔肿块的患者94例,经病理学切片检测后,分为疾病组(卵巢癌50例)和对照组(良性卵巢肿瘤44例)。疾病组患者年龄18~75岁,平均(44.22±3.43)岁;对照组患者年龄17~70岁,平均(43.31±2.59)岁。纳入标准:①病理学切片确诊患者;②肝、肾功能正常;③均为初次诊断。排除标准:①妇科炎症患者;②其他肿瘤史患者;③患有高血压、糖尿病和心血管等慢性病患者。所有患者及家属均签署知情同意书,该研究获伦理委员会批准。
1.2 方法
对所有疾病组患者进行全面检查,明确其病情并制订详细诊疗计划。针对疾病组患者实施常规抗癌治疗,并根据患者病情变化随时调整治疗方案;对照组患者均采用手术治疗。本研究检测指标包括CA125、CA199、HE4、D-二聚体、甲胎蛋白(alpha-fetoprotein,AFP)、血清白蛋白及卵巢癌风险预测值模型(risk of ovarian malignancy algorithm, ROMA)指数等。
1.3 检查方法
本研究中选取CA199、CA125、HE4、AFP、D-二聚体和血清白蛋白作为检测指标。收集所有患者晨起空腹静脉血3 ml,应用枸橼酸钠抗凝管盛放血液标本,静置5~10 min后,用离心机以3 000 r/min速度离心15 min后待检。血清HE4应用ELISA进行检测,应用Fujirebio Diagnostics AB公司生产试剂盒,并严格依照试剂盒操作规范进行检测。并在FAME自动板式免疫分析仪上进行。血清CA125、CA199应用电化学发光免疫分析仪检测,所用仪器为瑞士罗氏公司E-170生产,配套试剂亦是原装进口,所有质控品均为原装进口配件。采用35 u/ml作为CA125阳性临界值,37 u/ml作为CA199的阳性临界值,并由我国科研人员依据我国特点进行论证。血清D-二聚体采用全自动凝血分析仪,所用试剂盒和配套质控为SIMENS公司,检测前应确保试剂稳定性以及质控的效能性,其临界值为250 μg/L。血清白蛋白应用BCG法检测。所有操作由本院经验丰富的医师完成,均应符合操作规范。
1.4 资料收集
统计住院时两组患者的基线资料,包括:①年龄、体重指数(body mass index, BMI)、经产次数、绝经状况、月经紊乱及经历子宫切除术等。②收集入院时疾病组患者肿瘤分期、病理类型、肿瘤直径、组织学分级及转移状态等指标。肿瘤分期参考2000年FIGO分期,组织分级分为高分化、中分化、低分化,同时记录对照组患者肿瘤类型及例数。③检测指标包括CA125、CA199、HE4、D-二聚体、AFP和血清白蛋白等。根据HE4、CA125检测值与患者绝经状况,利用计算机软件计算ROMA指数,绝经前PI=-12.0+2.38*In[HE4]+0.0626*In[CA125];绝经后 PI=-8.09+1.04*In[HE4]+0.732*In[CA125]。ROMA(%)=[Exp(PI)x100]/[1+Exp(PI)]。
1.5 统计学方法
数据分析采用SPSS 20.0统计软件,计量资料以均数±标准差(±s)表示,采用独立样本t检验。计数资料以(%)表示,采用χ2检验。相关分析用Pearson法;影响因素的分析,采用多因素Logistic回归模型,筛选出罹患卵巢癌的独立影响因素,绘制ROC曲线,P<0.05为差异有统计学意义。
2 结果
2.1 两组的肿瘤分期、组织学分级、病理类型及转移状态比较
疾病组中,FIGO分期显示:Ⅰ期患者17例、Ⅱ期患者8例、Ⅲ期患者20例、Ⅳ期患者5例;卵巢癌组织分级:高分化患者6例、中分化患者29例、低分化患者15例;病理类型包括:高分化的浆液性腺癌10例、低分化的浆液性腺癌13例、子宫内膜样癌7例、黏液性腺癌14例、未成熟畸胎瘤3例、生殖细胞瘤3例;发生腹膜或远处转移的有22例,未发生转移的有28例。对照组中,浆液性囊腺瘤8例、黏液性囊腺瘤15例、成熟性畸胎瘤17例、卵巢纤维瘤2例、平滑肌瘤6例、交界性囊腺瘤2例。
2.2 两组子宫切除术、月经紊乱及绝经比较
疾病组与对照组比较,经χ2检验,差异无统计学意义(P>0.05)。见表1。
2.3 两组患者基线资料比较
两组的CA125、CA199、HE4、D-二聚体、AFP、血清白蛋白、ROMA指数比较,经独立样本t检验,差异有统计学意义(P<0.05);年龄、BMI、经产次数,差异无统计学意义(P>0.05)。见表2。
2.4 多因素非条件Logistic回归分析
为进一步了解上述因素与患者罹患卵巢癌的关系,并控制混杂因素,进行多因素非条件Logistic回归分析,以是否患有卵巢癌为因变量,以CA125、CA199、HE4、D-二聚体、AFP、血清白蛋白及ROMA指数为自变量,采用向后逐步法(似然比),引入水平为0.05,剔除标准为0.01。本研究发现,D-二聚体、ROMA指数、HE4和CA125是患者罹患卵巢癌的危险因素1.481)(1.292,1.470)(1.011,1.743)(1.305,1.638),P=0.037、0.034、0.042和0.040];血清白蛋白是患者罹患卵巢癌的保护因素0.953),P=0.039]。见表3。

表1 两组患者子宫切除术、月经紊乱及绝经比较 例(%)
表2 两组患者基线资料比较 (±s)
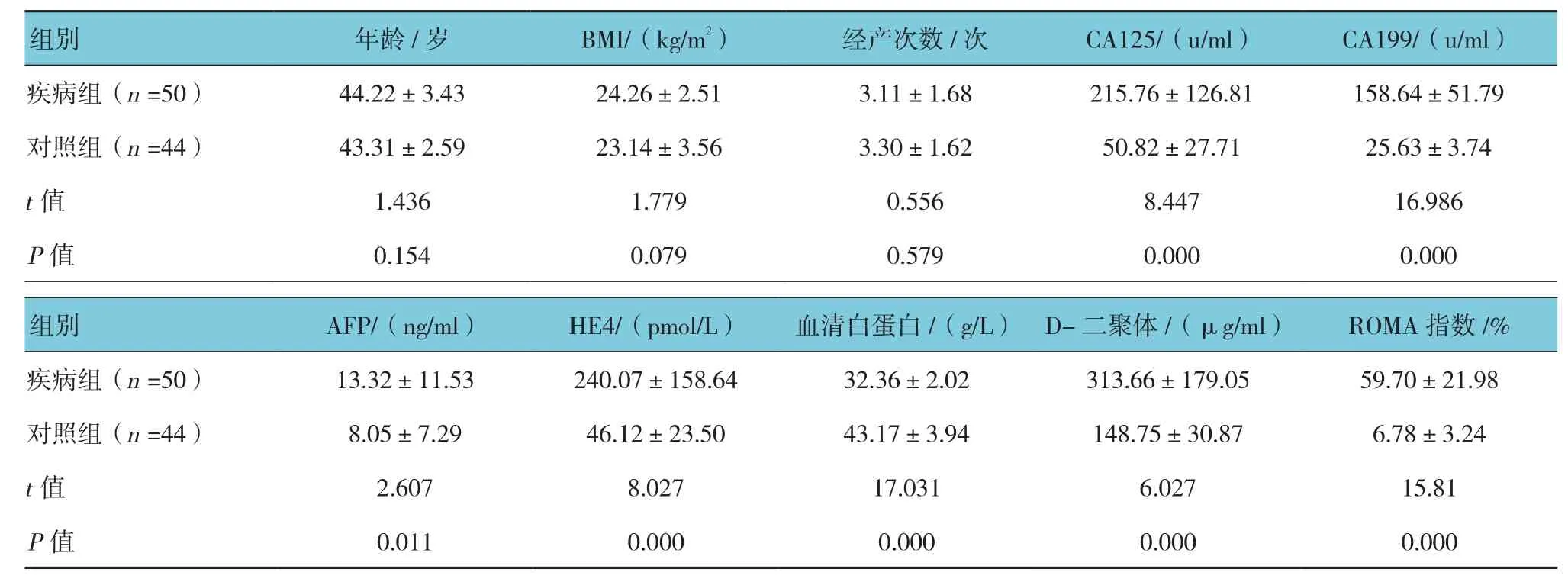
表2 两组患者基线资料比较 (±s)
组别 年龄/岁 BMI/(kg/m2) 经产次数/次 CA125/(u/ml) CA199/(u/ml)疾病组(n =50) 44.22±3.43 24.26±2.51 3.11±1.68 215.76±126.81 158.64±51.79对照组(n =44) 43.31±2.59 23.14±3.56 3.30±1.62 50.82±27.71 25.63±3.74 t值 1.436 1.779 0.556 8.447 16.986 P值 0.154 0.079 0.579 0.000 0.000组别 AFP/(ng/ml) HE4/(pmol/L) 血清白蛋白/(g/L) D-二聚体/(μg/ml) ROMA指数/%疾病组(n =50) 13.32±11.53 240.07±158.64 32.36±2.02 313.66±179.05 59.70±21.98对照组(n =44) 8.05±7.29 46.12±23.50 43.17±3.94 148.75±30.87 6.78±3.24 t值 2.607 8.027 17.031 6.027 15.81 P值 0.011 0.000 0.000 0.000 0.000

表3 诊断指标的Logistic分析
2.5 各指标与传统血清CA125的相关性分析
采用Pearson相关性分析D-二聚体、血清白蛋白、HE4、ROMA指数与传统指标CA125的相关性,由表4可知,HE4与CA125呈正相关(r=0.563,P=0.023);D-二 聚 体 与 CA125呈 正 相 关(r=0.412,P=0.045);ROMA指数与CA125亦呈正相关(r=0.684,P=0.028);血清白蛋白与CA125呈负相关(r=-0.432,P=0.037)。见表4。

表4 各指标与CA125的相关性分析
2.6 各指标对早期卵巢癌患者诊断价值的比较
ROC结果提示,血清白蛋白联合HE4、D-二聚体联合HE4、血清CA125及ROMA指数诊断早期卵巢癌的ROC曲线下面积分别为0.859、0.765、0.654和0.700。3者比较,血清白蛋白联合HE4的AUC最高,其敏感性为78.4%,特异性为100%;其次为D-二聚体联合HE4,敏感性和特异性分别为76.5%和69.8%。CA125的最佳诊断点为78.73,敏感性为55.1%,特异性为100%;ROMA指数的敏感性和特异性分别为70.6%和62.8%,见附图。

附图4种检测指标和诊断效能的ROC曲线
3 讨论
卵巢癌为女性常见恶性肿瘤之一,全球发病率逐年增加,死亡率亦不断上升。其主要临床表现为疼痛、月经不调、消瘦、下腹包块和腹腔积液等[9]。早期诊断卵巢癌有利于改善患者预后,能提高患者5年生存率。临床上诊断卵巢癌的首选检测指标为CA125,广泛应用于临床诊断及预后监测,但其早期诊断假阳性率高,诊断效能较低[10],李力等[11]研究发现,Ⅰ期卵巢癌患者有一半血清CA125水平亦处于正常范围内,可见CA125用于早期卵巢癌的诊断价值仍有待提升。HE4相比CA125更具特异性,在卵巢癌早期诊断中的价值不可忽视。然其发现时间较短,诊断价值未能得到深入研究。且其数值的变化可能与多种因素如年龄、吸烟、肾功能及绝经相关,故不足以成为诊断卵巢癌的独立标志物,常作为CA125的补充[12-13]。目前常用卵巢癌标志物应用于早期诊断时,均具有不同程度的局限性。正因为如此。寻找一种或多种联合敏感性和特异性较强的肿瘤标志物已成为现阶段临床工作的重点和热点之一。
D-二聚体是重要的纤溶活性指标,常与凝血功能障碍疾病相关[14]。近几年来,国内外研究均提示其与卵巢癌存在紧密联系。卵巢癌患者由于血管恶行增生,血管内皮损伤加重,打破了机体内正常凝血及纤溶的平衡,导致D-二聚体水平的升高[15-16]。WU等[17]的研究亦证实了这一理论,认为D-二聚体水平的升高与卵巢癌的浸润程度密切相关。本结果显示,患者基线资料在两组中并无差异,作为诊断指标或影响因素的临床价值并不理想,多因基线资料特异性敏感性较低,与多种疾病存在联系,且样本量有限,发展趋势不明显。血清白蛋白检测卵巢癌是国内较新的研究方向,相关文献较少,其过去主要用于腹水患者消化性疾病的检测。而腹水亦是卵巢癌患者的典型症状之一,肿瘤的增殖和腹腔转移刺激腹水产生,此时血清白蛋白降低,将再次促进腹水的产生。血清白蛋白的的降低极可能预示卵巢癌患者的恶行进展,这与国外学者ATASEVEN[18]的研究结论一致。
多因素Logistic回归分析结果显示,D-二聚体、血清白蛋白、HE4、CA125及ROMA指数对诊断早期卵巢癌有影响且ROMA指数影响程度最大,提示上述指标与早期卵巢癌关系紧密,具有潜在诊断价值。
CA125是目前临床上诊断卵巢癌的传统指标,其诊断价值已得到证实。相关性分析显示D-二聚体、血清白蛋白、HE4、ROMA指数与CA125有相关性,提示上述指标可作为早期卵巢癌的辅助诊断指标。
ROC曲线结果显示,血清白蛋白联合HE4的曲线下面积最高,D-二聚体联合HE4靠后。提示血清白蛋白联合HE4对早期卵巢癌具有一定的诊断价值,比其他3个指标的诊断效能高,可作为早期卵巢癌患者的理想诊断指标之一,联合其他临床诊断方法,进行早期诊断。
本研究尚存在不足,研究对象例数较少,纳入可能诊断早期卵巢癌的指标较少。笔者将在后续研究中,进一步增加样本数量,尽可能纳入更多诊断指标,将新指标与传统指标进行联合诊断,进一步寻找一种敏感性和特异性较强的卵巢癌诊断指标。
[1]边策, 姚奎, 赵际童,等. 晚期卵巢癌患者对新辅助化疗的反应及预后差异分析[J]. 实用妇产科杂志, 2015, 31(12): 942-947.
[2]董素民, 李文澎, 张秀玲,等. 血清CA125、CA199、VEGF-C联合检测对卵巢癌淋巴结转移的诊断价值[J]. 山东医药, 2016,56(10): 86-87.
[3]GASIOROWSKA E, MICHALAK M, WARCHOL W, et al.Clinical application of HE4 and CA125 in ovarian cancer typeⅠand typeⅡdetection and differential diagnosis[J].Ginekologia Polska, 2015, 86(2): 88-93.
[4]贾素娟, 王治洁, 张美琴, 等. 血清CA125、HE4和影像学检查在上皮性卵巢癌术后复发诊断中的应用价值[J]. 中国癌症杂志,2015, 25(6): 452-456.
[5]胡向丹, 肖静, 翟秋丽, 等. 卵巢癌患者血清HE4、CA125水平变化及临床意义[J]. 山东医药, 2017, 57(12): 58-60.
[6]SAKURAI M, SATOH T, MATSUMOTO K, et al. High pretreatment plasma D-dimer levels are associated with poor prognosis in patients with Ovarian cancer independently of venous thromboembolism and tumor extension[J]. International Journal of Gynecological Cancer, 2015, 25(4): 593-598.
[7]吴雪峰, 李晓鸥, 张晓伟. 卵巢癌患者血浆D-二聚体水平与静脉血栓栓塞的关系研究[J]. 中国实验诊断学, 2016, 20(10):1718-1720.
[8]HARADA T, NAKAMURA Y, SATO K, et al. Near-infrared photoimmunotherapy with galactosyl serum albumin in a model of diffuse peritoneal disseminated ovarian cancer[J]. Oncotarget,2016, 7(48): 79408-79416.
[9]SUNDAR S, NEAL R D, KEHOE S. Diagnosis of ovarian cancer[J]. BMJ, 2015, 351(5): 1283-1295.
[10]YAMADA T, HATTORI K, SATOMI H, et al. Mitotically active cellular fi broma of the ovary: a case report and literature review[J]. Journal of Ovarian Research, 2015, 8(1): 65.
[11]李力, 阳志军, 王琪. 卵巢上皮性癌标志物的现状与未来[J].中华妇产科杂志, 2017, 52(1): 4-7.
[12]MOORE R G, MCMEEKIN D S, BROWN A K, et al. A novel multiple marker bioassay utilizing HE4 and CA125 for the prediction of ovarian cancer in patients with a pelvic mass[J].Gynecol Oncol, 2009, 112(1): 40-46.
[13]刘洋, 李凤, 张琨, 等. CA125联合CA199及HE4诊断卵巢癌价值的Meta分析[J]. 中国妇幼保健, 2017, 32(6): 1339-1342.
[14]FOLSOM A R, GOTTESMAN R F, APPIAH D, et al. Plasma D-dimer and incident ischemic stroke and coronary heart disease:the atherosclerosis risk in communities study[J]. Stroke, 2016,47(1): 18.
[15]李达, 何静. 妇科恶性肿瘤患者凝血功能及D-二聚体水平变化及意义[J]. 中华实用诊断与治疗杂志, 2016, 30(6): 596-597.
[16]SAKURAI M, SATOH T, MATSUMOTO K, et al. High pretreatment plasma D-dimer levels are associated with poor prognosis in patients with ovarian cancer Independently of venous thromboembolism and tumor extension[J]. International Journal of Gynecological Cancer, 2015, 25(4): 593.
[17]WU J, FU Z, LIU G, et al. Clinical significance of plasma D-dimer in ovarian cancer: a meta-analysis[J]. Medicine, 2017, 96(25):e7062.
[18]ATASEVEN B, DU B A, REINTHALLER A, et al. Pre-operative serum albumin is associated with post-operative complication rate and overall survival in patients with epithelial ovarian cancer undergoing cytoreductive surgery[J]. Gynecologic Oncology,2015, 138(3): 560-565.

