阿伦磷酸钠缓释微球局部抗骨质疏松效果研究
刘志,林卫佳
(河北北方学院附属第一医院,河北 张家口 075000)
骨质疏松性骨折是骨质疏松症最具有破坏性的并发症[1],常见部位为脊柱、髋部和前臂远端,根本问题是骨密度降低。常规的手术治疗只能解决骨折复位,不能解决骨密度降低这一根本问题,而现有的骨质疏松治疗以提升全身骨密度为目的,无法达到对易骨折部位的重点防护。利用生物工程技术制造的阿伦磷酸钠缓释微球可以缓慢、持续释放阿伦磷酸钠,达到局部药物高浓度,全身药物低浓度的效果。所以本研究采用阿伦磷酸钠缓释微球对骨质疏松易骨折部位进行局部重点治疗。
1 材料与方法
1.1 材料
骨质疏松大鼠50只,清洁级,6月龄,体重285~310 g,由中国人民解放军军事医学科学院实验动物中心提供。利用聚乳酸-羟基乙酸聚合物(Poly lacticco-glycolic acid, PLGA)作为载体材料,将阿仑膦酸钠作为载体药物,利用快速膜乳化结合W/O/W法,合成阿伦磷酸钠缓释微球,测量微球粒径(1.951±0.617)μm,实际载药率(2.74±0.16)%,包封率(71.15±4.27)%,由中国科学院化学研究所提供。
1.2 方法
1.2.1 分组 将骨质疏松大鼠随机分为4组,第1组20只,其余各组每组10只,第1组为对照组,常规饲养(A组);第2组为全身给药组,灌胃给药,每只大鼠按照阿仑膦酸钠0.5 mg/(kg·d)(B组);第3组为空白微球组(C组);第4组为载药微球组(D组)。
1.2.2 皮下植入试验 从A组随机抽取10只大鼠,2%戊巴比妥钠腹腔麻醉,于右后支股骨外侧切开皮肤及筋膜,钝性分离肌肉,将适量环氧乙烷消毒过的载药微球植入组织间隙,逐层缝合筋膜及皮肤,常规消毒伤口后,无菌辅料包扎。大鼠清醒后单独饲养,每天注射青霉素8万u,持续3 d,密切观察动物进食、活动情况,重点观察切口有无感染及脓液形成。A组剩余大鼠继续常规饲养。
1.2.3 药物干预 将载药微球87 mg溶于2 ml生理盐水中,取D组大鼠左侧股骨中部为注射点,常规消毒后,进针到股骨部位后给予注射治疗。C组大鼠注射步骤同上,注射微球为空白微球。C组以及D组每2周注射1次,共注射4次。
1.2.4 皮下植入试验检测 于2和4周时,分别断颈处死5只大鼠,按原切口进入手术部位,观察周围组织愈合情况,取手术部位周围0.5 cm范围的组织,甲醛固定后,常规病理切片,HE染色。
1.2.5 骨密度检测 术后第8周断颈处死所有大鼠,取左侧股骨,D组大鼠取双侧股骨,利用双能X射线骨密度测量仪,选择动物模式,测量范围为股骨中部上下5 mm,分别测量4组大鼠左侧股骨骨密度,比较各组骨密度变化情况。D组大鼠额外测量双侧股骨骨密度,对比双侧骨密度有无变化。测量完成后,所有大鼠股骨冷冻保存。
1.2.6 生物力学检测 将大鼠股骨于冷冻条件下取出,进行骨应力检测。将股骨放在万能材料试验机上,用生理盐水润湿股骨标本,保持标本湿润,进行三点弯曲试验,双侧承载的跨距为3 cm,加载点为所取股骨的中段,速度为2 mm/min,测定股骨骨折时的最大载荷值。
1.3 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,采用t检验或方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠饲养情况
A组大鼠于试验开始后第2天死亡1只,考虑为运输过程及饲养环境改变所致。B组大鼠于开始灌胃后第4天、第6天各死亡1只,解剖发现大鼠胃部肿胀,局部血肿形成,考虑为灌药过程中损伤胃体引起局部梗阻死亡。其余大鼠术后正常饲养,
2.2 载药微球皮下植入后情况
2周时,肉眼观察可见载药微球大部分被肌肉组织包裹,周围肌肉组织无炎症反应,无坏死,无脓性分泌物。4周时,可见载药微球完全被肌肉组织包裹,手术部位瘢痕愈合,周围组织无感染,无脓性分泌物。证明载药微球未引起周围组织排斥反应。组织切片可见肌肉组织与载药微球分界处有炎症细胞浸润,4周时炎症细胞较2周时减少,说明载药微球植入皮下未引起异物排斥反应。见附图。
2.3 4组大鼠治疗后左股骨骨密度比较

附图 载药微球皮下植入试验病理检测结果 (HE×400)
各组大鼠治疗后左股骨骨密度测定结果,经方差分析,差异有统计学意义(F=22.207,P=0.000),B组、D组较A组骨密度增加(P<0.05),C组与A组骨密度差异无统计学意义(P>0.05),D组骨密度高于B组(P<0.05),见附表。D组大鼠测量双侧股骨骨密度,左侧(0.172±0.011)g/cm2,右侧(0.144±0.010)g/cm2,经t检验,差异有统计学意义,左侧股骨骨密度高于右侧(t=6.532,P=0.000)。
2.4 4组大鼠治疗后左股骨生物力学比较
各组大鼠治疗后左股骨应力检测结果,经方差分析,差异有统计学意义(F=14.019,P=0.000),B组、D组较A组三点弯曲最大载荷值增加(P<0.05),C组与A组三点弯曲最大载荷值差异无统计学意义(P>0.05),D组三点弯曲最大载荷值高于B组(P<0.05),见附表。D组大鼠双侧股骨骨应力测试结果,左侧(171.86±6.38)N/m2,右侧(156.16±7.78)N/m2,经t检验,左侧股骨三点弯曲最大载荷值高于右侧,差异有统计学意义(t=4.939,P=0.000)。
附表4组大鼠治疗后左股骨骨密度及骨应力检测结果(±s)
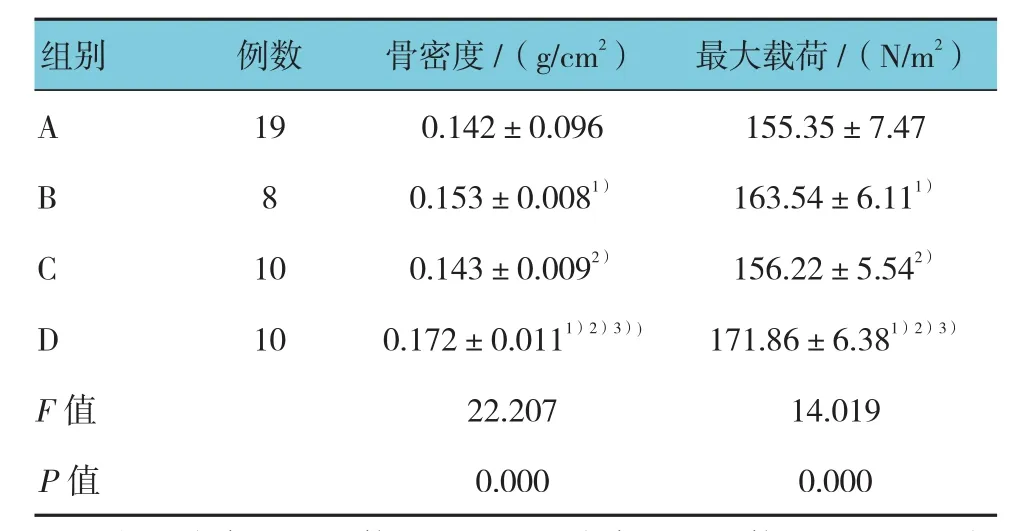
附表4组大鼠治疗后左股骨骨密度及骨应力检测结果(±s)
注:1)与A组比较,P <0.05;2)与B组比较,P <0.05;3)与C组比较,P <0.05
组别 例数 骨密度/(g/cm2) 最大载荷/(N/m2)A 19 0.142±0.096 155.35±7.47 B 8 0.153±0.0081) 163.54±6.111)10 0.143±0.0092) 156.22±5.542)D 10 0.172±0.0111)2)3)) 171.86±6.381)2)3)F值 22.207 14.019 P值 0.000 0.000 C
3 讨论
骨质疏松症是一种以骨量低下,骨微结构损坏,导致骨脆性增加,易发生骨折为特征的全身性疾病[2]。初次发生骨折的患者,未来数年内再次发生骨折的风险增加3~5倍。骨质疏松性骨折与传统骨折大不相同,骨质疏松性骨折的重要诱因是局部骨强度减低,所以增强局部骨强度是预防骨质疏松性骨折的根本。现有的骨质疏松治疗最终目的是增强全身骨强度,不能对易骨折部位进行局部增强,利用缓释材料包裹抗骨质疏松药物进行局部缓释治疗将很好地解决该问题。
双磷酸盐是目前公认的一线预防骨质疏松的药物,此类药物共同的药理作用机制是通过抑制破骨细胞的活性来减慢骨转换速度,进一步增加骨密度来减少骨折的风险[3]。阿仑膦酸钠是第3代双磷酸盐类药物[4],是目前国际防治骨质疏松症的一线药物[5],有研究证明规律服药后可以明显增加骨密度,并减少局部骨折的风险[6-7]。阿仑膦酸钠的主要作用机制是与附着于骨重吸收表面的羟基磷灰石结合,通过抑制破骨细胞活性并促进破骨细胞凋零,进一步增加骨密度[8]。但是阿仑膦酸钠的口服利用率较低,有研究统计为0.7%,并且需要长期服药,患者药物依从性差,有发生消化道溃疡的危险,最主要的是长期服用可引起全身骨转换的过度抑制[9]。本研究利用微球载药实现局部缓释来解决需要长期服药、局部副作用大的不足,利用阿仑膦酸钠在抑制骨转换方面的优势,通过增强局部骨密度对易骨折部位进行重点防御。
当前,主要从骨密度、骨生物力学以及骨的结构等方面来判断骨质疏松的治疗效果,骨密度被认为是反映骨强度和骨折风险的重要指标,在骨质疏松症的研究中具有广泛的应用[10],本结果显示,治疗8周后全身用药组、阿仑膦酸钠载药微球组较对照组骨密度及生物力学有提高。说明阿仑膦酸钠对骨密度的提高有效。局部空白微球组与对照组比较无差异,说明单纯PLGA微球对骨密度及骨质量无影响。阿仑膦酸钠载药微球组左侧骨密度明显大于右侧,左侧股骨骨应力同样强于右侧,说明阿仑膦酸钠载药微球可实现局部缓释,对改善局部骨密度及骨强度效果明显。阿仑膦酸钠载药微球组较全身用药组局部骨密度及骨应力均有提高,说明载药微球可以对阿仑膦酸钠进行很好的缓释作用,阿仑膦酸钠局部应用效果对骨密度及骨质量的改善优于全身用药,与KUMAR等[11]的研究双磷酸盐局部用药较全身用药作用明显增强相符,EINHORN等[12]也证明相同观点。
综上所述,阿伦磷酸钠缓释微球可以实现阿伦磷酸钠的缓慢释放,达到局部药物高浓度,增强局部骨密度及骨质量的目的。
[1]张雪绢, 赵刚, 尚炜. 骨质疏松性骨折围手术期的药物治疗[J].中国骨质疏松杂志, 2014, 20(2): 214-217.
[2]中华医学会骨质疏松和骨矿盐疾病分会, 中华医学会骨科学分会骨质疏松学组, 骨质疏松性骨折患者抗骨质疏松治疗与管理专家共识[J]. 中华骨质疏松和骨矿盐疾病杂志, 2015, 8(3): 189-195.
[3]BARON R. Osteoporosis in 2011: osteoporosis therapy-dawn of the post-bisphosphonate era[J]. Nature Reviews Endocrinology, 2012,8(2): 76-78.
[4]张晓, 江艺, 李慧. 阿仑膦酸钠治疗老年骨质疏松性骨折的体会[J]. 国际医药卫生导报, 2008, 14(19): 64-66.
[5]王飞, 观美华, 刘鹏, 等. 唑来膦酸联合如意珍宝丸及阿法骨化醇片治疗骨质疏松症的疗效[J]. 现代医院, 2013, 13(3): 27-29.
[6]MONTALCINI T, GORGONE G, FAVA A, et al. Pharmacological therapy of osteoporosis[J]. BMC Geriatrics, 2010, 10(Suppl 1):L24.
[7]BACCARO L F, CONDE D M, COSTA-PAIVA L, et al The epidemiology and management of Postmenopausal osteoporosis:a viewpoint from Brazil[J]. Clin Interv Aging, 2015, 10(11): 583-591.
[8]钟伟, 贺良. 双膦酸盐类药物在骨折急性期患者中的应用[J]. 中国骨质疏松杂志, 2007, 13(7): 511-515.
[9]ODVINA C V, ZERWEKH J E, RAO D S, et al. Severely suppressed bone turnover: a potential complication of alendronate therapy[J]. The Journal of Clinical Endocrinology & Metabolism,2005, 90(3): 1294-1301.
[10]遇呈祥, 陈亮, 宴铮剑, 等. 骨密度对骨质疏松性骨折的判断价值[J]. 中国骨质疏松杂志, 2012, 18(2): 127-129.
[11]KUMAR D, KUMAR V, LITTLE D G, et al. Evaluation of biodistribution by local versus systemic administration of 99mTclabeled pamidronate[J]. Journal of OrthoPaedic Science, 2006,11(5): 512-520.
[12]EINHORN T A, MAJESKA R J, MOHAIDEEN A, et al. A single percutaneous injection of recombinant human bone morphogenetic protein-2 accelerates fracture repair[J]. The Journal of Bone &Joint Surgery, 2003, 85(8): 1425-1435.

