烟曲霉COFILIN与人GOSR1蛋白相互作用并抑制HEK293T细胞的增殖
邵骏骅,石 超,王亚倩,霍克克
(1.复旦大学 生命科学学院,上海 200438; 2.复旦大学 遗传工程国家重点实验室,上海 200438)
烟曲霉是一种条件致病的腐生真菌,在自然界中能够产生大量的孢子存活于各种环境中[1].近年来,随着器官移植后免疫抑制剂的广泛应用、艾滋病患者及HIV病毒携带者的增多、对血液病及恶性肿瘤等疾病的放化疗使用等因素,使得免疫受损的人群逐年增长.在这些免疫力低下的人群中,烟曲霉的侵袭感染率高达50%,病死率约90%[2-3].虽然烟曲霉导致的侵袭性肺曲霉病、重症型哮喘、鼻窦炎等疾病的发病率逐年上升,但目前对其发病的分子机理尚未完全清楚,对其早期诊断方法和特效药物研发方面也还没能取得重大的突破,这也意味着烟曲霉将是人类战胜真菌感染的征途上的一大难题[4].
在真核生物中COFILIN基因编码的丝切蛋白(COFILIN)和肌动蛋白解聚因子(Actin Depolymerizing Factor, ADF)是肌动蛋白的结合蛋白,它们可以用来切割或是解聚肌动蛋白的细丝,并且能使细胞骨架产生活力.COFILIN基因序列和结构具有高度的保守性,物种亲缘关系越近则相似度越高[5].它的活性是通过磷酸化、去磷酸化、磷酸肌醇、pH改变等因素进行调节.COFILIN蛋白介导了细胞内的信号途径参与调节细胞内的多种生理活动,如细胞凋亡、胞质分裂、细胞迁移等[6].在诱导物的刺激下,COFILIN能诱导形成片状伪足并调节肌动蛋白骨架重组,从而引导癌细胞的侵袭[7].
已知当病原菌侵染人体时,首先接触到宿主细胞表面,激活细胞内的小G蛋白酶,通过LIMK(LIM kinase)、ROCK(Rho associated protein kinase)等信号分子调节COFILIN的磷酸化,从而在宿主细胞表面形成伪足或丝足,这类伪足或丝足易于病原菌的吸附.接着COFILIN会解开包裹在病原菌周围囊泡后面的肌动蛋白丝,让病原菌顺利侵入细胞[8-9].在这个过程当中,不仅宿主细胞的COFILIN在进行调控,某些病原菌自身的COFILIN也会参与其中[10].当真菌作为病原体侵入人体时,COFILIN也同样发挥着不可替代的作用.前人的研究[11]发现,烟曲霉孢子会引起上皮细胞出现褶皱,这种形态上的改变使得它更易于侵入A549细胞.在整个侵染的过程中,检测到肌动蛋白的骨架会重新排列,并伴随有COFILIN磷酸化循环变化.也有研究报道烟曲霉孢子在侵染A549细胞时会膨胀并与宿主细胞表面的受体结合,诱导细胞内脯氨酸肽酶(Prolidase, PLD)活性升高,从而提高侵染率[12].而当抑制PLD活性时,侵染率显著降低.由于COFILIN与PLD有着密切的信号联系,因此推测在烟曲霉入侵的过程中COFILIN也发挥着重要的作用[13-14].
虽然相关的研究都表明COFILIN在烟曲霉侵染宿主细胞的过程中起到重要的作用,但其具体的作用机制仍未完全清楚.本文以烟曲霉COFILIN为诱饵从人巨噬细胞膜蛋白酵母双杂交文库筛选它的互作蛋白,从蛋白相互作用的角度探索烟曲霉COFILIN在宿主细胞中的作用机制及其生物学效应.
1 材料与方法
1.1 材料
1.1.1 试剂
DNA限制性内切酶SfiⅠ、dNTP Mix、10×DNA Loading Buffer购自TaKaRa公司.EasyTaq DNA Ploymerase、EasyPfu DNA Ploymerase、DNA Ladder购自北京全式金生物技术有限公司.Bacto-Agar、Yeast Nitrogen Base、Annexin V FITC/PE试剂盒购自BD公司.Tryptone和Yeast extract购自Oxoid公司.氨基酸混合物Dropout、X-gal、Triton X-100、HEPES、Nodient P-40、IPTG、Tween-20均购自于Amresco公司.鲑鱼精ssDNA、氨基-1,2,4-三唑(3-AT)、PEG3350、鼠抗Myc、Flag、GST、6×His的单克隆抗体和巯基乙醇以及FACS流式细胞术染色试剂碘化丙锭(PI)均购自Sigma & Aldrich公司.鼠抗GAPDH的单克隆抗体购自Abmart公司.HRP交联的兔抗鼠二抗购自Proteintech公司.细胞培养基DMEM、胎牛血清和胰酶Trypsin-EDTA(0.25%)购自Gibco公司.Lipofectamine 2000脂质体购自Invitrogen公司.蛋白酶抑制剂(protease inhibitor cocktail tables, complete EDTA-free)购自Roche公司.
膜蛋白酵母双杂交试剂盒(DUALmembrane starter kit)购自Dualsystems Biotech公司质粒抽提试剂盒和DNA凝胶回收试剂盒购自Axygen公司.酵母质粒抽提试剂盒购自上海索莱宝生物科技有限公司.PVDF膜、化学发光底物检测试剂(ImmobilonTMWestern Chemiluminescent HRP Substrate, Cat. No. WBKLS0100)均购自Millipore公司.Protein G beads购自GE公司.Glutathione Sepharose 4B购自于Pharmacia Biotech公司.6、12、24和96孔板购自Corning公司.35mm玻底细胞培养皿购自NEST公司.厚滤纸购自上海天能公司.X光片为Kodak公司产品.蛋白预染分子量标准为Thermo Scientific公司产品,其它试剂均为国产分析纯.
1.1.2 克隆、文库、质粒和菌株
烟曲霉COFILIN基因cDNA克隆(AFUA_5G10570)源自A.fumigatusAf293菌株,由军事医学科学院疾病预防控制研究所韩黎教授惠赠.烟曲霉Af293菌株的膜蛋白酵母双杂交文库由本实验室构建.膜蛋白酵母双杂交菌株为S.cerevisiaeNMY32,酵母双杂交诱饵载体质粒为pBT3SUC,猎物载体质粒为pPR3N.大肠杆菌菌株为E.coliBL21(DE3),哺乳动物细胞株分别为HEK293T、HeLa和THP-1.
1.2 方法
1.2.1 膜蛋白酵母双杂交文库筛选及回转验证
将烟曲霉COFILIN基因的cDNA克隆构建到诱饵载体pBT3SUC上并转化酵母NMY32菌株.用化学转化方法将人巨噬细胞cDNA膜蛋白酵母双杂交文库质粒转入已含有诱饵质粒的感受态细胞,涂布SD-Leu-Trp-His-Ade+60mmol/L 3-AT(SD-4)平板进行培养.从文库筛选板上挑取能激活HIS3、ADE2和LacZ3个报告基因的阳性菌落转接到含有更高(120mmol/L)3-AT浓度的(SD-4)平板做进一步鉴定确认.抽提阳性酵母菌落质粒并转化大肠杆菌扩增后进行DNA测序和BLAST分析.对分离得到的阳性克隆质粒再重新回转仅含有诱饵克隆质粒的酵母细胞,以验证相互作用的真实性.
1.2.2 GST pull-down
构建pGEX-5x-1-GOSR1和pET28a-COFILIN两个原核表达质粒,分别表达GST-GOSR1和6×His-COFILIN融合蛋白.将这两个重组质粒和pGEX-5x-1空载体分别转化E.coliBL21(DE3)菌株,活化后以终浓度0.2mmol/L的IPTG在16℃诱导16h.诱导完成后冰浴0.5h,用超声破壁仪裂解菌体得到上清,破壁参数: 220W,破壁2s,暂停3s,60次.将GST-GOSR1和GST蛋白用Glutathione Sepharose 4B珠子纯化,将6×His-COFILIN蛋白用Ni-NTA亲和树脂珠子纯化.将结合有GST融合蛋白的Glutathione Sepharose 4B悬浮于500μL NETN buffer(100mmol/L NaCl,1mmol/L EDTA,20mmol/L Tris-HCl pH 7.0,0.5% Nonidet P-40,1mmol/L PMSF),加入50μL纯化的6×His-COFILIN融合蛋白,4℃结合过夜.沉淀用适量buffer H(20mmol/L Tris-HCl pH 7.7,50mmol/L KCl,20% Glycerol,0.1% Nonidet P-40,0.007% β-巯基乙醇)洗涤3次.沉淀用anti-His单克隆抗体进行Western blot检测.
1.2.3 免疫共沉淀(Co-IP)
构建pEGFP-GOSR1和pEF-Flag-COFILIN这两个真核表达质粒,分别表达GFP-GOSR1和Flag-COFILIN融合蛋白.先将这两个重组质粒连同pEGFP空载体和pEF-Flag-COFILIN作为阴性对照共转染HEK293T细胞,培养48h后收获细胞,用细胞裂解液(150mmol/L NaCl,50mmol/L Tris-HCL,1% NP-40,1mmol/L DTT,5mmol/L EDTA,使用前加入蛋白酶抑制剂)裂解后,取上清加入少量Protein G Agarose亲和凝胶珠子震荡1h进行预沉淀,再加入anti-GFP和Protein G Agarose亲和凝胶珠子震荡过夜进行免疫共沉淀,沉淀用anti-Flag的单克隆抗体进行Western blot检测.
1.2.4 亚细胞共定位
分别构建两组真核表达质粒pEGFP-GOSR1和pDsRED-COFILIN;pEGFP-COFILIN和pDsRED-GOSR1.将转染试剂(LipofectamineTM2000 Transfection Reagent)稀释于Opti-MEM中,轻轻混匀,避免剧烈吹打,3000r/min,3s,室温静置5min;将这两组质粒按照1∶1混合后稀释于Opti-MEM中,轻轻混匀,避免剧烈吹打,3000r/min,3s,室温静置5min.将转染试剂溶液缓慢地滴加到质粒混合溶液中,轻轻混匀,3000r/min,3s,室温静置20min.吸去原来的培养液,更换适量Opti-MEM(约为正常培养液用量的一半),将混合液慢慢加入培养皿中,轻轻晃匀.继续培养24h,用4%多聚甲醛固定,DAPI染细胞核,采用共聚焦显微镜观察结果.
1.2.5 细胞内基因表达检测
用不同剂量的pEF-Flag-COFILIN分别转染HEK293T细胞并转染pEF-Flag空载体和shRNA作为对照.培养48h后收获细胞,加入TRIzol,提取总RNA.选用逆转录引物建立反转录体系,用待检测基因的RT-PCR专用引物,在实时荧光定量PCR仪中进行反应,每个样品进行3个平行反应,相对定量的检测GOSR1基因的表达情况.
1.2.6 流式细胞仪检测细胞周期和凋亡
细胞转染24h后(对数生长期),倒去培养液,胰酶适度消化制成单细胞悬液,用PBS(137mmol/L NaCl, 2.7mmol/L KCl, 10mmol/L Na2HPO4, 2mmol/L KH2PO4)洗两次.打孔: 0.3% Triton X-100至终浓度为0.03%.染色: 加入PI至终浓度为50μg/mL,室温避光染色10min.48μm(300目)滤网过滤,用流式细胞仪(BD FACS)检测细胞周期变化.
细胞转染24h后(对数生长期),加入100mmol/L H2O2至终浓度为2mmol/L处理细胞以诱导凋亡.在37℃培养箱中培养2h.经胰酶适度消化后,用PBS洗两次,用BD FITC Annexin V Apoptosis Detection Kit I检测细胞凋亡.用1×Binding Buffer重悬细胞使细胞浓度约为1.0×106/mL并取100μL转移至5mL离心管.加入5μL Annexin V-FITC和5μL PI,混合均匀,25℃避光反应15min.每个离心管再加入400μL的1×Binding Buffer,上机做检测细胞凋亡情况,1h内完成检测.
2 结 果
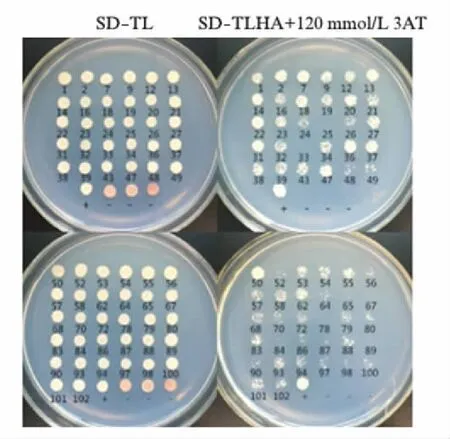
图1 阳性克隆与COFILIN的回转验证结果Fig.1 Rotary verification of the 62 positive clones with COFILIN将62种阳性克隆质粒(其中7号为GOSR1)分别与COFILIN诱饵质粒共转化酵母菌株后接种在SD-TLHA平板培养3d后的结果.不生长或生长极弱者(如: 25、33、78、89号)为没有通过验证.+: 阳性对照(pNubG-Fe65+pTSU2-APP),—: 阴性对照(pPR3N+pTSU2-APP).
2.1 烟曲霉COFILIN能与人GOSR1发生蛋白相互作用
为了寻找烟曲霉菌COFILIN在宿主细胞中的相互作用蛋白,本文采用基于分裂的泛素(split ubiquitin)重构原理建立的膜蛋白酵母双杂交技术筛选人巨噬细胞cDNA文库.首先将构建好的诱饵克隆质粒pBT3SUC-COFILIN转化酵母受体菌株NMY32进行自激活检测,结果显示pBT3SUC-COFILIN存在一定程度的自激活作用,但能被浓度≥60mmol/L的3-AT所抑制.因此,将人巨噬细胞文库质粒DNA转化含有诱饵克隆pBT3SUC-COFILIN的酵母菌株后,先涂布在含有60mmol/L 3-AT的SD-TL平板上进行培养,共得到102个初始阳性菌落.对这些阳性菌落中的质粒进行DNA测序,并对序列进行BLAST比对,结果表明它们分别属于62种蛋白的编码基因克隆.为进一步检验这些阳性克隆序列所表达的蛋白与COFILIN之间的相互作用,将它们再次分别转化含有诱饵克隆pBT3SUC-COFILIN的酵母菌株并涂布含有120mmol/L 3-AT的SD-TLHA平板进行回转验证.结果显示GOSR1等58个阳性克隆通过了回转验证(图1).
2.2 COFILIN与GOSR1的相互作用
为了排除酵母细胞内其他因素介导而产生的假阳性相互作用,我们构建了pGEX-5x-1-GOSR1和pET28a-COFILIN两个原核表达质粒,分别转化大肠杆菌E.coliBL21(DE3)菌株进行表达,经过分离纯化后将这两种融合蛋白进行GST pull-down实验,同时以pGEX-5x-1空载体表达产物为阴性对照.结果显示6×His-COFILIN蛋白能被结合有GST-GOSR1蛋白的亲和树脂珠子吸附,而不能被仅结合GST蛋白的珠子吸附.这表明在体外没有任何其他蛋白介导的情况下,COFILIN可以与GOSR1发生直接的蛋白相互作用(图2).
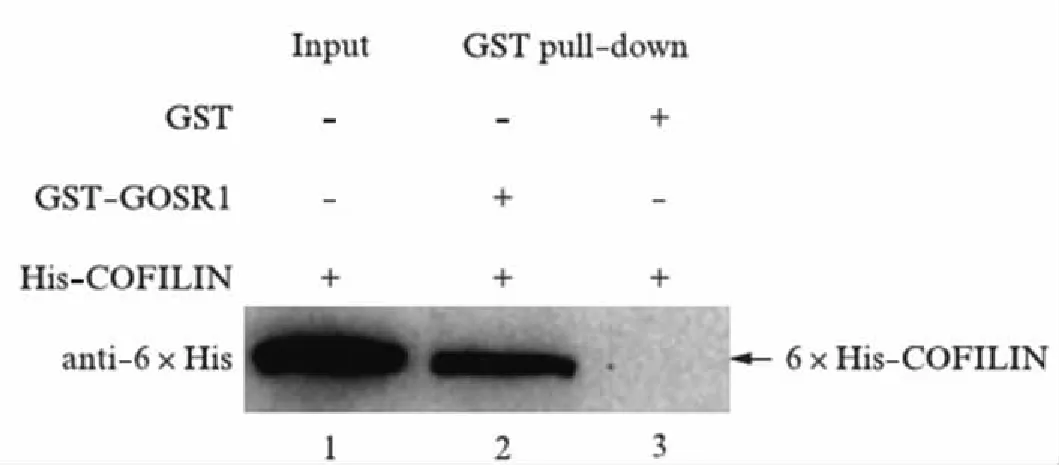
图2 COFILIN与GOSR1在体外的蛋白相互作用验证Fig.2 Verification of the interaction between COFILIN and GOSR1 in vitro1. pET28a-COFILIN表达产物;2. pGEX-5x-1空质粒和pET28a-COFILIN表达产物;3. pGEX-5x-1-GOSR1和pET28a-COFILIN表达产物.
为了进一步了解这两个蛋白在细胞环境内是否真实存在相互作用,我们构建了pEGFP-GOSR1和pEF-Flag-COFILIN这两个真核表达质粒,并将pEGFP-GOSR1分别与pEF-Flag-COFILIN及与pEGFP空载体共转染HEK293T细胞进行表达,将培养收获的细胞裂解液进行Co-IP检测.结果如图3所示,Flag-COFILIN及GFP-GOSR1两种融合蛋白都能顺利表达(泳道3、泳道4),其中结合有GFP-GOSR1融合蛋白的凝胶珠子可以把Flag-COFILIN融合蛋白免疫共沉淀下来(泳道2),而只结合GFP蛋白的珠子则不能共沉淀Flag-COFILIN融合蛋白(泳道1).这表明COFILIN和GOSR1可以在细胞内发生特异性的蛋白直接相互作用.
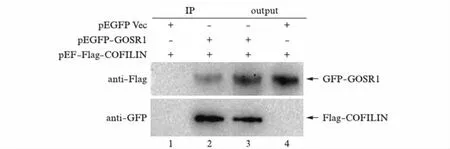
图3 COFILIN与GOSR1在体内的相互作用验证Fig.3 Verification of the interaction between COFILIN interacts and GOSR1 in vivo1和4: pEF-Flag-COFILIN与pEGFP质粒共转染;2和3: pEF-Flag-COFILIN与pEGFP-GOSR1质粒共转染.
2.3 COFILIN与GOSR1相互作用区段的确定
由于全长GOSR1蛋白共有250个氨基酸残基,为了分析GOSR1中与COFILIN蛋白相互作用的结合部位,我们构建了GOSR1的两个截短体: pEGFP-GOSR1△A(1~105 aa)和pEGFP-GOSR1△B(96~250 aa),如图4(a)所示.将pEGFP-GOSR1、pEGFP-GOSR1△A、pEGFP-GOSR1△B和pEGFP空载体分别与pEF-Flag-COFILIN共转染HEK293T细胞,经培养48h后收获细胞做Co-IP实验,用anti-FLAG单克隆抗体检测不同的GOSR1截短体与COFILIN的蛋白相互作用.结果如图4(b)所示,转染有pEGFP-GOSR1和pEGFP-GOSR1△A的细胞可以将Flag-COFILIN共沉淀下来,而pEGFP-GOSR1△B和pEGFP空载体则不能与Flag-COFILIN共沉淀.这表明GOSR1△A和全长GOSR1一样可以与COFILIN在体内发生蛋白相互作用,而GOSR1△B则丧失了与COFILIN发生蛋白相互作用的能力.这提示GOSR1中含有两个Coiled coil结构域的1~105 aa区段是其与COFILIN发生蛋白结合的重要部位.

图4 COFILIN和GOSR1相互作用区域确定Fig.4 COFILIN and GOSR1 Interaction region determination(a) GOSR1的缺失体构建示意图,其中9~30位和68~95位aa内各有一个Coiled coil结构域,230~250位aa为跨膜结构;(b) 1. pEGFP-GOSR1和pEF-Flag-COFILIN共转染为阳性对照;2. 截短体pEGFP-GOSR1△A与pEF-Flag-COFILIN共转染;3. 截短体pEGFP-GOSR1△B与pEFlag-COFILIN共转染;4. pEGFP和pEF-Flag-COFILIN共转染为阴性对照.箭头标示Flag-COFILIN.
2.4 COFILIN与GOSR1在细胞中的共定位
两个蛋白在细胞中具有共同的空间定位是它们之间能发生相互作用的前提条件.为了检验COFILIN与GOSR1在细胞内是否有相互接触并且发生相互作用的基础,我们进行了细胞内荧光共定位检测实验.结果如图5所示,GFP-GOSR1和RED-COFILIN在HeLa细胞内的荧光共定位检测结果显示,GFP-GOSR1仅在细胞质中定位;而RED-COFILIN在整个细胞中都有分布,且在细胞质中的分布量高于细胞核内.GFP-COFILIN和RED-GOSR1在细胞内的荧光共定位检测结果显示,GFP-COFILIN在整个细胞中都有分布,而RED-GOSR1只在细胞质中定位.此实验结果表明虽然GOSR1只定位在细胞质,但由于COFILIN蛋白在整个细胞都有分布,且在细胞质中的含量高于细胞核,因此这两个蛋白具有在细胞质中相遇并发生相互作用的空间基础.
2.5 COFLIN的过表达会抑制GOSR1
为了研究烟曲霉COFILIN蛋白与宿主内源GOSR1蛋白的相互作用会对细胞产生什么生理效应,我们首先通过调节烟曲霉COFILIN表达质粒对HEK293T细胞的转染量,检测COFILIN的过表达对细胞内源GOSR1蛋白表达量的影响.结果如图6所示,随着pEF-Flag-COFILIN转染量的增加,Flag-COFILIN融合蛋白的表达水平也相应提高,但细胞内源GOSR1蛋白的表达量均显著低于仅转染pEF-Flag空载体的阴性对照.提示烟曲霉COFILIN的过表达会使细胞内源GOSR1的蛋白表达受到抑制.
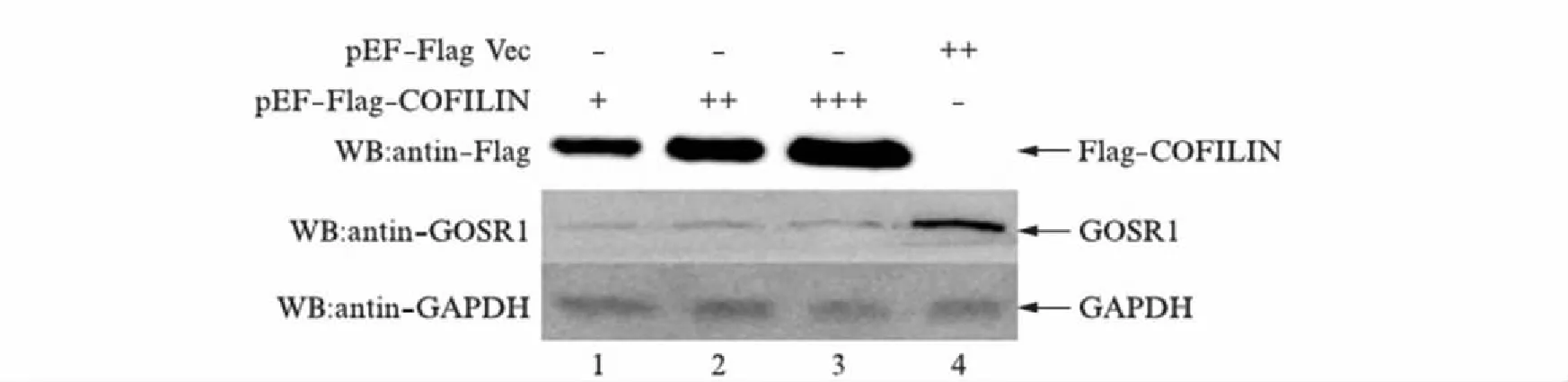
图6 过表达COFILIN在蛋白水平上抑制GOSR1Fig.6 COFILIN decreases the protein expression of endogenous GOSR1泳道从1到4依次是转染pEF-Flag-COFILIN 1μg、2μg、3μg和pEF-Flag空载体2μg到HEK293T细胞.
因GOSR1是具有重要功能的蛋白质,如果COFILIN抑制了它的表达,势必会引起一系列生物学效应.为了确认这些效应是由于这两个蛋白相互作用引起的,我们通过RNA干扰改变细胞内GOSR1蛋白的表达水平,作为后续实验的对照.小分子的RNA能够在转录水平与目的基因的mRNA结合,从而抑制该基因的表达.本实验共设计了3条针对GOSR1的shRNA(shRNA768、shRNA769、shRNA770)用于在HEK293T细胞内瞬时表达,以削减内源GOSR1的表达.
为了进一步分析COFILIN对GOSR1表达的抑制是发生在蛋白水平还是转录水平,我们又进行了实时荧光定量PCR实验.将不同量的pEF-Flag-COFILIN、pEF-Flag空载体以及shRNA768分别转染HEK293T细胞,并在12孔板培养,转染48h后,通过抽提总RNA,逆转录合成cDNA,进行RT-PCR检测,对每个样品中的每个基因都做3个平行重复.
实时定量PCR实验的结果显示,作为阳性对照的shRNA可以显著降低内源GOSR1的mRNA水平,在用不同剂量转染pEF-Flag-COFILIN质粒的3组细胞内,GOSR1的mRNA水平都不同程度地低于阴性对照组,但降低幅度与pEF-Flag-COFILIN质粒转染量并不呈现正相关性.表1、图7(看第160页)表明烟曲霉的COFILIN对GOSR1在转录和翻译的水平都有抑制,但主要表现在翻译水平.
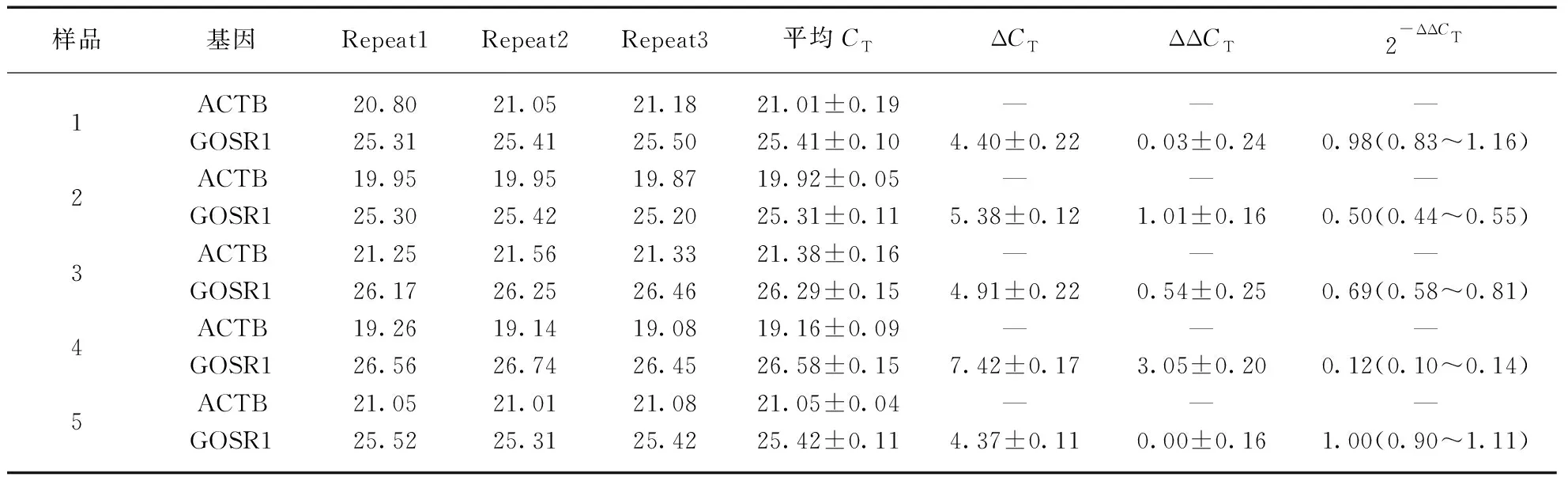
表1 RT-PCR检测GOSR1相对hACTB的mRNA水平
注: 样品1、2、3分别转入了pEF-Flag-COFILIN重组质粒0.5μg、1μg、2μg;样品4转入了shRNA768作为阳性对照;样品5转入了pEF-Flag空载体2μg作为阴性对照.以转入pEF-Flag空载体的细胞内GOSR1的mRNA水平为参照,荧光定量PCR检测不同转染条件下细胞内GOSR1与内参ACTB(Actin-β)的相对mRNA水平.
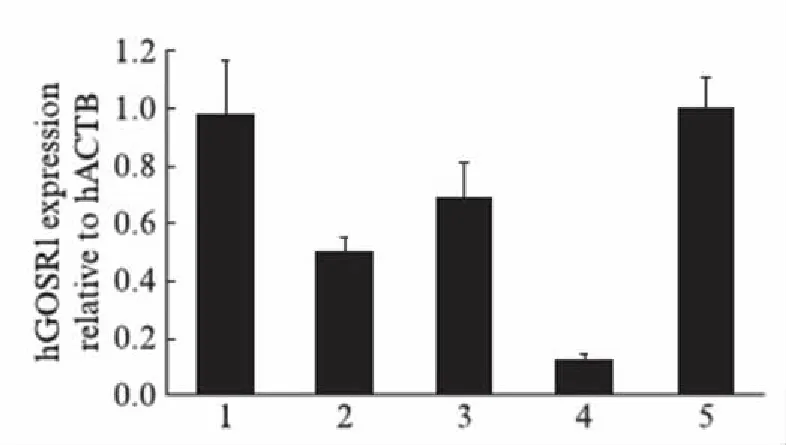
图7 GOSR1相对hACTB的mRNA水平Fig.7 mRNA levels of endogenous GOSR1 relative to hACTB样品1、2、3依次转入了pEF-Flag-COFILIN重组质粒0.5μg、1μg、2μg;样品4转入了shRNA768作为阳性对照;样品5转入了pEF-Flag空载体2μg作为阴性对照.
2.6 COFILIN的过表达会抑制细胞增殖
为研究COFILIN与GOSR1相互作用对细胞的生理效应,我们又检测了这对蛋白互作对HEK293T细胞增殖的影响.本实验共设置了3个实验组,第一组转染pEF-Flag空载体和pEF-Flag-COFILIN,第二组转染pEGFP空载体和pEGFP-GOSR1,第三组分别转染CON55(阴性对照)、shRNA768、shRNA769和shRNA770.培养24h后,采用MTT细胞活性法(OD490)对细胞的增殖情况进行检测.结果如图8所示,烟曲霉COFILIN的过表达会抑制细胞增殖(图8(a)),内源GOSR1的过表达能促进细胞增殖(图8(b)),但敲减内源GOSR1的表达会抑制细胞增殖(图8(c)).提示烟曲霉COFILIN通过与内源GOSR1相互作用降低后者表达而使细胞增殖受到抑制.
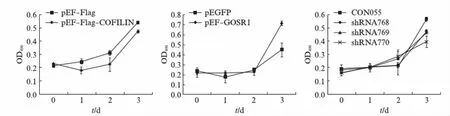
图8 MTT细胞活性检测Fig.8 MTT cell activity assay(a) pEF-Flag空载体和pEF-Flag-COFILIN共转染HEK293T细胞;(b) pEGFP空载体和pEGFP-GOSR1共转染HEK293T细胞;(c) CON55对照质粒分别与shRNA768、shRNA769、shRNA770共转染HEK293T细胞.
2.7 COFILIN与GOSR1的相互作用影响细胞周期
为进一步了解烟曲霉COFILIN过表达导致细胞增殖减缓所产生的细胞生物学效应,我们又检测了它对细胞周期的影响,检测结果如图9所示.
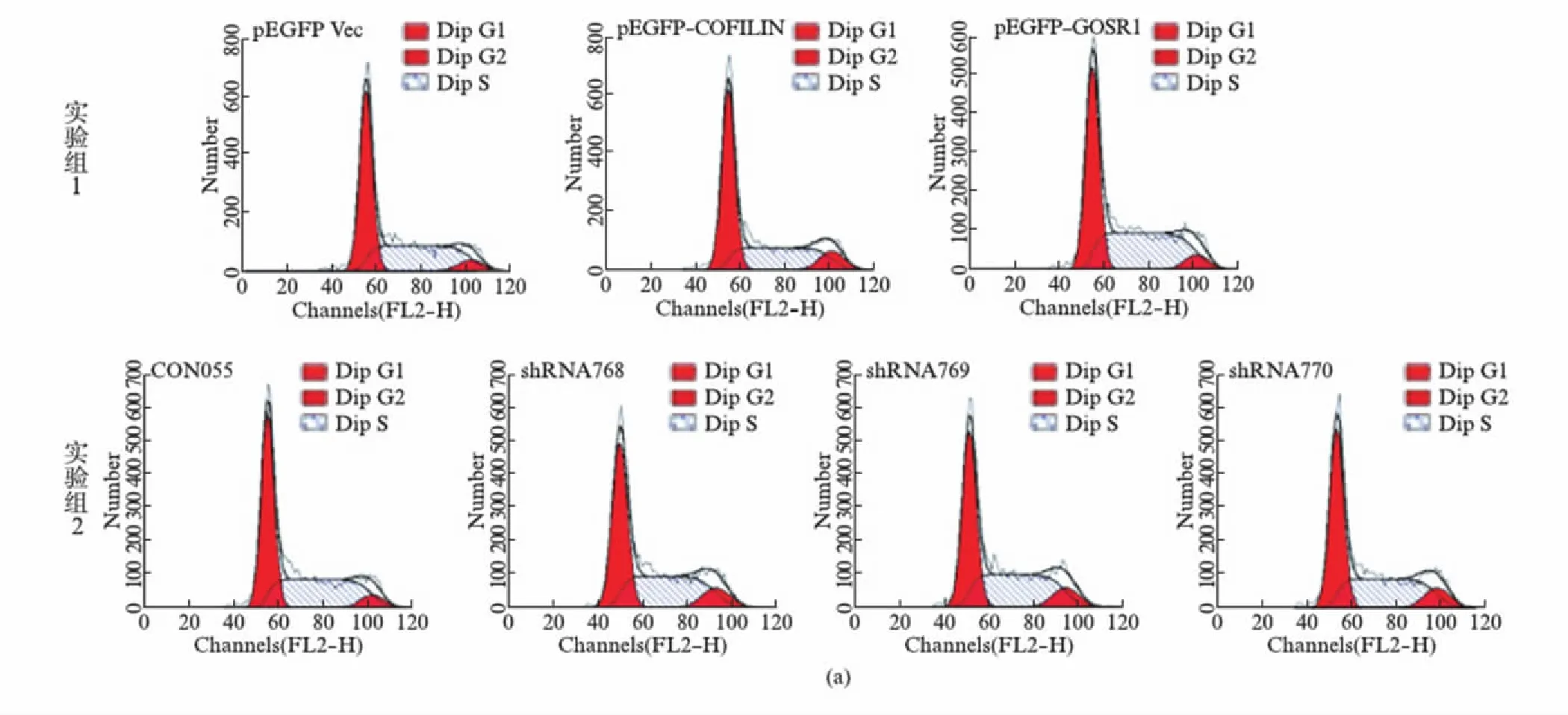
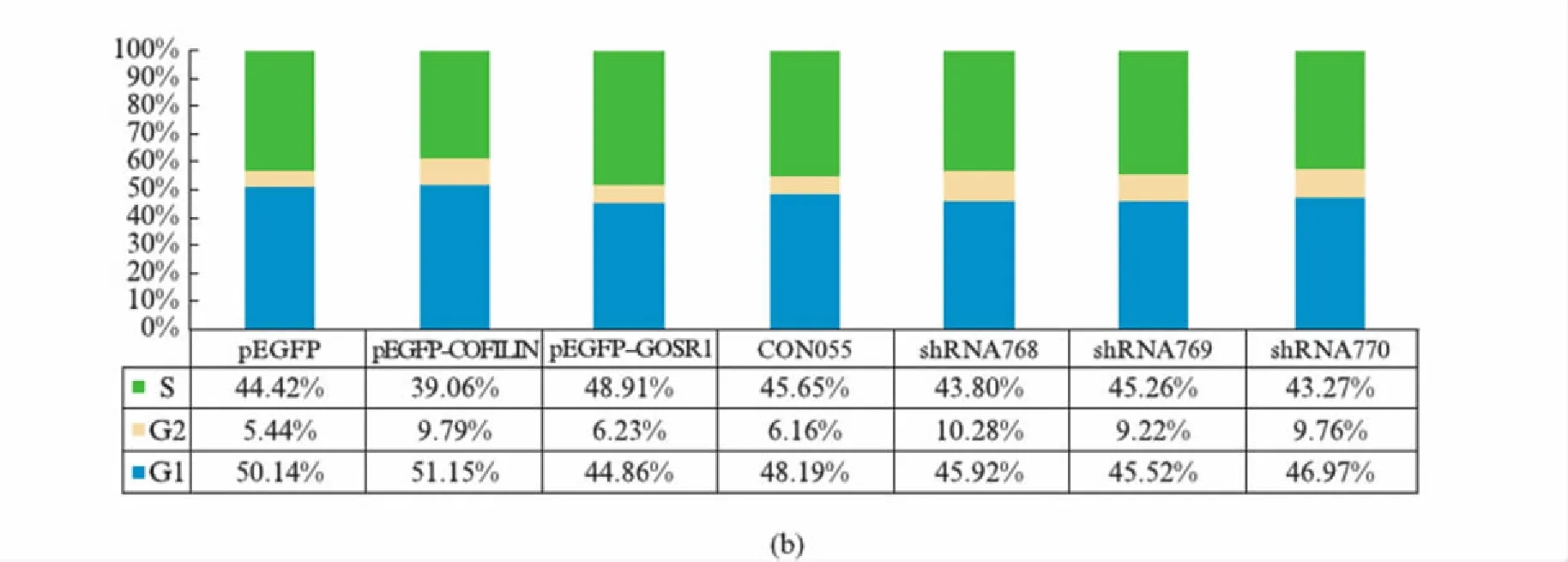
图9 细胞周期的流式细胞仪检测结果Fig.9 Cell cycle results detected by flow cytometry(a) 实验组1,分别转染pEGFP空载体、pEGFP-COFILIN、pEGFP-GOSR1的HEK293T细胞24h后流式细胞检测细胞周期的分析图表.实验组2,分别转染CON55、shRNA768、shRNA769、shRNA770细胞24h后流式细胞检测细胞周期的分析图表.结果用ModFit LT V3.311(Mac)进行分析.(b) 细胞周期百分比图.
在实验组1中,过表达GFP-COFILIN融合蛋白的细胞G2期较阴性对照(转染pEGFP空载体)相比有所增多,但过表达GFP-GOSR1的细胞G2期细胞与阴性对照无明显差别;在实验组2中,RNA干扰内源GOSR1后的细胞与阴性对照(转染CON055)相比,G2期细胞也有所增多.提示过表达的烟曲霉COFILIN蛋白可通过与GOSR1相互作用并降低GOSR1蛋白的表达而导致细胞发生G2期阻滞.
2.8 COFILIN与GOSR1的相互作用影响细胞凋亡
经过前面的实验发现,烟曲霉COFILIN在HEK293T细胞中过表达会在一定程度上抑制细胞增殖并导致细胞G2期阻滞.那么它是否会引起细胞凋亡?我们用BD ANNEXIN-FITC/PI凋亡检测试剂盒检测了细胞的凋亡情况.结果如图10(看第162页)所示,在实验组1中,细胞凋亡率(早期凋亡和晚期凋亡)分别为25.49%、37.10%和22.61%,其中转染pEF-Flag-COFILIN的细胞早期凋亡和晚期凋亡均比空载体上升,而转染pEF-Flag-GOSR1则有所下降.在实验组2中,细胞凋亡率为26.01%、34.71%、42.74%和51.46%,转染shRNA的细胞早期凋亡和晚期凋亡均高于对照组.表明烟曲霉COFILIN过表达会促进细胞凋亡,而内源的GOSR1的表达减少也会加速细胞的凋亡.提示细胞内源GOSR1对于H2O2毒性而导致的细胞凋亡具有一定的保护作用,烟曲霉COFILIN可通过与内源GOSR1蛋白的相互作用抑制其功能促进细胞凋亡.
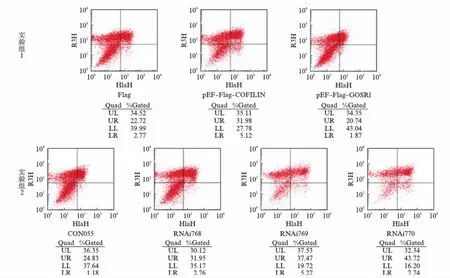
图10 细胞凋亡的流式细胞仪检测结果Fig.10 Cell apoptosis results detected by flow cytometry实验组1: 分别转染pEF-Flag、pEF-Flag-COFILIN、pEF-Flag-GOSR1到HEK293T细胞;实验组2: 分别转染CON055、shRNA768、shRNA769、shRNA770到HEK293T细胞.
3 讨 论
本文首次以烟曲霉COFILIN基因为诱饵从人巨噬细胞膜蛋白酵母双杂交文库中筛选发现了一批新的相互作用蛋白,并重点对COFILIN与GOSR1之间的蛋白相互作用及其细胞生物学效应进行了探索研究.
GOSR1属于SNARE(soluble N-ethylmaleimide-sensitive factor attachment protein receptor)大家族,即可溶性N-乙基马来酰亚胺敏感因子连接复合体[15].它在高尔基体内部囊泡的运输及高尔基体与内质网之间囊泡的运输中发挥着重要的作用[16].GOSR1的主要功能是参与内质网到高尔基体运输的对接和融合,它在高尔基体超低密度脂蛋白运输囊泡的融合中具有重要的功能[17],但它的其他细胞生物学功能还没有被清楚地报道过.
在真核生物中,细胞器与细胞器之间,细胞与细胞间的物质与信息交流是细胞生命活动的基本保证,而囊泡的运输是细胞器之间和细胞之间物质交流和信息传递的主要方式[18].大多数的囊泡融合过程由SNARE介导,因此不同物种间的SNARE具有高度的保守性.SNARE蛋白家族成员组成的膜融合系统调控着细胞内和细胞间的主要运输[19-21].
致病力蛋白是致病真菌入侵机体的关键因素,也是其逃逸宿主免疫系统防御的主要手段.烟曲霉侵入宿主黏膜上皮细胞、血管内皮细胞等,是其躲避宿主免疫攻击、穿越组织屏障的重要机制.其间发生细胞肌动蛋白骨架重排,而COFILIN是此过程的重要调控核心,因此也被认为是其主要的致病力蛋白之一,但目前人们对其过程了解仍非常有限[22-24].
我们通过在细胞内过表达烟曲霉COFILIN,发现其会导致内源性的GOSR1表达量下调,荧光定量PCR实验的结果也显示COFILIN抑制了GOSR1 mRNA的转录,提示COFILIN与GOSR1在体内的相互作用降低了内源GOSR1的表达量.进一步研究发现当烟曲霉的COFILIN进入宿主细胞表达后,细胞的增殖会受到抑制并发生G2期阻滞,同时促进在H2O2诱导下的细胞凋亡.这与采用RNA干扰将GOSR1的蛋白表达水平敲低出现的结果相同.反之,若通过转染外源GOSR1过表达增加其蛋白水平,就能使细胞增殖速度加快并抑制H2O2诱导的细胞凋亡,且G2期细胞与空载体阴性对照没有明显差异.这表明烟曲霉COFILIN与宿主内源GOSR1蛋白的相互作用对细胞增殖和细胞凋亡等生理过程的调控有重要影响.
参考文献:
[1] SUGUI J A, KWON-CHUNG K J, JUVVADI P R, et al.Aspergillusfumigatusand related species [J].ColdSpringHarborPerspectivesinMedicine, 2014,5(2): a019786.
[2] HEINEKAMP T, SCHMIDT H, LAPP K, et al. Interference ofAspergillusfumigatuswith the immune response [J].SeminarsinImmunopathology, 2015,37(2): 141-152.
[3] VALIANTE V, MACHELEIDT J, FOGE M, et al. TheAspergillusfumigatuscell wall integrity signaling pathway: Drug target, compensatory pathways, and virulence [J].FrontiersinMicrobiology, 2015,6: 325.
[4] SALES-CAMPOS H, TONANI L, CARDOSO C R, et al. The immune interplay between the host and the pathogen inAspergillusfumigatuslung infection [J].BioMedResearchInternational, 2013,2013(4): 693023-693023.
[5] NIERMAN W C, PAIN A, ANDERSON M J, et al. Genomic sequence of the pathogenic and allergenic filamentous fungusAspergillusfumigatus[J].Nature, 2005,438(7071): 1151-1156.
[6] BERNSTEIN B W, BAMBURG J R. ADF/cofilin: A functional node in cell biology [J]. Trends in Cell Biology, 2010,20(4): 187-195.
[7] VAN TROYS M, HUYCK L, LEYMAN S, et al. Ins and outs of ADF/cofilin activity and regulation [J].EuropeanJournalofCellBiology, 2008,87(8/9): 649-667.
[8] CORTEZ M, ATAYDE V, YOSHIDA N. Host cell invasion mediated byTrypanosomacruzisurface molecule gp82 is associated with F-actin disassembly and is inhibited by enteroinvasiveEscherichiacoli[J].MicrobesandInfection, 2006,8(6): 1502-1512.
[9] ZHENG K, XIANG Y, WANG X, et al. Epidermal growth factor receptor-PI3K signaling controls cofilin activity to facilitate herpes simplex virus 1 entry into neuronal cells [J].MBio, 2014,5(1): e00958-01013.
[10] REED S C, LAMASON R L, RISCA V I, et al. Rickettsia actin-based motility occurs in distinct phases mediated by different actin nucleators [J].CurrentBiology, 2014,24(1): 98-103.
[11] WASYLNKA J A, MOORE M M. Uptake ofAspergillusfumigatusconidia by phagocytic and nonphagocytic cellsinvitro: Quantitation using strains expressing green fluorescent protein [J].InfectionandImmunity, 2002,70(6): 3156-3163.
[12] JIA X, CHEN F, PAN W, et al. Gliotoxin promotesAspergillusfumigatusinternalization into type Ⅱ human pneumocyte A549 cells by inducing host phospholipase D activation [J].MicrobesandInfection, 2014,16(6): 491-501.
[13] HAN L, STOPE M B, de JESUS M L, et al. Direct stimulation of receptor-controlled phospholipase D1 by phospho-cofilin [J].TheEMBOJournal, 2007,26(19): 4189-4202.
[14] HAN X, YU R, JI L, et al. InlB-mediated Listeria monocytogenes internalization requires a balanced phospholipase D activity maintained through phospho-cofilin [J].MolecularMicrobiology, 2011,81(4): 860-880.
[15] TAI G, LU L, WANG T L, et al. Participation of the syntaxin 5/Ykt6/GS28/GS15 SNARE complex in transport from the early/recycling endosome to the trans-Golgi network [J].MolecularBiologyoftheCell, 2004,15(9): 4011-4022.
[16] DASTE F, GALLI T, TARESTE D. Structure and function of longin SNAREs [J].JournalofCellScience, 2015,128(23): 4263-4272.
[17] NAGAHAMA M, ORCI L, RAVAZZOLA M, et al. A v-SNARE implicated in intra-Golgi transport [J].TheJournalofCellBiology, 1996,133(3): 507-516.
[18] TRUCHET S, CHAT S, OLLIVIER-BOUSQUET M. Milk secretion: The role of SNARE proteins [J].JournalofMammaryglandBiologyandNeoplasia, 2014,19(1): 119-130.
[19] FANG Q, LINDAU M. How could SNARE proteins open a fusion pore? [J].Physiology(Bethesda,Md), 2014,29(4): 278-285.
[20] KIOUMOURTZOGLOU D, SADLER J B, BLACK H L, et al. Studies of the regulated assembly of SNARE complexes in adipocytes [J].BiochemicalSocietyTransactions, 2014,42(5): 1396-1400.
[21] MILOVANOVIC D, JAHN R. Organization and dynamics of SNARE proteins in the presynaptic membrane [J].FrontiersinPhysiology, 2015,6(89): 1-11.
[22] OHASHI K. Roles of cofilin in development and its mechanisms of regulation [J].Development,Growth&Differentiation, 2015,57(4): 275-290.
[23] RUST M B. ADF/cofilin: A crucial regulator of synapse physiology and behavior [J].CellularandMolecularLifeSciences, 2015,72(18): 3521-3529.
[24] LI X, GAO M, HAN X, et al. Disruption of the phospholipase D gene attenuates the virulence ofAspergillusfumigatus[J].InfectionandImmunity, 2012,80(1): 429-440.

