龋病感染牙髓相关基因的筛选与生物信息学分析
董宁,丁良,戴姗姗,郭青玉
陕西省颅颌面精准医学研究重点实验室,陕西省牙颌面疾病临床研究中心,西安交通大学 口腔医学院儿童口腔科,陕西 西安 710004
牙髓受到龋病等各种刺激会触发自身的防御和修复功能而呈现应答反应,随后通过各种细胞因子介导的一系列复杂的细胞、蛋白、细胞因子的级联反应,最终实现修复损伤、重建组织,其具体机制尚不清楚且难以进行外源性操控[1]。基因组筛选和芯片等高通量技术的不断发展丰富,为我们提供了一个获取龋病分子水平信息的研究利器。我们综合利用生物信息学工具,对正常和龋坏牙髓的相关基因表达谱数据进行分析,并对龋病相关差异表达基因进行初步筛选,为下一步研究提供线索。
1 材料和方法
1.1 材料
研究数据取自龋坏牙髓相关基因表达芯片(GSE1629),下载自美国国立生物技术信息中心(NCBI)基因表达数据库(Gene Expression Omni⁃bus,GEO),由 McLachlan等提交,实验平台是 Af⁃fymetrix公司的HG-U133A芯片。共4组样本,龋坏 牙 髓(GSM27725、GSM27726)和 正 常 牙 髓(GSM27727、GSM2778)各2组。样本取自12颗临床诊断健康及11颗临床诊断为深龋(牙本质深层未穿髓、无炎症)的因正畸原因拔除的前磨牙或磨牙,患者年龄 20~30 岁[2]。
1.2 差异基因分析及筛选
用在线分析工具MORPHEUS(https://software.broadinstitute.org/morpheus/)进行统计学分析。样本按龋坏和正常分为2组,进行比较,以P<0.05、差异表达倍数(foldchange)≥2作为差异基因的筛选条件。
1.3 差异基因的基因本体论(geneontology,GO)富集分析和通路分析
将筛选出的上调及下调差异基因列表导入DAVID数据库(https://david.ncifcrf.gov/),利用生物学注释进行相关的GO富集分析(生物学过程、分子功能、细胞组成)和KEGG通路分析[3-4]。设定P<0.05、FDR<0.05,进行筛选匹配。
1.4 差异基因编码蛋白的相互作用网络和节点分析
将差异基因导入STRINGv10.0(http://string.Db.org/)[5],分析其所编码的蛋白之间的相互作用,找出关键节点的蛋白质,综合分数(combined score)>0.4定为有效筛选标准。随后用Cytoscape软件构建蛋白质相互作用(protein-proteininterac⁃tion,PPI)网络,用其 MCODE(MolecularComplex Detection)插件深入筛检其中关联性强的蛋白互作模块,标准为分数大于4,节点数和互作数不少于10个。
2 结果
2.1 差异基因
共筛选出龋坏牙髓差异表达基因375个,其中表达上调253个,表达下调122个(图1A)。
2.2 差异基因的GO富集分析
结果见表1(按P值高低排名,部分展示)。筛选出的上调基因主要富集在生物学过程(bio⁃logicalprocess,BP)201个分类(免疫应答、炎症反应、细胞因子应答和细胞活化调控等)、分子功能(molecularfunction,MF)14个分类(抗原结合、受体结合、细胞因子活性和分子传感活性等)、细胞组分(cellcomponent,CC)26个分类(胞外间隙、主要组织相容性复合体、膜结合囊泡和溶酶体等);下调基因主要富集于6个BP分类(生物矿化组织发育、细胞突起形态发生、细胞组分形态发生、细胞突起组建、细胞黏附和生物附着)和2个CC分类(蛋白质细胞外基质和细胞外基质)。
2.3 KEGG通路分析
按设定条件筛选后,上调差异基因所涉及的KEGG通路分析有17条被保留,包括金黄色葡萄球菌感染、吞噬体、抗原加工提呈及NF-κB信号通路等(表2,部分展示)。下调基因未有有效涉及通路获得保留。
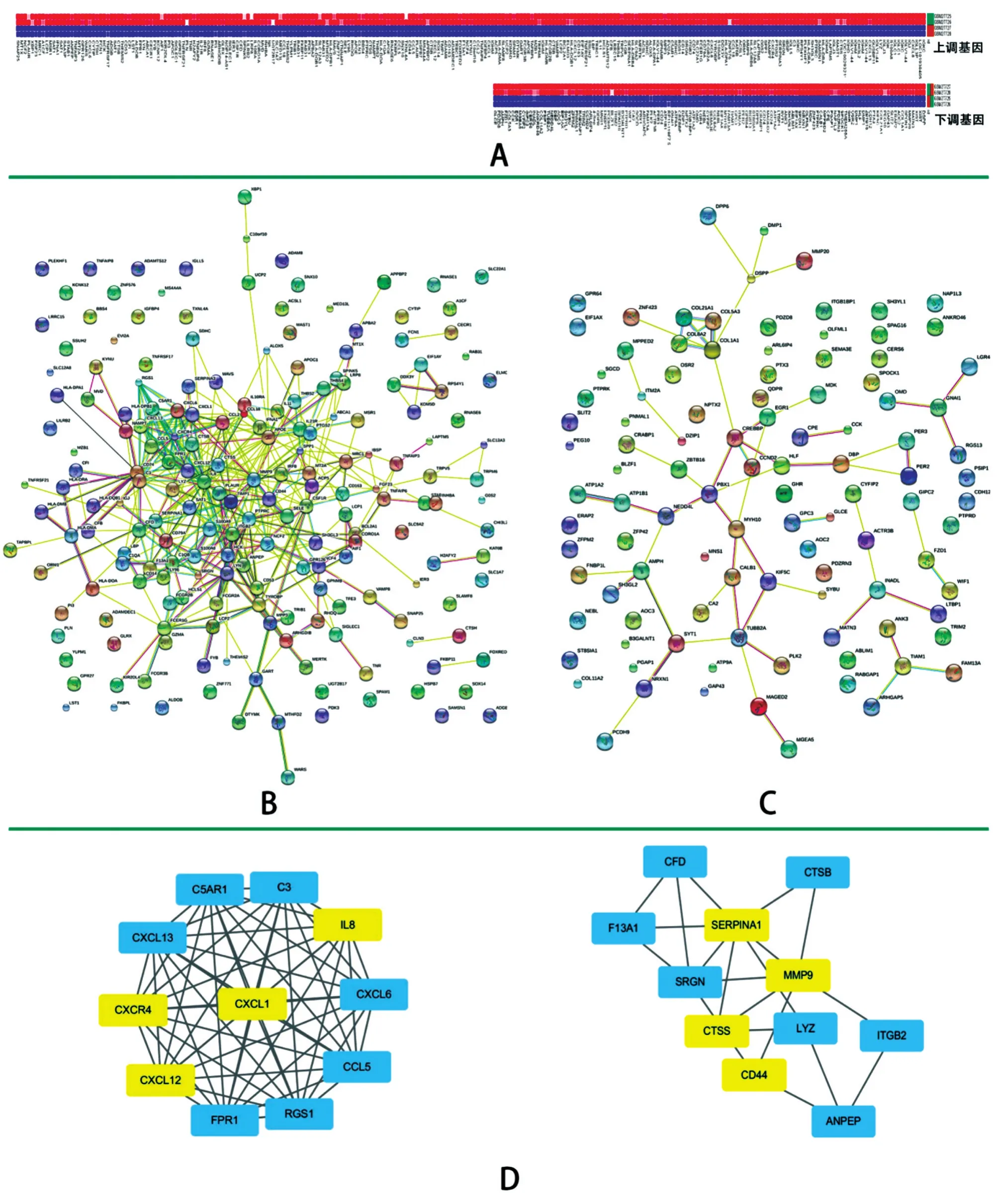
图1 差异表达基因分析
2.4 差异基因编码蛋白相互作用网络
STRING检测结果显示,上调基因PPI网络共涵盖195个节点蛋白和411个蛋白互作(图1B),下调基因PPI网络共涵盖105个节点蛋白和62个蛋白互作(图 1C)。其中 MMP9、CXCL12、IL-8、PTPRC、LYN、CXCR4、CD44、CXCL1、SERPINA1、CTSS蛋白的互作多于10条,被认为是中心节点基因且均为上调基因(表3)。MCODE分析得到2个高显著性蛋白互作模块,均处于上调差异基因互作网络中(图1D)。
3 讨论
牙髓牙本质复合体的内生性修复再生是机体防御龋病的重要手段,其机制亦是近年来的研究热点,其中涉及的分子和细胞相互作用非常复杂,若能控制炎症损伤与再生之间的平衡,将促进牙髓组织愈合[6]。本研究综合应用生物信息学工具,筛选得到牙髓组织中与龋病发生相关的差异基因,并通过构建PPI网络深入发掘出龋病相关性高的核心基因,富集分析结果显示这些基因可能加强了病理状态下组织的免疫应答和抗原抗体反应,同时活化了炎症相关细胞因子并调控机体的应激反应。同时由于组织受到破坏,部分生物矿化因子及细胞形态发生相关基因的表达亦受到抑制。

表1 龋齿牙髓GO富集分析结果

表2 龋坏牙髓中上调差异基因涉及的KEGG通路分析结果
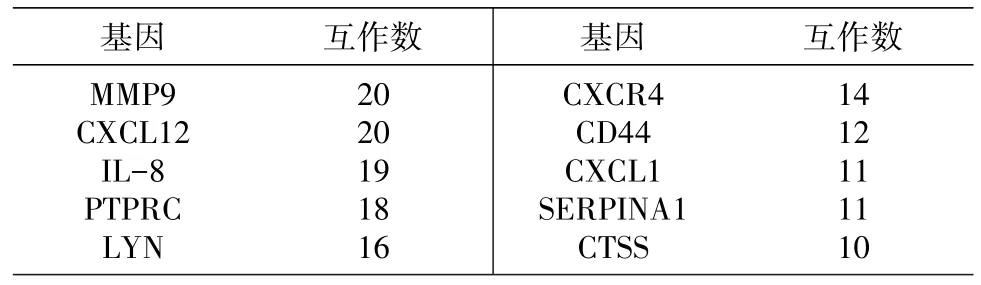
表3 差异基因的蛋白质相互作用网络中心节点基因
其中多数表达上调的细胞因子/趋化因子相关基因处于网络中心位置,说明在龋坏牙髓防御中占有重要地位。在筛选得到的中心蛋白中,基质 金 属蛋 白 酶 9(matrix metalloproteinase 9,MMP9)是基质金属蛋白酶家族(MMPs)中的一员,亦是基质重建的调控因子之一,参与了细胞外基质局部的蛋白水解和白细胞迁移,同时与破骨细胞吸收有关[7]。MMPs家族是已知重要的生物活性剂和生长因子,被证实参与了病理过程中细胞外基质的崩解,并在修复性牙本质形成过程中有调节牙本质分解产物的潜能[8]。CD44是透明质酸受体,介导细胞间和细胞与基质间的相互作用,同时与MMPs家族蛋白、骨桥蛋白和胶原蛋白的关系密切,在细胞迁移、淋巴细胞募集归巢和血细胞生成等活动中起重要作用[9]。CTSS(ca⁃thepsinS)是一种溶酶体半胱氨酸蛋白酶,在2型组织相容复合体分子(MHCⅡ)的递呈中,将抗原蛋白降解成多肽[10]。而牙髓树突状细胞可表达MHCⅡ分子,当牙本质遭到龋坏侵袭时,未成熟的抗原提呈树突状细胞会通过迁移来捕获外来抗原[11]。
IL-8(interleukin8,白细胞介素 8;或 C-X-C motifchemokineligand8,C-X-C基序趋化因子配体 8)、CXCL12、CXCL1、CXCR4(C-X-Cmotifche⁃mokinereceptor,C-X-C基序趋化因子受体4)同属趋化因子家族,广泛存在于血管、肝脏、神经系统、肌肉等多种组织和细胞中。不但参与正常组织的形成,也介导炎症的发生发展和损伤修复反应[12]。IL-8已成为衡量牙髓炎症的一个重要指标,研究证实人牙髓细胞(humandentalpulp cells,hDPCs)在炎症条件下会高表达 IL-8,牙髓干细胞受到脂多糖(lipopolysaccharides,LPS)刺激后会产生IL-8等大量促炎因子[13]。而趋化因子在清除感染的同时,也与生长因子协同作用促进组织的修复过程。MTA(mineraltrioxideaggre⁃gate,无机三氧化聚合物)盖髓实验发现,组织修复过程中细胞释放的IL-1α、-1β、-2、-6、-8明显增加[14]。CXCR4是目前所知的基质细胞衍生因子1(stromalcell-derivedfactor-1,SDF-1)的惟一受体,二者构成SDF-1/CXCR4轴,其介导成体干细胞定向迁移归巢和在血管新生和组织再生修复中的作用已受到广泛关注,并扩展到牙髓再生治疗的研究中[15]。而在大鼠牙本质-牙髓损伤修复模型中观察发现SDF-1α、CXCR4的表达呈现时间和程度相关性,提示二者可能参与诱导了修复性牙本质的形成[16]。
本实验分析结果的多样性也反映了龋病发生发展的复杂性,覆盖了多种生理病理反应,其牵涉基因、蛋白种类之多,也印证了龋病控制之困难。其在龋病病因和牙髓修复再生研究中的预测价值,除炎症因子等少部分基因已在历年研究中获得证实或得到部分验证,多数差异基因还须通过大量临床病例验证和体内外实验研究证实。此外,鉴于龋病的多样性和研究工具的不断发展,将来仍然需要涉及不同地区、人群,不同研究平台的大量的样本来不断充实和验证我们的结果。

