酱卤制品常用香辛料主效成分检测方法初步研究
艾有伟,侯温甫,张洁,王宏勋
(武汉轻工大学,武汉 430023)
酱卤肉制品是将鲜(冻)畜禽肉及可食副产品置于添加有食盐、酱油(或不加)、香辛料的水中[1],经预煮、烧煮、酱制(卤制)等工序加工而成[2],集肉香、酱香于一体的休闲食品[3]。风味独特,品种繁多,距今有多年历史[4],具有巨大市场潜力[5]。以酱卤鸭制品系列为代表的湖北肉鸭熟食产品,已成为湖北地方特色食品,深受国内外消费者喜爱。
香辛料是酱卤鸭制品加工过程中的重要原料,其含有的主效成分是形成酱卤鸭制品独特风味的重要成分基础。现阶段酱卤制品加工工艺中香辛料多采用直接添加的方法,但受限于香辛料的品种、产地、收获期、生产年份等差异,使得各香辛料中的主效成分存在一定的差异[6],而直接影响到不同批次产品间的风味稳定性,一定程度影响消费者对产品的感官体验。本文以酱卤制品常用香辛料为研究对象,建立各主效成分含量的测定方法。旨在建立香辛料主效成分标准化检测方法,为明晰不同批次、产地、品种中香辛料主效成分含量之间的差异提供理论依据。
1 材料与方法
1.1 材料与试剂
原料:辣椒、花椒、八角、桂皮、陈皮、白芷、砂姜、丁香、紫苏、黑胡椒、小茴香、肉豆蔻、当归、香叶、草果,购于武汉舵落口香料批发市场。
标准品:辣椒素标准品、二氢辣椒素标准品、β-山椒素标准品、莽草酸标准品、桂皮醛标准品、橙皮苷标准品、欧前胡素标准品、山奈酚标准品、丁香酚标准品、紫苏醛标准品、胡椒碱标准品、反式茴香脑、桉油精、阿魏酸(纯度95%),购于成都克洛玛生物公司。
试剂:甲醇(色谱纯)、乙腈(色谱纯)、磷酸(优级纯)、甲酸(色谱纯)、乙酸(色谱纯),国药集团化学试剂有限公司;95%食用酒精;正己烷(色谱纯),德国Meker公司。
1.2 仪器与设备
Aglilent 1260LC高效液相色谱仪 美国安捷伦科技公司;超纯水系统 Milli-Q Integral公司;SB-5200DTN超声波清洗机 宁波新芝生物科技股份有限公司;GZX-9140MBE数显鼓风干燥箱 上海博讯实业有限公司;RE-2000A旋转蒸发器 上海亚荣生化仪器厂; YB-1000A型高速多功能粉碎机 浙江省永康市速峰工贸有限公司;CP214电子天平 奥豪斯仪器(上海)有限公司;TGL-16G离心机 上海安亭科学仪器厂。
1.3 方法
1.3.1 各香辛料中主效成分及其主效成分高效液相色谱检测条件
15种香辛料中花椒、桂皮、陈皮、白芷、砂姜、紫苏、黑胡椒、小茴香、八角、当归10种香辛料对应主效成分分别为β-山椒素、桂皮醛、陈皮苷、欧前胡素、山奈酚、紫苏醛、胡椒碱、反式茴香脑、莽草酸、阿魏酸;辣椒中主效成分为辣椒素和二氢辣椒素;香叶、草果2种香辛料主效成分均为桉油精;丁香、肉豆蔻2种香辛料对应主效成分均为丁香酚,故15种香辛料对应主效成分共14种。
1.3.1.1 辣椒素和二氢辣椒素2种成分色谱检测条件[7]
色谱柱:Aglilent Extend-C18色谱柱(250 mm×4.6 mm,5 μm);柱温为30 ℃,检测波长为280 nm;采用A和B双泵系统,流速为1.0 mL/min,进样量为20 μL。流动相A为甲醇,流动相B为水(65∶35,V/V)。
1.3.1.2 桂皮醛色谱检测条件[8]
色谱柱:Aglilent Extend-C18色谱柱(250 mm×4.6 mm,5 μm);柱温为25 ℃,检测波长为290 nm;采用A和B双泵系统,流速为1.0 mL/min,进样量为20 μL。流动相A为乙腈,流动相B为水(32∶68,V/V)。
1.3.1.3 陈皮苷色谱检测条件[9]
色谱柱:Aglilent Extend-C18色谱柱(250 mm×4.6 mm,5 μm);柱温为30 ℃,检测波长为283 nm;采用A和B双泵系统,流速为1.0 mL/min,进样量为20 μL。流动相A为乙腈,流动相B为水(pH 3,23∶77,V/V)。
1.3.1.4 胡椒碱色谱检测条件[10]
色谱柱:Aglilent Extend-C18色谱柱(250 mm×4.6 mm,5 μm);柱温为30 ℃,检测波长为343 nm;采用A和B双泵系统,流速为1.0 mL/min,进样量为20 μL。流动相A为乙腈,流动相B为水(40∶60,V/V)。
1.3.1.5 丁香酚色谱检测条件[11]
色谱柱:Aglilent Extend-C18色谱柱(250 mm×4.6 mm,5 μm);柱温为30 ℃,检测波长为270 nm;采用A和B双泵系统,流速为1.0 mL/min,进样量为20 μL。流动相A为甲醇,流动相B为0.2%磷酸溶液(70∶30,V/V)。
1.3.1.6 β-山椒素色谱检测条件[12]
色谱柱:Aglilent Extend-C18色谱柱(250 mm×4.6 mm,5 μm);柱温为30 ℃,检测波长为254 nm;采用A和B双泵系统,流速为1.0 mL/min,进样量为20 μL。流动相A为乙腈,流动相B为0.1%甲酸水溶液(45∶55,V/V)。
1.3.1.7 山奈酚色谱检测条件[13]
1.3.1.8 欧前胡素色谱检测条件[14]
色谱柱:Aglilent Extend-C18色谱柱(250 mm×4.6 mm,5 μm);柱温为30 ℃,检测波长为247 nm;采用A和B双泵系统,流速为1.0 mL/min,进样量为20 μL。流动相A为乙腈,流动相B为水(65∶35,V/V)。
1.3.1.9 紫苏醛色谱检测条件[15]
色谱柱:Aglilent Extend-C18色谱柱(250 mm×4.6 mm,5 μm);柱温为30 ℃,检测波长为230 nm;采用A和B双泵系统,流速为1.0 mL/min,进样量为20 μL。流动相A为乙腈,流动相B为水(75∶25,V/V)。
1.3.1.10 反式茴香脑色谱检测条件[16]
色谱柱:Aglilent Extend-C18色谱柱(250 mm×4.6 mm,5 μm);柱温为30 ℃,检测波长为254 nm;采用A和B双泵系统,流速为1.0 mL/min,进样量为20 μL。流动相A为甲醇,流动相B为水(80∶20,V/V)。
1.3.1.11 莽草酸色谱检测条件[17]
色谱柱:Aglilent Extend-C18色谱柱(250 mm×4.6 mm,5 μm);柱温为30 ℃,检测波长为210 nm;采用A和B双泵系统,流速为1.0 mL/min,进样量为20 μL。流动相A为乙腈,流动相B为0.5%磷酸水溶液(体积比95∶5,V/V)。
橡胶圈外观质量应符合以下要求:颜色均匀,表面不应有游离硫;材质致密,无肉眼可见的杂质、气孔、裂缝及其他有碍使用的缺陷;单个橡胶圈上凹凸不超过1 mm,面积不超过6 mm2,且不多于3处;飞边须除净,其厚度不应超过0.4 mm,剪损宽度应不超过0.8 mm;无平面扭曲现象,带接头的橡胶圈,接头处应平顺无分离迹象,接头处错位不应超过0.5 mm;每个橡胶圈只容许有1个接头。
1.3.1.12 桉油精色谱检测条件[18]
色谱柱:Aglilent Extend-C18色谱柱(250 mm×4.6 mm,5 μm);柱温为40 ℃,检测波长为203 nm;采用A和B双泵系统,流速为1.0 mL/min,进样量为20 μL。流动相A为乙腈,流动相B为水(70∶30,V/V)。
1.3.1.13 阿魏酸色谱检测条件[19]
色谱柱Aglilent Extend-C18色谱柱(250 mm×4.6 mm,5 μm);柱温为40 ℃,检测波长为323 nm;采用A和B双泵系统,流速为1.0 mL/min,进样量为20 μL。流动相A为乙腈,流动相B为乙酸溶液(pH 3,15∶85,V/V)。
1.3.2 香辛料提取液制备
将15种香辛料样品分别于65 ℃干燥4 h,经粉碎过60目筛。精确称取香辛料样品各5.00 g,加入60%食用酒精100 mL,于60 ℃下超声提取2 h。静置10 min后过滤浓缩定容至50 mL,经0.45 μm有机滤膜过滤后进行色谱分析。
1.3.3 香辛料主效成分标准品溶液制备方法
分别精确称取1.3.1中14种香辛料主效成分标准品用其相对应流动相超声溶解后配制成14种标准品溶液,经0.45 μm有机滤膜过滤后进行色谱分析。
1.3.4 传统卤水检测前处理方法
取100 g传统卤水样品加热融化并除去表面油脂,逐个分装至2.5 mL离心管中于12000 r/min转速下离心5 min去除卤水中的残渣并取上清液,经0.45 μm滤膜过滤后进行色谱分析。
2 结果与分析
2.1 14种主效成分标准品检测结果
精密吸取辣椒素标准品、二氢辣椒素标准品、β-山椒素标准品、桂皮醛标准品、橙皮苷标准品、欧前胡素标准品、山奈酚标准品、丁香酚标准品、紫苏醛标准品、胡椒碱标准品、反式茴香脑标准品、莽草酸标准品、桉油精标准品、阿魏酸标准品14种香辛料主效成分的标准品溶液,每种标准品溶液进样20 μL,按1.3.1的色谱条件测定,得到标准品高效液相测定色谱图,见图1。



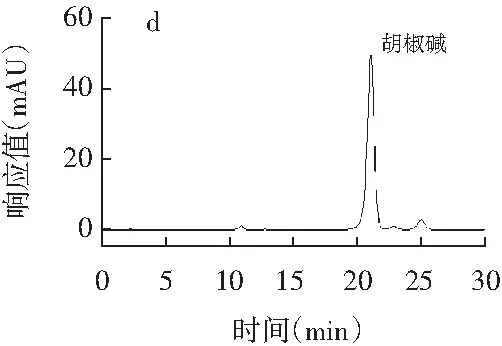
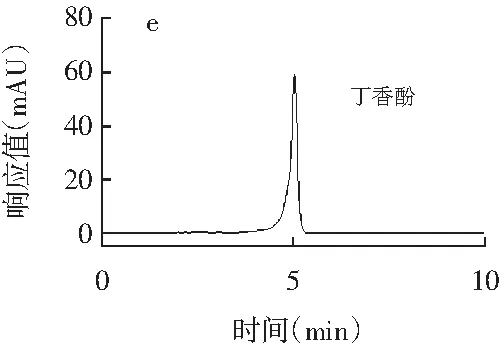

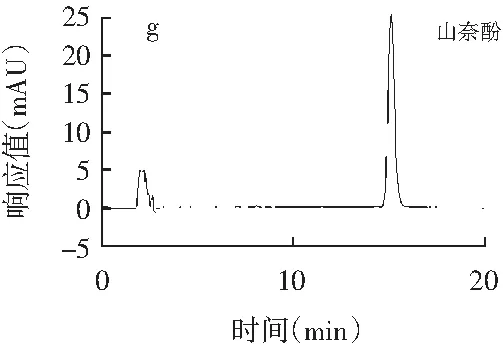
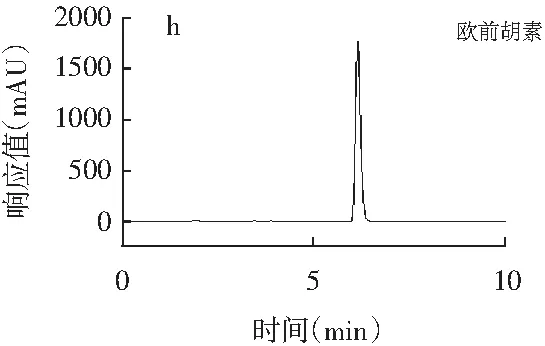





图1 14种主效成分标准品高效液相色谱图Fig.1 HPLC chromatograms of 14 main effective components
注:各图分别为辣椒素与二氢辣椒素(a)、桂皮醛(b)、橙皮苷(c)、胡椒碱(d)、丁香酚(e)、β-山椒素(f)、山奈酚(g)、欧前胡素(h)、反式茴香脑(i)、莽草酸(j)、桉油精(k)、阿魏酸(l)、紫苏醛(m)。
由图1可知,各香辛料主效成分辣椒素、二氢辣椒素、桂皮醛、橙皮苷、胡椒碱、丁香酚、β-山椒素、山奈酚、欧前胡素、反式茴香脑、莽草酸、桉油精、阿魏酸、紫苏醛标准品的保留时间分别为12.875,19.597,16.327,6.038,21.092,5.036,10.086,15.134,6.141,7.542,3.425,5.132,4.823,7.560 min,且各标准品色谱峰峰形较好。
2.2 15种香辛料提取液中主效成分检测方法研究
分别精密吸取15种香辛料提取液各20 μL,按1.3.1的色谱条件测定,经测定除八角提取液中莽草酸、香叶和草果提取液中桉油精、当归提取液中阿魏酸这4种香辛料提取液中3种主效成分,由于提取液中其他成分干扰分离效果较差外,其余11种香辛料提取液中的11种有效成分目标峰与其他组分峰能够良好地分离,其主效成分色谱图见图2。





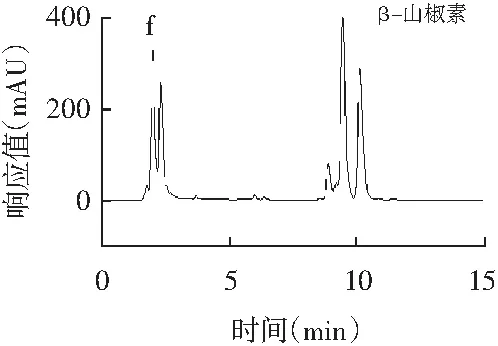





图2 11种香辛料提取液高效液相色谱色谱图Fig.2 HPLC chromatograms of 11 spices extracting solution
注:各图分别为辣椒提取液(a)、桂皮提取液(b)、陈皮提取液(c)、胡椒提取液(d)、丁香提取液(e)、花椒提取液(f)、砂姜提取液(g)、白芷提取液(h)、小茴香提取液(i)、紫苏提取液(j)、肉豆蔻提取液(k)。
由图2可知,11种香辛料提取液中的11种主效成分的保留时间分别为:(1)辣椒提取液中辣椒素和二氢辣椒素的保留时间分别是12.679,19.330 min;(2)桂皮提取液中桂皮醛的保留时间是16.338 min;(3)黑胡椒提取液中胡椒碱的保留时间是20.946 min;(4)陈皮提取液中橙皮苷的保留时间是6.045 min;(5)丁香提取液中丁香酚的保留时间是5.008 min;(6)花椒提取液中β-山椒素的保留时间是10.156 min;(7)砂姜提取液中山奈酚的保留时间是15.156 min;(8)白芷提取液中欧前胡素的保留时间是6.158 min;(9)紫苏提取液中紫苏醛的保留时间是7.522 min;(10)小茴香提取液中反式茴香脑的保留时间是7.510 min;(11)肉豆蔻提取液中丁香酚的保留时间是5.034 min。上述主效成分保留时间均与图1对应标准品保留时间一致,且分离效果良好。
2.3 标准曲线绘制及香辛料提取液中主效成分含量检测
2.3.1 标准曲线的绘制
依据辣椒、花椒、桂皮、陈皮、白芷、砂姜、丁香、紫苏、黑胡椒、小茴香、肉豆蔻11种香辛料中主效成分检测方法,精确吸取辣椒素、二氢辣椒素、β-山椒素、桂皮醛、橙皮苷、欧前胡素、山奈酚、丁香酚、紫苏醛、胡椒碱和反式茴香脑不同浓度梯度的标准品溶液,分别进样20 μL。按照1.3.1的液相条件进行检测,以标准品浓度作为横坐标,峰面积作为纵坐标,分别得到辣椒素、二氢辣椒素、β-山椒素、桂皮醛、橙皮苷、欧前胡素、山奈酚、丁香酚、紫苏醛、胡椒碱和反式茴香脑11种香辛料主效物质的标准曲线、回归方程、相关系数、浓度范围,见表1。
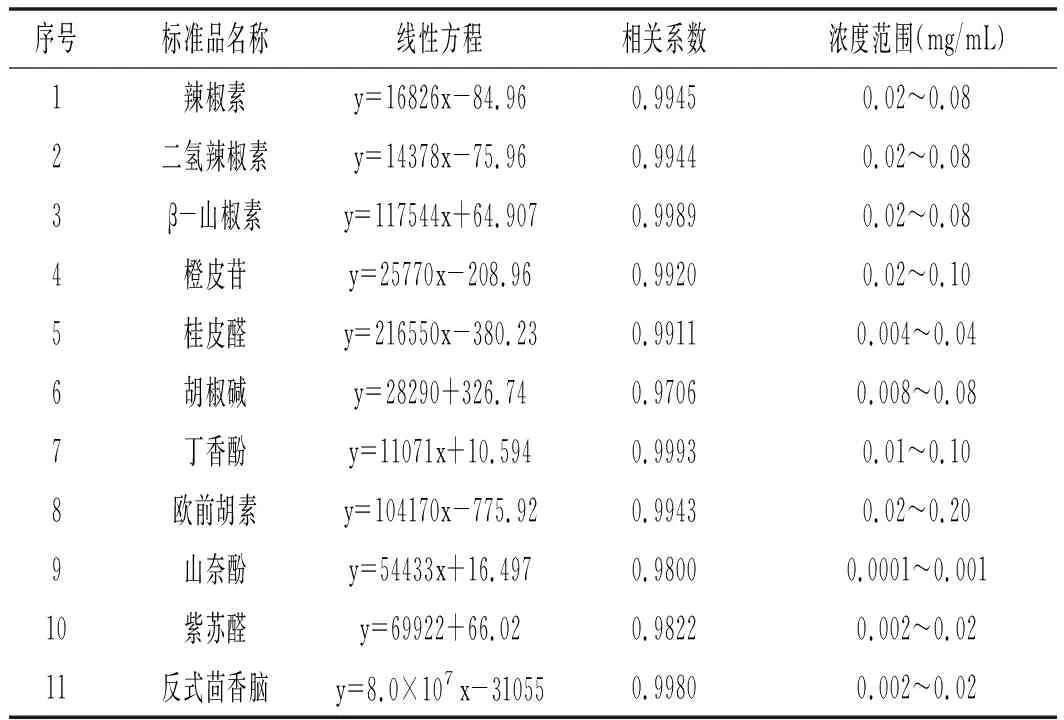
表1 11种常见香辛料中主效成分的线性方程、相关系数及检测浓度范围Table 1 Linear equations,correlation coefficients and concentration ranges of main effective components in 11 common spices
2.3.2 香辛料提取液中主效成分含量测定
取同一批次的香辛料干粉,按照1.3.2中样品溶液的提取方法进行制备,过0.45 μm有机滤膜进行色谱分析重复进样3次,做3个平行。取峰面积代入曲线方程,得到每种香辛料提取液的主效成分含量,见表2。
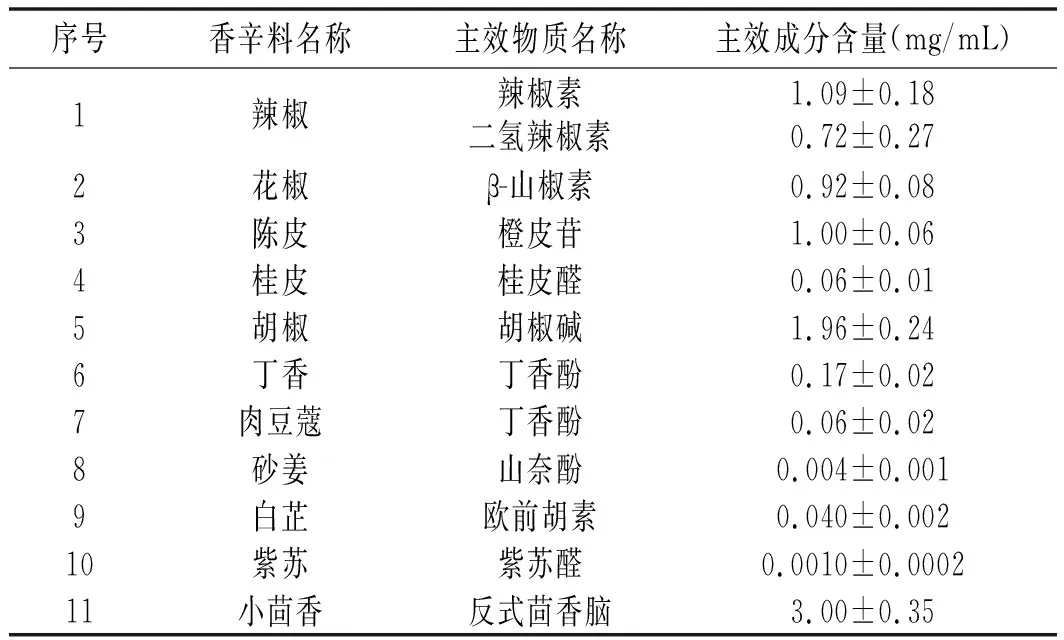
表2 11种常见香辛料提取液中主效成分含量Table 2 The main effective components in 11 common spices extracting solution
2.4 传统卤水中香辛料主效成分检测结果
按照1.3.4方法处理传统卤水,采用1.3.1中方法对传统卤水中香辛料主效成分进行色谱分析。经测定得到辣椒素、胡椒碱、β-山椒素、橙皮苷4种主效成分的含量分别为0.060,0.056,0.072,0.037 mg/mL。
3 结论
采用高效液相色谱法建立了14种香辛料主效成分标准品的测定方法,经测定,辣椒素、二氢辣椒素、桂皮醛、胡椒碱、橙皮苷、山奈酚、欧前胡素、丁香酚、β-山椒素、紫苏醛、反式茴香脑11种香辛料提取液主效成分在高效液相条件下分离效果较好。最终确定11种常见香辛料提取液中主效成分含量及传统卤水中4种香辛料主效成分含量。本文通过11种常见香辛料提取液中主效成分测定方法的建立,为香辛料及酱卤制品中香辛料主效成分标准化方法检测提供了技术支撑。
参考文献:
[1]陈旭华.酱卤肉制品定量卤制工艺研究[D].北京:中国农业科学研究院,2014.
[2]夏文水.食品工艺学[M].北京:中国轻工业出版社,2008:322.
[3]孔保华.肉制品工艺学[M].哈尔滨:黑龙江科学技术出版社,1996:23-26.
[4]马玉山.酱卤制品的调香技术[J].肉制品加工与设备,2007,312(4):10-12.
[5]张赟彬,沈栋立,毛彦佳,等.肉桂精油抑菌性及其在酱卤牛肉保鲜中的应用[J].中国食品添加剂,2016(5):111-115.
[6]周光宏.肉品加工学[M].北京:中国农业出版社,2008.
[7]GB/T 21266-2007,辣椒及辣椒制品中辣椒素类物质测定及辣度表示方法[S].
[8]Hussein M M,D′Amelia R P,Manz A L,et al.Determination of reactivity of aspartame with flavor aldehydes by gas chromatography,HPLC and GPC[J].Journal of Food Science,2006,49(2):520-524.
[9]Saeidi I,Hadjmohammadi M R,Peyrovi M,et al.HPLC determination of hesperidin,diosmin and eriocitrin in Iranian lime juice using polyamide as an adsorbent for solid phase extraction[J].Journal of Pharmaceutical & Biomedical Analysis,2011,56(2):419-422.
[10]Chiang G H.HPLC analysis of capsaicins and simultaneous determination of capsaicins and piperine by HPLC-ECD and UV[J].Journal of Food Science,2006,51(2):499-503.
[11]Dhoot G,Auras R,Rubino M,et al.Determination of eugenol diffusion through LLDPE using FTIR-ATR flow cell and HPLC techniques[J].Polymer,2009,50(6):1470-1482.
[12]王进,李欣,杨龙佳,等.高效液相色谱法测定贵州顶坛花椒中麻味成分羟基-β-山椒素的含量[J].中国调味品,2015,40(10):102-105.
[13]Olszewska M.Separation of quercetin,sexangularetin,kaempferol and isorhamnetin for simultaneous HPLC determination of flavonoid aglycones in inflorescences,leaves and fruits of threeSorbusspecies[J].Journal of Pharmaceutical & Biomedical Analysis,2008,48(3):629.
[14]胡华杰,楼招欢,吕圭源,等.HPLC 测定不同产地白芷饮片中欧前胡素和异欧前胡素的含量[J].浙江中医药大学学报,2010,34(3):418-420.
[15]Hoffmann-Benning S,Gage D A,Mcintosh L,et al.Comparison of peptides in the phloem sap of flowering and non-floweringPerillaand lupine plants using microbore HPLC followed by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry[J].Planta,2002,216(1):140-147.
[16]谢滟,邓家刚,黄丽贞,等.高效液相色谱法测定广西不同产地八角茴香中反式茴香脑的含量[J].广西中医药大学学报,2014,17(4):67-68.
[17]Wang X Q,Guo Y J,Yang C S.Determination of shikimic acid in fruit of illiciaceae plants by HPLC with diode-array detection[J].China Journal of Chinese Materia Medica,2001,26(7):447.
[18]Wallis I R,Foley W J.The rapid determination of sideroxylonals inEucalyptusfoliageby extraction with sonication followed by HPLC[J].Phytochemical Analysis,2005,16(1):49.
[19]Zupfer J M,Churchill K E,Rasmusson D C,et al.Variation in ferulic acid concentration among diverse barley cultivars measured by HPLC and microspectrophotometry[J].Journal of Agricultural & Food Chemistry,1998,46(4):1350-1354.

