Box-Behnken设计-效应面法优化甘草黄酮纳米混悬处方
吴超群,李小芳,牟倩倩,严敏嘉,赵甜甜,马祖兵
甘草黄酮是从甘草根及根茎中提取的一类具较强生理活性的脂溶性物质,具有显著的抗炎、抗溃疡等药理作用,但甘草黄酮的水溶性差,严重制约了其的应用及发展[1-2]。纳米混悬剂(nanosuspensions NS)是 20 世纪末发展起来的一种新型纳米给药系统,其主要是以少量表面活性剂为稳定剂的“纯药物”粒子构成一种亚微米胶体分散体系[3-4]。其适用范围广,无论是难溶于水的药物还是既难溶于水又难溶于油的药物均适用。纳米混悬剂因处方简单、制备快速、载药量高、且具有靶向性等优势成为增溶技术的研究热点之一。本试验采用沉淀法-高压均质法制备甘草黄酮纳米混悬剂,并采用Box-Behnken设计-效应面法对处方进行优化,以期得到工艺稳定、处方简单、预测性及重现性良好的甘草黄酮纳米混悬剂。
1 仪器与材料
1.1 仪器
Nicomp 380ZLS 型激光粒度分析仪 ( 美国 PSS公司 ) ;AH-100D 型高压均质机 ( 加拿大 ATS 公司 )
1.2 材料
甘草黄酮原料药(西安小草植物科技有限责任公司,批号XC20160508,含有量为70.0%); 十二烷基磺酸钠(SDS)、聚维酮K30(PVPK30)、泊洛沙姆188(P188)、聚乙二醇400(PEG400)、吐温-80(成都市科龙化工试剂厂)。
2 方法与结果
2.1 甘草黄酮纳米混悬剂的制备
采用沉淀法-高压均质法制备。称取甘草黄酮加入适量的无水乙醇,超声使其完全溶解;匀速加入到含有稳定剂的纯水溶液中,匀速搅拌15 min,旋转蒸发挥去乙醇,即得粗混悬液,采用高压均质机在一定的压力下均质数次,即得甘草黄酮纳米混悬剂。采用Nicomp 380ZLS 型激光粒度分析仪测定粒径及PDI值。
2.2.1 稳定剂的筛选 根据参考文献及预实验[5-6],按“2.1”项下的方法制备甘草黄酮纳米混悬剂,以平均粒径、多分散指数(PDI)以及2 h后的稳定性情况为评价指标,考察了十二烷基磺酸钠(SDS)、聚维酮K30(PVPK30)、泊洛沙姆188(P188)、聚乙二醇400(PEG400)、吐温-80等不同稳定剂对甘草黄酮纳米混悬剂的影响。见表1可知,PVPK30与PEG-400联合作为稳定剂时,制得的纳米混悬剂粒径小,体系能保持较长时间的稳定。
表1 不同种类稳定剂对甘草黄酮纳米混悬剂平均粒径和PDI的影响(n=3,±s)
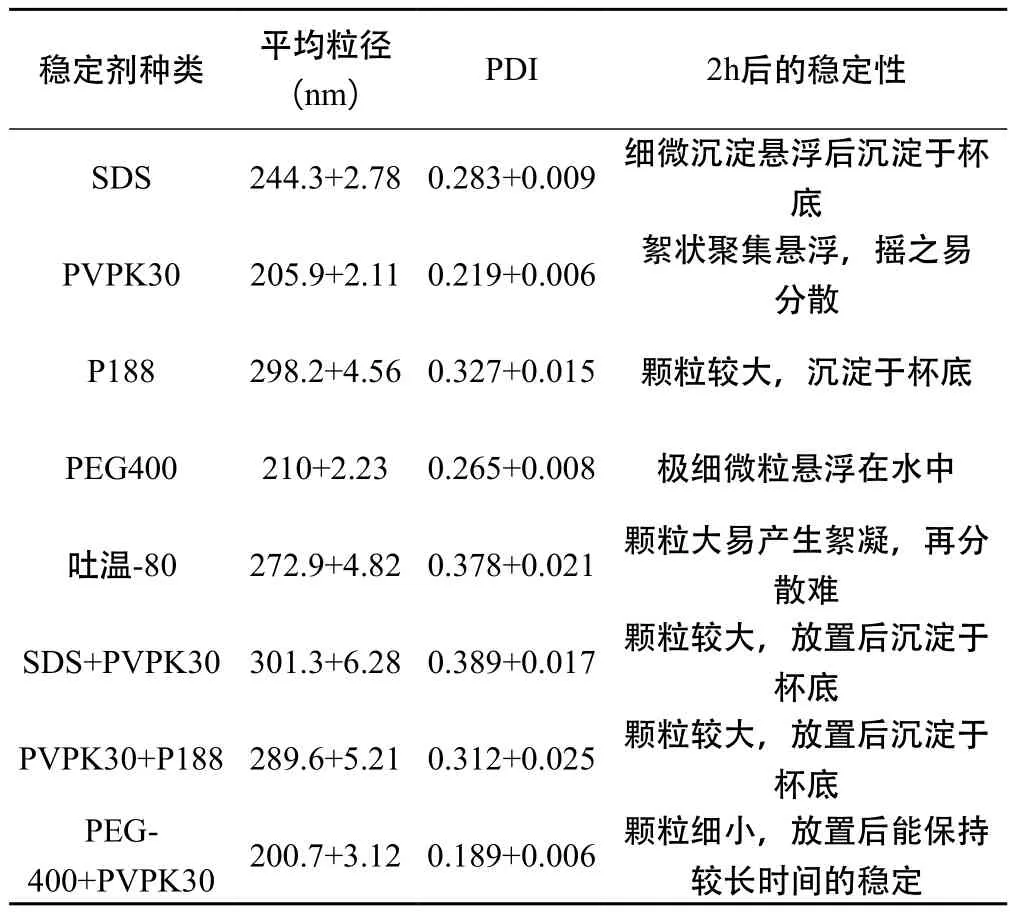
表1 不同种类稳定剂对甘草黄酮纳米混悬剂平均粒径和PDI的影响(n=3,±s)
稳定剂种类 平均粒径(nm) PDI 2h后的稳定性SDS 244.3+2.780.283+0.009 细微沉淀悬浮后沉淀于杯底PVPK30 205.9+2.110.219+0.006 絮状聚集悬浮,摇之易分散P188 298.2+4.560.327+0.015 颗粒较大,沉淀于杯底PEG400 210+2.23 0.265+0.008 极细微粒悬浮在水中吐温-80 272.9+4.820.378+0.021 颗粒大易产生絮凝,再分散难SDS+PVPK30301.3+6.280.389+0.017 颗粒较大,放置后沉淀于杯底PVPK30+P188289.6+5.210.312+0.025 颗粒较大,放置后沉淀于杯底PEG-400+PVPK30 200.7+3.120.189+0.006 颗粒细小,放置后能保持较长时间的稳定
2.3 单因素考察
2.3.1 乙醇用量考察 按“2.1”项下的方法制备甘草黄酮纳米混悬剂,以平均粒径及PDI为评价指标,考察无水乙醇与水的体积比为1:10、1:5、2:1对甘草黄酮纳米混悬剂粒径和PDI的影响。见表2可知,随着无水乙醇的用量增加,制得的甘草黄酮纳米混悬剂的粒径越小,但PDI随之增大。因有机溶剂具有一定毒性,故选取无水乙醇与水的体积比为1:10。
表2 无水乙醇用量对甘草黄酮纳米混悬剂的粒径和PDI的影响结果(n=3,±s)
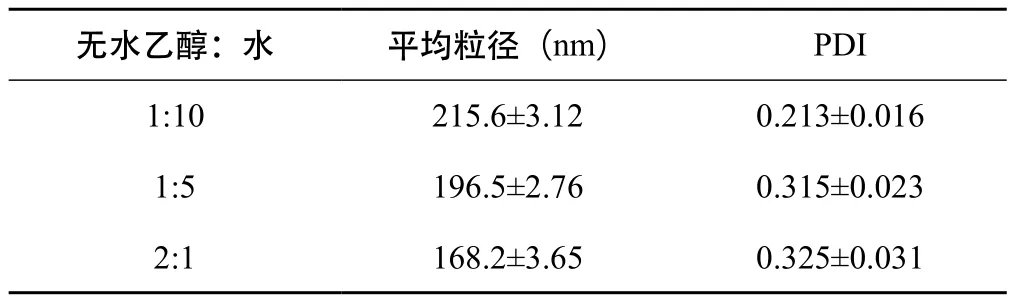
表2 无水乙醇用量对甘草黄酮纳米混悬剂的粒径和PDI的影响结果(n=3,±s)
无水乙醇:水 平均粒径(nm) PDI 1:10 215.6±3.12 0.213±0.0161:5 196.5±2.76 0.315±0.0232:1 168.2±3.65 0.325±0.031
2.3.2 磁力搅拌器转速考察 按“2.1”项下的方法制备甘草黄酮纳米混悬剂,以平均粒径及PDI为评价指标,考察了200、400、600、800、1000 r﹒min-1五种转速对甘草黄酮纳米混悬剂的影响。见图1可知,随着磁力搅拌器转速的增加,甘草黄酮纳米混悬剂的粒径及PDI随之减小,这是由于高转速能增加粒子间的碰撞机会以及强度,使得粒径减小,但当转速过高时,搅拌过程中可能会产生气泡,阻碍了粒子间的碰撞,导致粒子增大[7]。故最终选取转速为800 r﹒min-1。
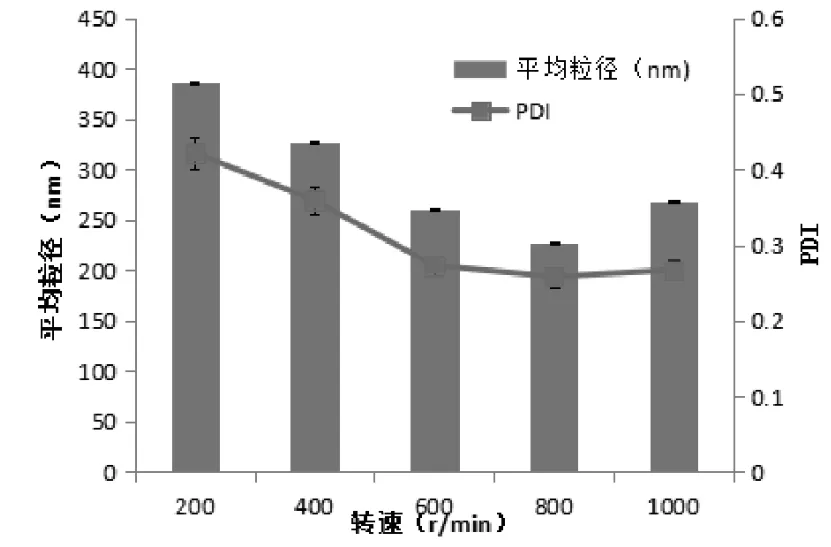
图1 磁力搅拌转速对粒径及PDI的影响
2.3.1 均质压力对粒径及PDI的影响 按2.1项下的方法制备甘草黄酮粗混悬液,将其置于50 MPa的压力下均质3次,再分别于40、60、80、100、120、150 MPa等不同压力下均质10次,测定平均粒径及PDI值。见图2可知:随着均质压力的升高,甘草黄酮纳米混悬剂的粒径及PDI值逐渐变小,当增加到一定压力后,又随之增大。故选择将粗混悬剂先在50 MPa下循环3次,再在120 MPa下循环10次。
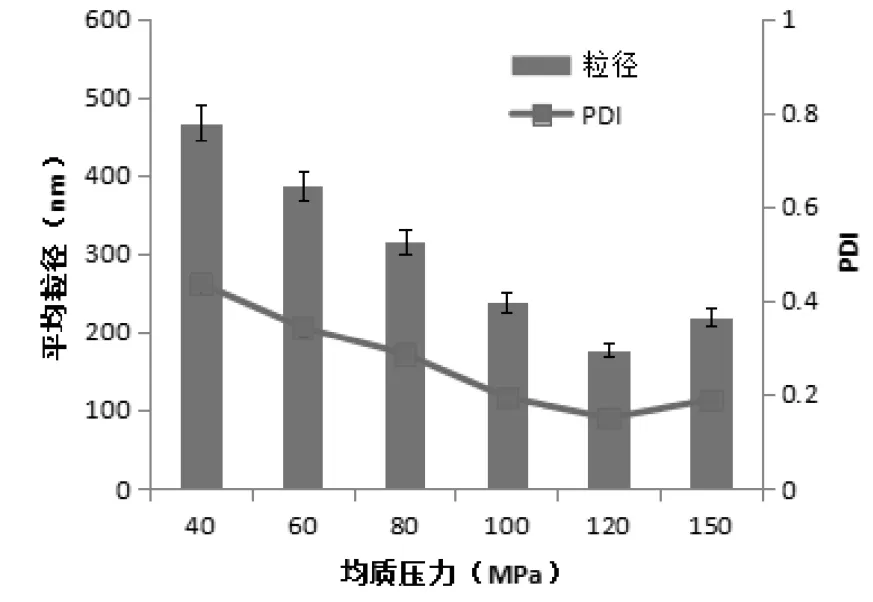
图2 不同均质压力对粒径及PDI的影响
2.3.2 均质次数对粒径及PDI的影响 按2.1项下的方法制备甘草黄酮粗混悬液,将其置于50 MPa的压力下均质3次,再置于120 MPa的压力下分别均质5、10、15、20和25次取样,测定平均粒径及PDI值,见图3可知:随着均质次数的增多,甘草黄酮纳米混悬剂的平均粒径及PDI逐渐降低,当均质次数达到15次后,甘草黄酮纳米混悬剂的平均粒径及PDI值的变化不大。故综合考虑,选择均质次数为15次。
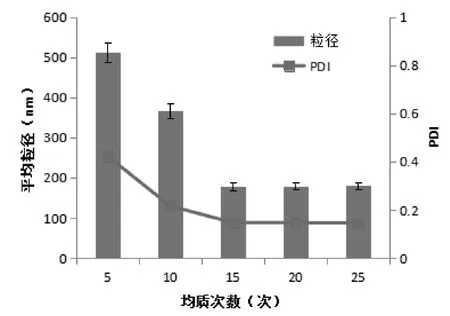
图3 均质次数对粒径及PDI的影响
2.4 甘草黄酮纳米混悬剂的处方优化
2.4.1 Box-Behnken设计-效应面法设计优化处方 根据前期预实验结果,选取甘草黄酮质量浓度(A)、PVP K30 浓度(B)、PEG-400浓度(C)为因素,以甘草黄酮纳米混悬剂的平均粒径(Y )为相应值,响应值越小越好。采用Box-Behnken设计-效应面法设计优化甘草黄酮纳米混悬剂的处方。实验因素水平见表3,试验安排与结果见表4。
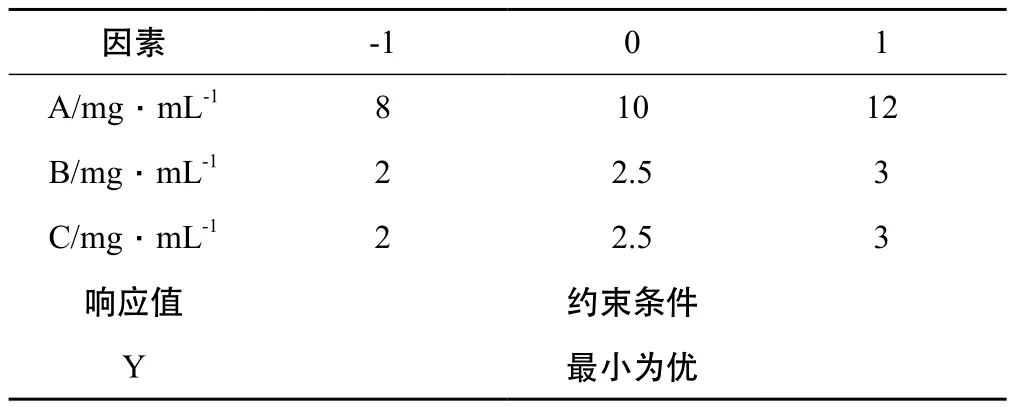
表3 实验因素水平表
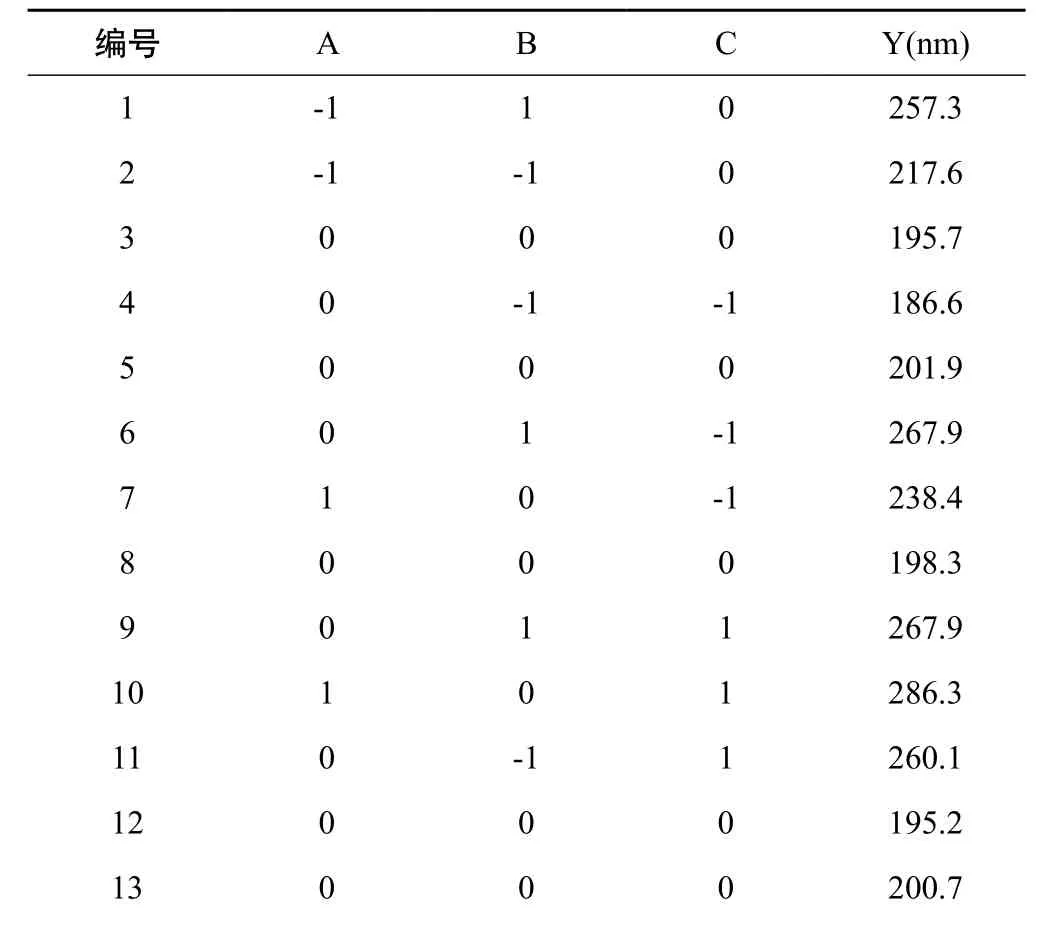
表4 Box-Behnken试验安排及结果
14 -1 0 1 245.215 1 -1 0 225.616 -1 0 -1 210.817 1 1 0 285.9
2.4.2 模型的拟合 应用 Design-Expert 8.0.6 软件分析对表4试验数据进行二次多元回归拟合,得到模型的二次多元回归方程: Y =+198.36+13.16* A+23.64*B+19.48* C+5.15* A * B+3.38* A * C-18.38* B *C+23.89* A2+24.34* B2+22.92* C2(P<0.0001)。拟合方程相关系数R2=0.9898,表明该模型拟合程度良好,失拟项不显著(P>0.05),表明该模型无失拟现象,可充分反映实际试验值。综上,该模型可对甘草纳米混悬剂的处方进行分析和预测。
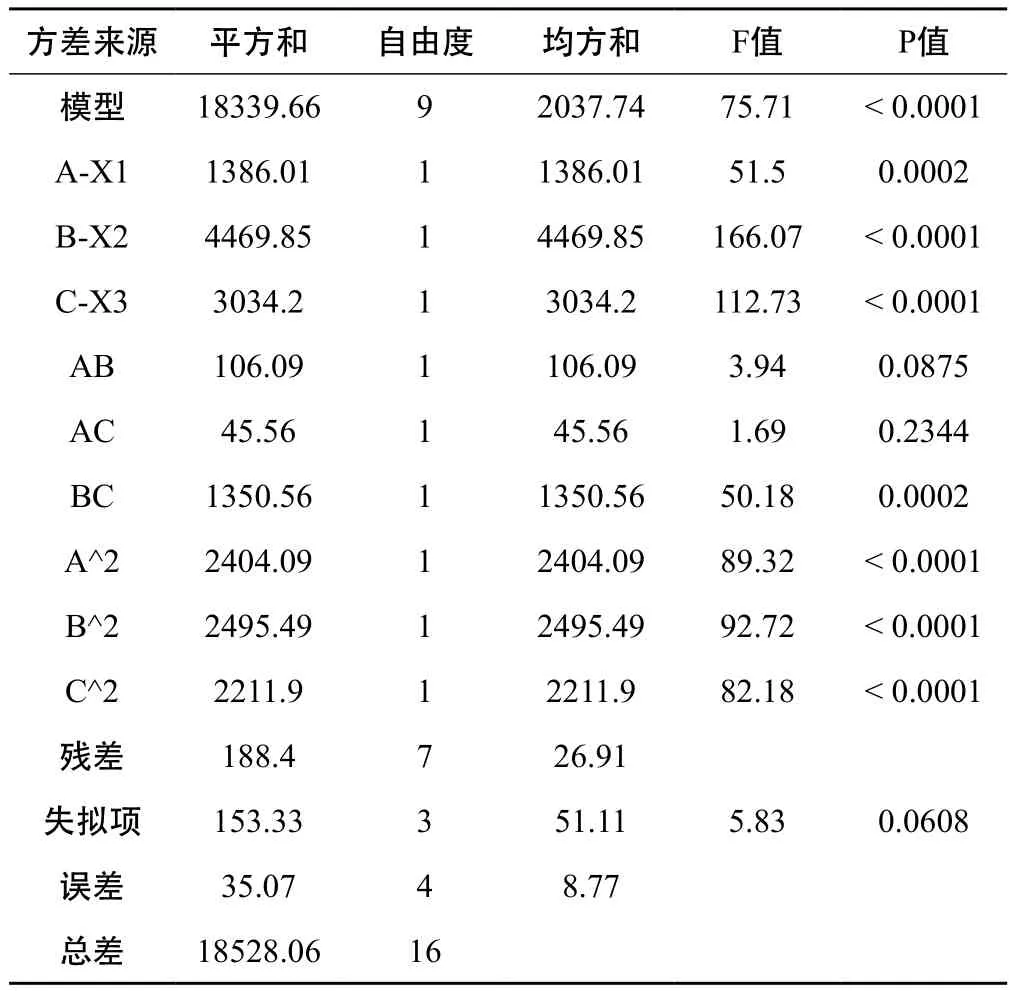
表5 方差分析结果
2.4.3 效应面优化与预测 根据回归方程应用 Design-Expert 8.0.6 软件绘制三维效应面图,见图4。可知,甘草黄酮纳米混悬剂的粒径受甘草黄酮浓度、PVPK30及PEG-400共同影响,粒径随着PVPK30和PEG-400的用量增加先降低后升高,随甘草黄酮浓度的增大呈非线性增加。经以上分析,模型预测的最优处方为:甘草黄酮为10.14 mg﹒mL-1,PVPK30为2.26 mg﹒mL-1,PEG400为2.29 mg﹒mL-1,预测Y值为181.8。
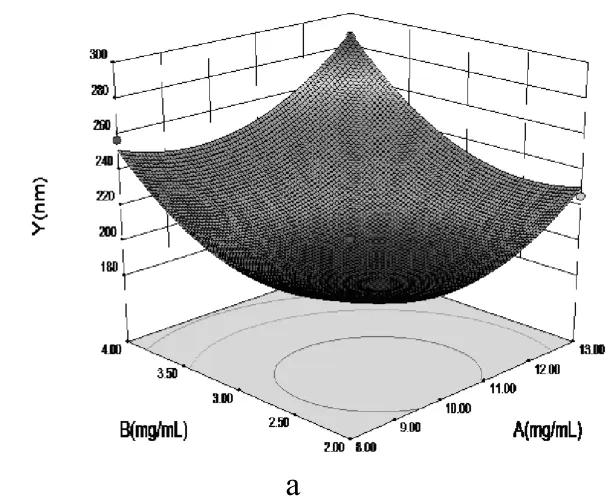
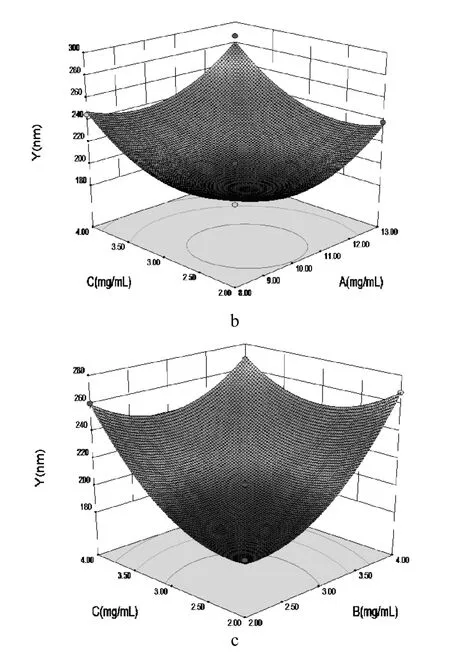
图4 三维效应曲面图
2.4.4 最优处方验证 按“2.4.3”项下优化所得处方,制备3批甘草黄酮纳米混悬剂,测定平均粒径及PDI值。见表5可知,预测值与实际值的偏差为1.16%,说明 Box-Behnken设计-效应面法所得到的数学模型预测性良好,适用于甘草黄酮纳米混悬剂的处方优化。
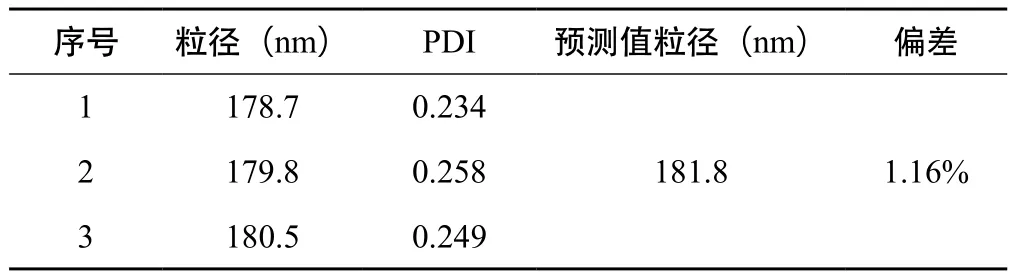
表5 Box-Behnken设计-效应面法优化验证
3 结论
通过试验,采用 Box-Behnken设计-效应面法优选甘草黄酮纳米混悬剂的最优处方。以PVPK30、PEG-400为稳定剂,采用沉淀法-高压均质法制备甘草黄酮纳米混悬剂,得到外观均为带乳光的棕黄色溶液,粒径为(179.7±0.907)nm,PDI为0.274±0.012。
4 讨论
纳米混悬剂制备方法主要分为了Bottom-up 技术和Top-down 技术两大类,沉淀法即采用Bottom-up技术将药物先溶解后通过控制析晶条件聚集成纳米粒子;高压均质法采用Top-down技术借助机械力将药物大颗粒粉碎成纳米粒子。将沉淀法和高压均质法联合使用,不仅降低了高压均质机堵塞狭缝的风险,防止其因硬度过大不易均质,且克服了沉淀法制得产品不均匀,易团聚的问题[8-9]。
纳米混悬剂属于热力学不稳定体系,粒子易发生聚集以减小表明自由能。为克服粒子间的聚集,通常需加入适量、适宜的稳定剂。PVP K30是一种常用的空间稳定剂,提供立体稳定效应[10-11]。本研究采用PVPK30与PEG-400 联合作为稳定剂制备甘草黄酮纳米混悬剂。
应用Box-Behnken 效应面法优化甘草黄酮纳米混悬剂处方是基于单因素试验,可充分考虑到各个因素之间的交互作用,并对其进行非线性模型拟合,具有可信度高、预测性好等优点。
[1]伍卫平, 孙文基.甘草黄酮类化学成分研究进展[J].中国药品标准, 2004, 5(1):10.
[2]刘洋, 金玉姬, 吴湘军,等.甘草黄酮的研究现状及进展[J].吉林医药学院学报, 2014(2):135.
[3]Shen BD, Jin S, Yu C, Yue PF, Han J, Yuan HL.Enhanced intestinal absorption activity and hepatoprotective effect of herpetrione via preparation of nanosuspensions using pH-dependent dissolving-precipitating/homogenization process [J].Pharm Pharmacol, 2013, 65(9): 1382.
[4]朱建芬, 吴祥根.纳米混悬剂的制备方法及其在药剂学中的应用研究进展 [J].中国医药工业杂志, 2006, 37(3): 196-199.
[5]武娜, 张利红, 程玲,等.金丝桃苷固体纳米晶体的制备及其体外释放研究[J].中草药, 2015, 46(12):1759.
[6]罗开沛,李小芳,杨露,等.水飞蓟素纳米混悬剂的制备及体外溶出[J].中国医药工业杂志,2016,47(9):1165.
[7]Vijay A,,Meenakshi B.Investugation of Formulation and Process Parameters for the Production of Esomeprazole Nansuspension by Anti-solvent Prcipitation Ultasonication Technique[J].Current Nanoscience,2013,9(6):773.
[8]Zhao YX,Hua HY,Chang M, et al.Preparation and cyto-toxic activity of hydroxycamptothecin nanosuspensions[J]Int J Pharm, 2010,392(1-2):64.
[9]袁慧玲, 易加明, 张彩云,等.纳米混悬剂的制备方法及给药途径研究进展[J].中国新药杂志, 2014(3):297.
[10]Van Eerdenbrugh B, Vermant J, Martens JA, et al.A screening study of surface stabilization during the production of drug nanocrystals [J].J Pharm Sci, 2009, 98(6): 2091.
[11]岳鹏飞,王 勇,万 晶, 等 .固体纳米晶体给药系统构建方法的研究进展 [J].药学学报, 2012, 47(9): 1120.

