异烟肼对利福平单耐/多耐药肺结核患者治疗效果的分析
代晓琦 李仁忠 阮云洲 苏伟 王忠东 王黎霞
耐药结核病是指对一种或者多种抗结核药物存在耐药性的结核病,至少对利福平和异烟肼同时存在耐药的结核病为耐多药结核病(multidrug-resistant tuberculosis, MDR-TB)。我国因为MDR-TB患者绝对数大,居世界第二位,而被归类为MDR-TB高负担国家。2016年全球新发利福平耐药结核病患者(rifampin-resistant tuberculosis,RR-TB)10万例,其中45%的患者分布在印度、中国和俄罗斯,约25万例患者死于MDR/RR-TB[1]。耐药结核病尤其是MDR-TB的出现,在许多国家已成为重大的公共卫生问题[2]。2013年WHO提出将RR-TB与MDR-TB患者统一登记管理,使用MDR-TB治疗方案进行治疗[3]。
为了探索建立与社会基本医疗保险(简称“医保”)相结合的医疗机构和疾病预防控制(简称“防控”)系统相合作的耐多药肺结核患者的防控新模式,提高患者的发现率和治愈率,我国从2011年开始开展了中国卫生部-盖茨基金会结核病防治合作项目——医院与疾控系统合作管理耐多药肺结核试点研究项目(简称“医防合作子项目”)。2016年依托“医防合作子项目”研究现场,在进行“MDR-TB患者治疗转归影响因素的调查分析”的过程中发现,在RR-TB患者中有一类患者对利福平单耐(rifampicin mono-resistant tuberculosis,RMR-TB)/多耐药(rifampicin poly-drug resistant tuberculosis,RPR-TB)[4],对异烟肼敏感,但这类肺结核患者的治疗方案中却有部分患者并未加用异烟肼。由于异烟肼是抗结核药物中抗菌活性最强的药物[5],对于此类肺结核患者在使用MDR-TB治疗方案的同时加用异烟肼是否会提高治疗成功率,相关研究及报道还较少。因此,本次研究依托于“医防合作子项目”,探讨异烟肼对利福平单耐/多耐药肺结核患者治疗效果的影响,为能够有效地防控和治疗耐药结核病提供参考依据。
对象和方法
1.患者纳入:收集2011年1月1日至2011年12月31日“医防合作子项目”4个研究地区[内蒙古自治区呼和浩特市(华北)、河南省开封市(华中)、江苏省连云港市(华东)和重庆市永川区(华西)]确诊的利福平单耐/多耐药的50例肺结核患者资料。50例患者中,治愈21例(42.00%)、完成治疗1例(2.00%)、失败12例(24.00%,1例无法使用有效治疗方案)、死亡3例(6.00%)、丢失12例(24.00%)、未评估1例(2.00%)。
2.患者分组:50例利福平单耐/多耐药肺结核患者中,剔除14例丢失、未评估、无法使用有效治疗方案的患者,对其余36例患者的临床资料进行分析。其中11例(30.56%)患者在接受治疗后3~4个月时加用了异烟肼(治疗方案:3~6Am-Lfx-H-PZA-EMB/9~12 Lfx-H-PZA-EMB;简称“异烟肼组”),25例(69.44%)未加用异烟肼(治疗方案:6 PZA-Am (Cm)-Lfx(Mfx)-PAS(EMB)-Pto/18 PZA-Lfx(Mfx)-PAS(EMB)-Pto;简称“标准组”)。两组患者的基本情况差异均无统计学意义(P值均>0.05),具体见表1。
3.两组患者的耐药情况:传统药物敏感性试验(简称“药敏试验”)结果显示,纳入分析的36例肺结核患者中有8种耐药谱,异烟肼组的患者中有6种耐药谱系,标准组的患者中有8种耐药谱系。异烟肼组耐药率较高的分别为耐R(36.36%)、耐R+S+Ofx(18.18%)和耐R+EMB+S+Ofx(18.18%),无耐R+Ofx及耐R+S+Km者;标准组耐药率较高的分别为耐R(48.00%)、耐R+S(12.00%)、耐R+EMB(12.00%)。具体见表2。
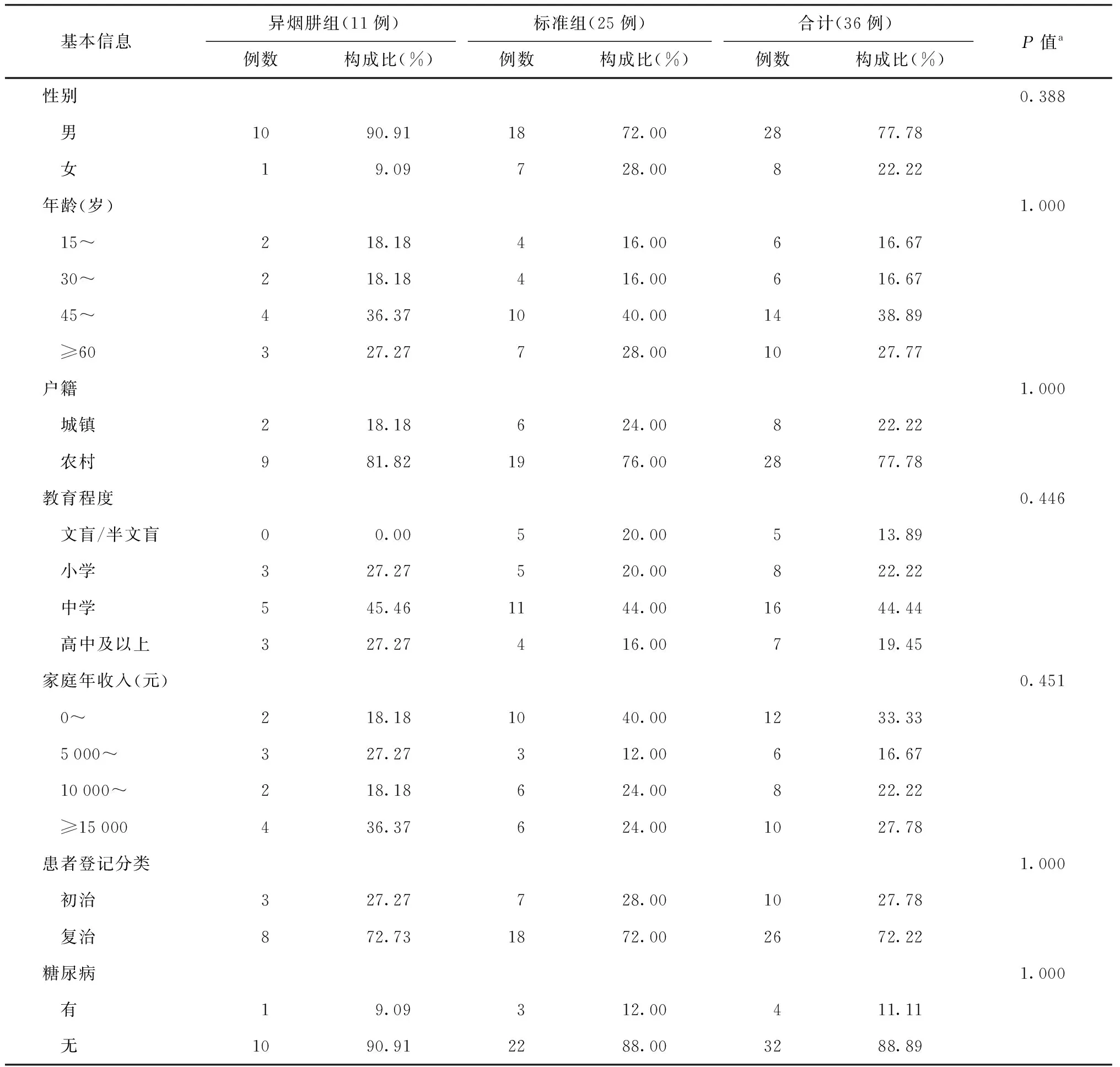
表1 研究对象基本信息在两组患者中的分布情况
注a:采用Fisher精确概率法检验

表2 不同耐药谱在两组患者中的分布情况
注括号外数值为“患者例数”,括号内数值为“耐药率(%)”
4.调查设计及问卷调查:在对“医防合作子项目”治疗的所有患者进行“MDR-TB患者治疗转归影响因素”的调查分析时,通过咨询结核病防控领域、统计学领域专家和预调查,设计完成了《利福平耐药肺结核患者治疗情况调查表》,调查表内容包括患者基本信息、既往史、治疗情况和药物不良反应发生情况等,并使用该问卷收集患者队列数据。选择有结核病控制和临床经验的专业人员作为现场调查人员,在调查前统一进行培训;调查过程中,及时核查漏缺项,并就患者治疗期间治疗情况与医疗机构信息系统中的记录进行核对。问卷核对后,采用双录入的方式录入EpiData 3.1数据库,并抽取10%问卷进行复核。问卷有效率为100%,本研究中的利福平单耐/多耐药的所有患者数据均来源于此问卷调查。
5. 利福平耐药的诊断:应用基因芯片和传统药敏试验对在疾病预防控制中心(简称“疾控中心”)和医院诊断为涂片阳性的肺结核患者进行一线、二线抗结核药物的耐药性检测。
6.患者的治疗方案:若患者基因芯片快速诊断结果为利福平耐药,则在传统药敏试验结果报告之前,可以对耐多药肺结核疑似患者采用由国产抗结核药物组成的WHO推荐使用的MDR-TB标准化治疗方案[6 PZA-Am (Cm)-Lfx(Mfx)-PAS(EMB)-Pto/18 PZA-Lfx(Mfx)-PAS(EMB)-Pto]进行治疗,待传统药敏试验结果报告后再进行治疗方案的调整;但若两者结果不一致,则需经国家参比实验室复核后再行调整,如果证实为耐利福平肺结核患者,则改为加用异烟肼的治疗方案(3~6Am-Lfx-H-PZA-EMB/9~12 Lfx-H-PZA-EMB)[2],如果治疗3个月(注射期)痰菌阴转(连续2次痰涂片和培养阴性,间隔至少30 d)则继续9个月的非注射期治疗;否则,需再次做痰培养、菌种鉴定和药敏试验,同时继续注射期治疗直至满6个月,若此次药敏试验结果显示异烟肼耐药者,则再按MDR-TB方案处理;若为异烟肼敏感者,则仍按加用异烟肼的方案治疗直至满12个月。但由于传统药敏试验结果报告和国家参比实验室复核的时间较长,很多利福平单耐/多耐药肺结核患者并未加用异烟肼治疗,故本调查中此类患者的治疗方案出现了加用异烟肼和未加用两种现象。国产抗结核药物的种类和剂量[6]详见表3。
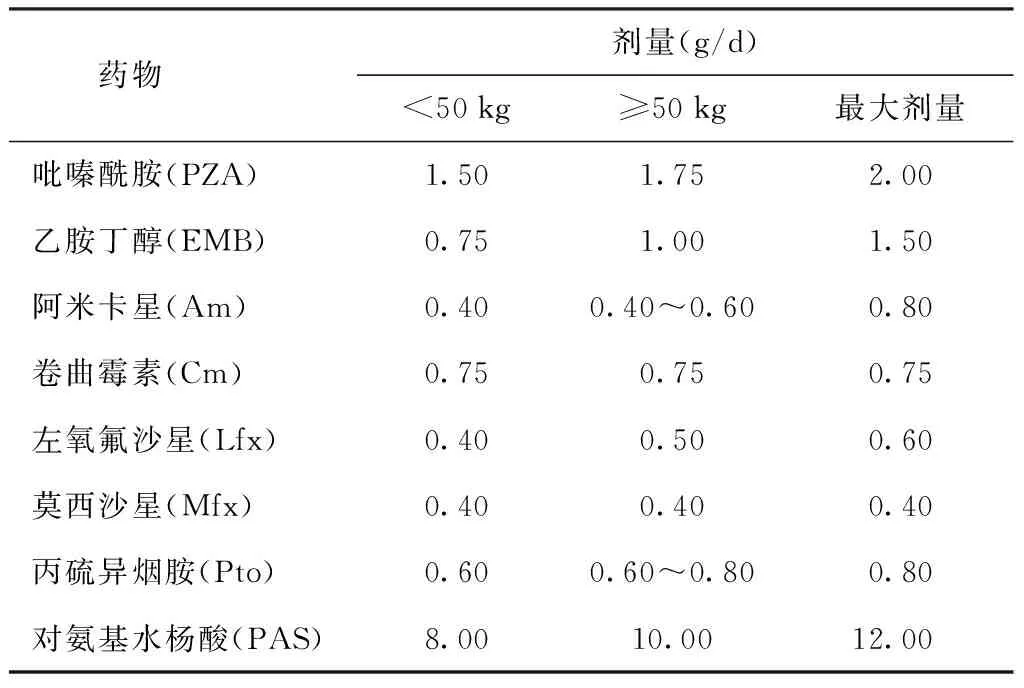
表3 研究对象所用国产抗结核药物的种类和剂量
7.治疗转归:截至2014年10月底,纳入项目的患者全部完成治疗疗程。治疗结果包括:治愈、完成治疗、失败、 死亡、丢失和未评估;治疗结果定义见WHO发布的《结核病定义和报告框架(2013修订版)》[7]。治愈和完成治疗的患者视为治疗成功。
8.统计学分析:建立EpiData数据库,使用SAS 9.3软件对数据进行统计分析。基本情况采用描述性分析,计数资料采用Fisher精确概率检验,检验水准为α=0.05。
结 果
1. 两组患者药物不良反应的发生情况:异烟肼组患者药物不良反应发生率[54.55%(6/11)]低于标准组[60.00%(15/25)],但差异无统计学意义(Fisher精确概率检验,P=1.000),详见表4。

表4 药物不良反应类型在两组患者中的分布情况
注括号外数值为“患者例数”,括号内数值为“发生率(%)”
2.治疗结果:36例患者中,治疗成功患者22例(61.11%),其中治愈21例(58.33%)、完成治疗1例(2.78%);失败11例(30.56%)、死亡3例(8.33%)。异烟肼组与标准组患者的治疗结果差异有统计学意义(P=0.016),异烟肼组患者治疗成功的比率(90.91%)较高,见表5。
讨 论
在2016年之前的全球结核病报告中,耐药结核病负担的估算多关注于MDR-TB。2016年开始,WHO指出RR-TB患者(包括了所有对利福平耐药的情况,即单耐药、耐多药、多耐药以及广泛耐药)[7],无论是否耐其他抗结核药物,都需要使用MDR-TB治疗方案[1, 7];加之WHO曾报道80%以上的RR-TB患者也同时对异烟肼耐药,说明大多数的RR-TB患者为MDR-TB患者[8];同时我国耐药基线调查报告也显示,86%的RR-TB患者为MDR-TB[9];因此,MDR-TB患者和RR-TB关系紧密。根据2014年WHO伙伴手册的相关内容[10],利福平耐药与异烟肼耐药呈明显相关性,在快速诊断技术确定利福平耐药后,可及时予以MDR-TB治疗方案。但由于异烟肼是在抗代谢研究中发现的一种结构简单的药物,具有对结核分枝杆菌高特异性的抗菌活性,是抗结核药物中抗菌活性最强的药物[5],如果未能明确是否对异烟肼耐药而直接舍弃使用,很可能会影响患者的治疗效果;另外,对于利福平单耐/多耐药肺结核患者在加用异烟肼后是否会提高治疗成功率,相关研究及报道还较少。因此本研究针对此问题进行研究分析。
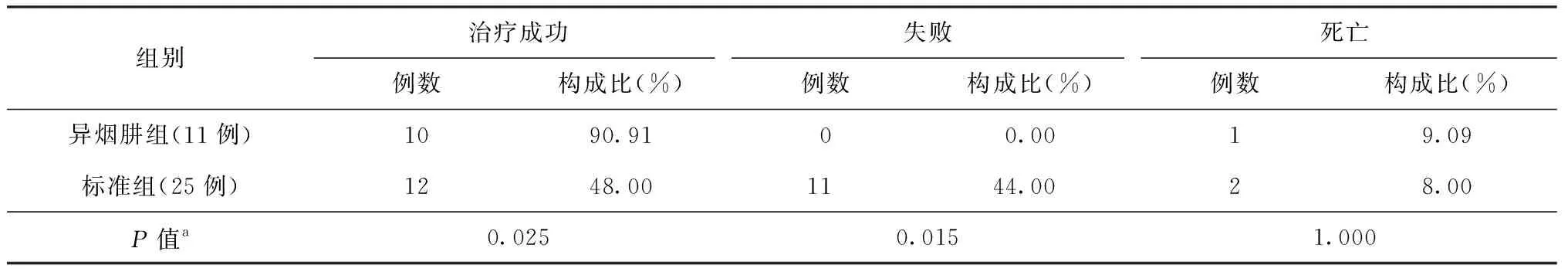
表5 两组患者治疗结果比较
注a:Fisher精确概率法检验;治疗成功=治愈+完成治疗
研究中使用基因芯片检测发现的耐利福平肺结核患者在传统药敏试验结果出来之前,首先作为耐多药肺结核患者采用MDR-TB标准化治疗方案,在确诊为耐利福平肺结核患者后根据情况改用12~18个月的单耐利福平抗结核治疗方案[2];本次研究中,异烟肼组和标准组的患者基本信息、药物不良反应发生情况的差异均无统计学意义,说明两组患者具有可比性,且治疗过程中,是否加用异烟肼并不会增加药物不良反应的发生。同时,研究数据显示,在患者诊断为利福平单耐/多耐药肺结核时,改用含有异烟肼的相应治疗方案后,这部分患者的治疗成功率(90.91%)明显高于继续使用MDR-TB治疗方案的患者(48.00%),失败率(0.00%)明显低于未加用组(44.00%),提示加用异烟肼能够明显改善此类患者的治疗效果,建议在不能确定患者是否对异烟肼耐药的情况下,可以考虑加用异烟肼,或在患者确诊利福平单耐/多耐药时及时加用异烟肼进行治疗,以确保治疗效果。
有研究显示,加大异烟肼的使用剂量,可以使患者单位体积内抗结核药物的血药浓度增加,杀菌和抑菌的效果也能随之提升,改善治疗效果[11];针对复治患者,由于之前已经接受过包括异烟肼的治疗方案而未能成功,可能也与剂量不够有关,提高药物剂量是改善治疗效果的一个研究方向[12-13];也有研究指出,因为异烟肼耐药的水平低于标准方案用药后的血清水平峰值,因此使用大剂量异烟肼对其治疗有效[14],其效果依赖于使用剂量[15]。本研究未对患者使用异烟肼后的血药浓度进行检测是本次研究的一个局限,希望进一步研究在血药浓度监测下提高异烟肼的治疗效果,及增加可使用异烟肼的患者数量。
本研究中36例患者中有8种耐药谱,耐药谱结果显示出多态性与复杂性。其中比例较高的有耐R(44.44%)、耐R+S(11.11%)、耐R+EMB(11.11%),与相关文献相近[16]。异烟肼组耐药率较高的为耐R(36.36%)、耐R+S+Ofx(18.18%)和耐R+EMB+S+Ofx(18.18%),无耐R+Ofx及耐R+S+Km者;标准组耐药率较高的为耐R(48.00%)、耐R+S(12.00%)、耐R+EMB(12.00%)。提示两组患者的耐药谱还是存在一定的差异,可参考耐药谱制定更有针对性的治疗方案,以提高治疗效果。
本次研究仅有36例患者的数据纳入分析,例数偏少,代表性有一定局限,统计学分析可能出现偏差。且本次研究对象中仅11例患者的治疗方案加用了异烟肼,加用时间集中在接受治疗后的3~4个月,造成加用异烟肼的比例偏小、加用时间不够及时,考虑与传统药敏试验及国家参比实验室复核后确诊为单耐利福平的用时较长有关;还可能与菌株在运输和保存过程中易造成污染或者损坏,无法最终确定耐药情况有关。但由于目前相关研究还较少,本研究结果提示了应重视RR-TB患者治疗方案的及时调整,在不确定是否耐异烟肼的情况下,可以考虑治疗初期加用异烟肼,待明确耐药谱后再调整,对于今后的研究具有参考价值。
[1] World Health Organization. Global tuberculosis report 2016. Geneva:World Health Organization, 2016.
[2] World Health Organization. Guidelines for the programmatic management of drug-resistant tuberculosis emergency update 2008. Geneva:World Health Organization, 2008.
[3] World Health Organization. Global tuberculosis report 2013. Geneva:World Health Organization, 2013.
[4] 顾瑾, 唐神结. 对利福平耐药结核病诊治的思考. 中国防痨杂志, 2015,37(11):1097-1101.
[5] 谭守勇, 丁秀秀, 谭耀驹, 等. 异烟肼和利福平治疗方案对单耐异烟肼或利福平肺结核患者的治疗效果. 中华结核和呼吸杂志, 2014,37(12):915-918.
[6] 王宇. 耐多药肺结核防治管理工作方案. 北京: 军事医学科学院出版社, 2012.
[7] 世界卫生组织. 结核病定义和报告框架(2013修订版). 日内瓦:世界卫生组织, 2014.
[8] World Health Organization. Anti-tuberculosis drug resistance in the world: Third global report. Geneva:World Health Organization, 2004.
[9] 肖东楼. 全国结核病耐药性基线调查报告. 北京: 人民卫生出版社, 2010.
[10] World Health Organization. Companion handbook to the WHO guidelines for the programmatic management of drug-resistant tuberculosis. Geneva:World Health Organization, 2014.
[11] 陈瑜晖, 钟球, 周琳, 等. 不同方案治疗复治肺结核的疗效评价. 广东医学, 2017,38(15):2355-2358.
[12] 杜建, 刘宇红, 李亮, 等. 复治肺结核患者采用不同化疗方案的效果评价. 中国防痨杂志, 2016,38(10):850-857.
[13] Chen L, Du J, Li L, et al. Low doses of rifampicin used in new tuberculosis patients correlated to increased frequency of rifampicin-resistance and poorer treatment outcomes. Open J Med Microbiol, 2015,5(2):76-84.
[14] Piubello A, Harouna SH, Souleymane MB, et al. High cure rate with standardised short-course multidrug-resistant tuberculosis treatment in Niger:no relapses. Int J Tuberc Lung Dis, 2014,18(10):1188-1194.
[15] Dooley KE, Mitnick CD, Ann DM, et al. Old drugs, new purpose: retooling existing drugs for optimized treatment of resistant tuberculosis. Clin Infect Dis, 2012,55(4):572-581.
[16] 张天华, 刘卫平, 李妍, 等. 陕西省肺结核耐药性监测分析. 中国热带医学, 2017,17(3):226-230.

