BRCA1在非小细胞肺癌中表达及临床意义研究*
崔方博,张丰林,高尔云
安徽省马鞍山市人民医院肿瘤科(马鞍山 243000)
近年来,非小细胞肺癌在肺癌中占据很大比例,因此提高非小细胞肺癌的治疗效果迫在眉睫[1]。虽然治疗手段不断提高,手术、化疗、放疗、靶向治疗等综合治疗的有效率极为有限,目前非小细胞肺癌的5年生存率仅17.1%[2]。随着表皮生长因子受体(Epidermal crowth factor receptor,EGFR)、间变性淋巴瘤激酶(Anaplastic lymphoma kinase, ALK)等非小细胞肺癌驱动基因研究的深入,相应的靶向药物进入临床应用,取得了显著的疗效[3]。大量研究表明,非小细胞肺癌患者的预后较差可能是与化疗反应率低,或对联合化疗过程中产生的原发或继发性药物耐药有关[4]。化疗药物和靶向药物疗效预测相关基因深入研究,极大促进了非小细胞肺癌个体化化疗和个体化靶向治疗的发展和应用[5]。乳腺癌易感基因1(Breast cancer susceptibility gene1, BRCA1)被认为与非小细胞肺癌化疗疗效、预后等相关[6],可能在非小细胞肺癌的发生发展中扮演重要角色。本文通过检测32例非小细胞肺癌患者的BRCA1基因表达情况,并分析BRCA1与非小细胞肺癌临床病理特征的关系,旨在探讨非小细胞肺癌患者中BRCA1表达情况及其临床意义。
资料与方法
1 资料来源 本研究选取2016年1月至2017年12月期间在马鞍山市人民医院住院治疗并且通过接受活检或手术等方式,病理诊断为非小细胞肺癌患者32例,排除合并其他恶性肿瘤者。选取每例患者组织中的正常组织和肿瘤组织分别作为对照组和非小细胞肺癌组。男性20例(62.5%),女性12例(37.5%),年龄<60岁17例(53.1%),≥60岁15例(46.9%);病理类型为腺癌19例(59.3%),非腺癌13例(40.7%);分期I-II期4例(12.5%),III期9例(28.1%),IV期19例(59.3%);高分化3例(9.38%),中分化7例(21.9%),低分化22例(68.8%);吸烟者17例(53.1%),不吸烟者15例(46.9%)。
2 主要试剂 BRCA1的PCR引物由生工生物工程(上海)有限公司合成;EGFR引物由广州锐博生物科技公司提供;组织蛋白提取试剂盒(南京凯基生物科技发展有限公司);RNAiso Plus、Prime Script® RT reagent Kit with gDNA Eraser、SYBR® Premix Ex TaqTMII (Tli RNase H Plus)(大连宝生物工程有限公司);Trizol总RNA提取试剂盒(天根公司);RT-PCR反转录试剂盒(天根公司);BCA蛋白定量试剂盒、Beyo ECL Plus试剂盒(碧云天);抗GAPDH、抗BRCA1单克隆抗体、二抗和荧光二抗(CST)。
3 实验方法
3.1 HE组织病理学染色: 分别取对照组(正常肺组织)和非小细胞肺癌组的组织,经过脱水和石蜡包埋后,分别切成5μmol/L厚的薄片制作切片并用于染色。对照组和非小细胞肺癌组的切片经过HE染色封片后,置于正置显微镜下观察两组组织病理学差异并且拍照分析,以验证所选取组织为正常肺组织或肺癌组织,进行后续检测。
3.2 免疫荧光染色:分别取对照组和非小细胞肺癌组的肺组织石蜡切片,经二甲苯脱蜡、梯度浓度酒精脱水后,进行抗原修复,然后用0.01 mol/L PBS (pH 7.4)漂洗3次,5 min/次。然后在10% BSA湿盒内封闭30min(37 ℃封闭)。然后在标本片上滴加适当稀释的荧光标记抗体 (1∶100稀释抗体),放在湿盒中,4 ℃孵育过夜。经过PBS(pH 7.4) 漂洗3次(5min/次)后,于避光处滴加荧光二抗 (1∶100稀释抗体),置于37 ℃湿盒内继续孵育2 h。最后经缓冲甘油封片,在正置荧光显微镜下观察拍照。
3.3 Real-Time PCR分析:将适量的对照组和非小细胞肺癌组的组织迅速转移至含1 ml Trizol试剂中进行组织充分研磨使其成为匀浆,室温静置5 min,使样品裂解完全,经12000 g,4℃离心5 min后小心取出上清液。在上清液中加入氯仿,混合均匀,室温静置5 min后,12000g,4℃离心15 min后小心取出上清液。然后加入相同体积的异丙醇,室温静置10 min。12000 g,4 ℃离心10 min,留取沉淀,加入75%乙醇,混合均匀,用来洗RNA沉淀。最后加入RNas-free水使之完全溶解。然后测定OD260/OD280的比值,测定RNA浓度。最后根据说明书,根据表1所示的引物序列模板进行逐步扩增,反应产物进行RT-PCR分析。
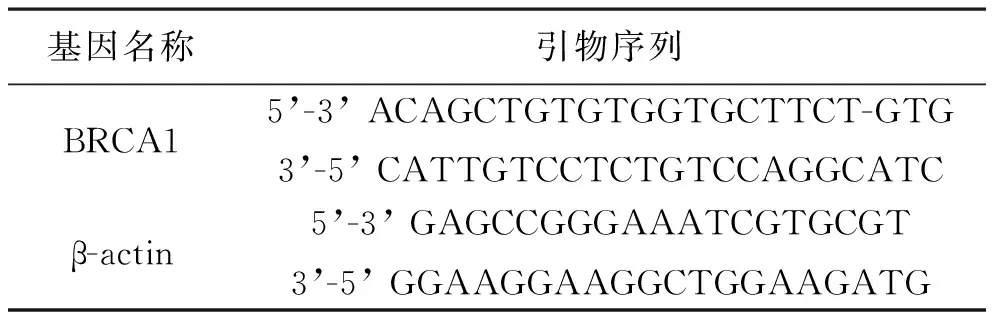
表1 BRCA1和β-actin mRNA的RT-PCR引物序列
3.4 Western blotting分析:将正常肺组织和非小细胞肺癌组织,分别用冰生理盐水洗2遍,按照全蛋白抽提试剂盒说明书进行操作,加入裂解液,组织匀浆器匀浆1 min后离心收集上清。用BCA蛋白浓度测定试剂盒测定蛋白浓度,将全蛋白提取液与2 × Loading buffer,按照体积比1∶ 1混匀,沸水浴5 min,自然降温。根据目标蛋白分子量配制适当比例的SDS-PAGE分离胶,凝固1h左右,然后配制5%SDS-PAGE浓缩胶,凝固0.5 h左右。加入电泳缓冲液,将变性的蛋白样品加入上样孔中,按照蛋白浓度上样,使每孔总蛋白含量相同。在220 V恒压下进行电泳,直至溴酚蓝达到胶底部,停止电泳。根据目标蛋白的分子量,切胶,放入Transfer buffer中,依照胶的大小裁剪一层PVDF膜和6层滤纸,先将PVDF模放入甲醇中浸泡10s,然后将PVDF膜和滤纸放入Transfer buffer中。按照正极-三层滤纸-PVDF模-凝胶-三层滤纸-负极顺序放入转膜仪中,注意边缘对齐,防止起泡。在110 V恒压下转膜2 h。将附有蛋白的PVDF膜放在5%的脱脂奶粉中室温摇床封闭2 h。将封闭好的膜用TTBS洗5 min,放入相应比例的一抗中,4℃孵育过夜。TTBS洗膜3次,每次10min,放入对应的二抗中,摇床上室温孵育3 h,TTBS洗膜3次,每次10 min。凝胶成像仪开机预热30 min,将ECL发光试剂盒中的A、B两种试剂等体积均匀混合,滴加在PVDF膜上,充分接触,避光显色1 min,用滤纸将膜周围的多余液体吸干,放入凝胶成像仪中,采用动态积分模式进行拍照,观察结果。采用Quantity one图像分析软件进行图像分析。
3.5 EGFR基因检测: 采集非小细胞肺癌患者血标本,进行外周血细胞DNA的提取和EGFR基因检测。抽取研究对象周围静脉血提取DNA。然后根据聚合酶链反应及凝胶电泳对EGFR基因检测。EGFR基因上游引物为5'- CTTCGGGGAGCAGCGATGCGAC- 3',下游引物为5'- ACCAATACCTATTCCGTTACAC -3'。
结 果
1 EGFR基因突变情况 32例非小细胞肺癌患者中,9例患者检测出EGFR基因突变,其中包括Exon 19缺失4例(44.4%)、Exon 21(L858R)突变5例(55.6%)。
2 HE染色结果 通过HE染色可知对照组和非小细胞肺癌组的组织在病理学上比较具有显著差异。与正常肺组织相比,非小细胞肺癌组织结构被破坏,核染色质颜色变深,大量癌细胞产生(图1)。以此我们区分正常组织和肺癌组织,为后续实验做准备。
3 免疫荧光染色结果 通过免疫荧光法检测对照组和非小细胞肺癌组的组织中BRCA表达情况。与对照组相比,非小细胞肺癌组的BRCA1表达显著增高(图2)。
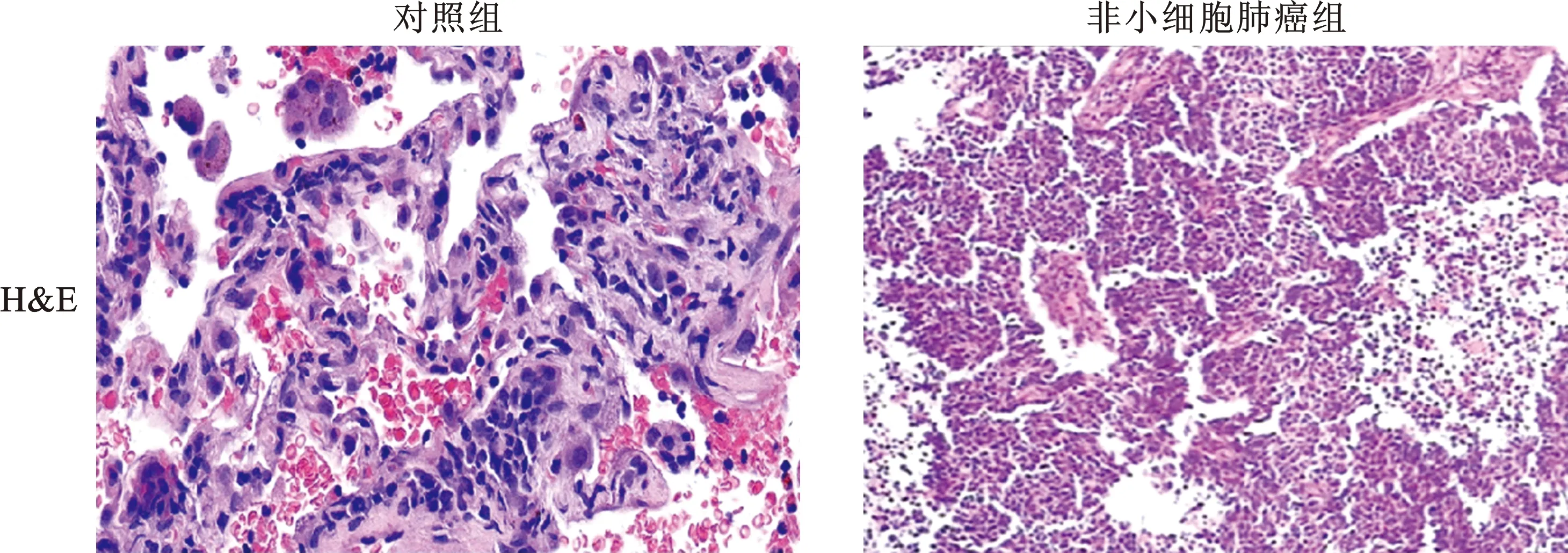
图1 对照组和非小细胞肺癌组组织HE染色结果(×200)
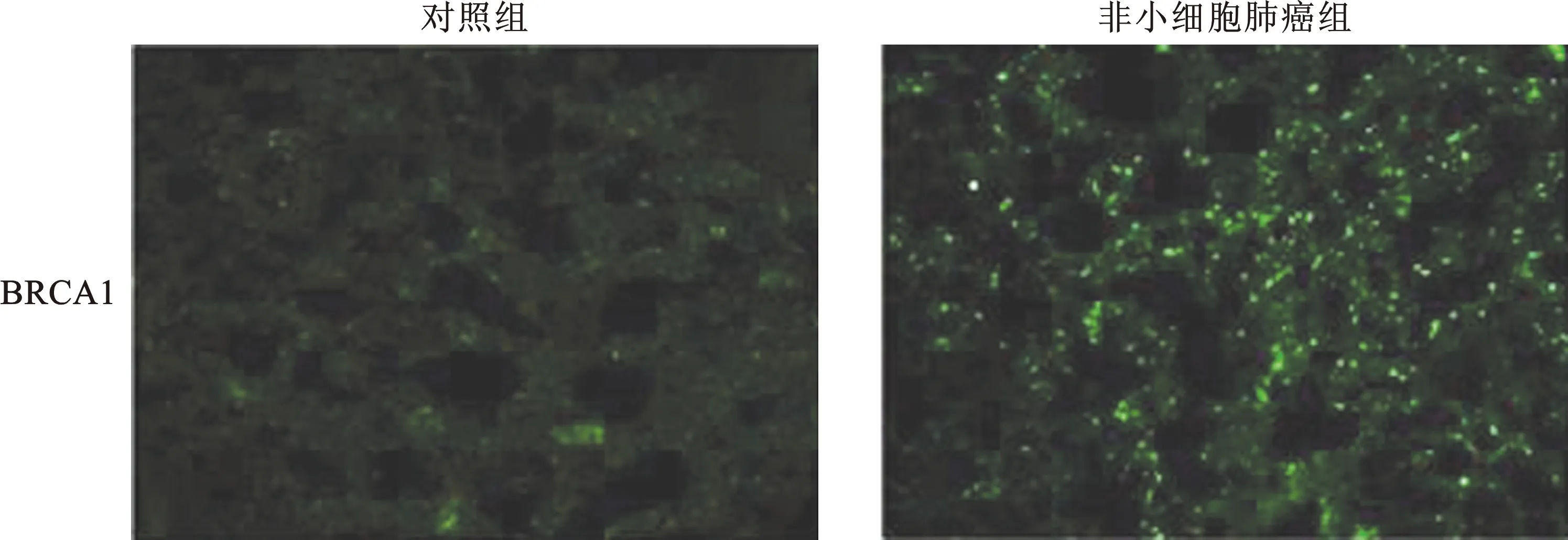
图2 免疫荧光法检测对照组和非小细胞肺癌组组织中BRCA1表达情况 (×200)
4 BRCA1 RT-PCR结果 对照组和非小细胞肺癌组的组织样本分别提取的总RNA,经RT-PCR 后,检测出较对照组,非小细胞肺癌组中BRCA1显著升高(图3)。
5 BRCA1蛋白的Western blotting结果 分别提取对照组和非小细胞肺癌组的组织样本蛋白,经Western blotting后,检测出较对照组,非小细胞肺癌组中BRCA1蛋白的表达显著升高(图4)。
6 BRCA1 mRNA表达水平与患者临床病理特征的相关性 BRCA1 mRNA表达水平与患者临床病理特征的相关性分析采用Spearman相关分析,相关系数r的绝对值越接近1,提示相关性越强。各临床病理特征中,肿瘤分期与BRCA1 mRNA相关性最强差异具有统计学意义(r=0.78,P<0.05);其他临床病理特征,包括EGFR突变情况等,与BRCA1 mRNA表达水平无明显相关性。提示BRCA1可能在非小细胞肺癌的疾病发展过程中有重要作用。
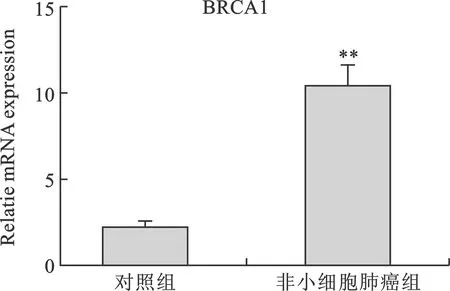
图3 对照组和非小细胞肺癌组的组织中
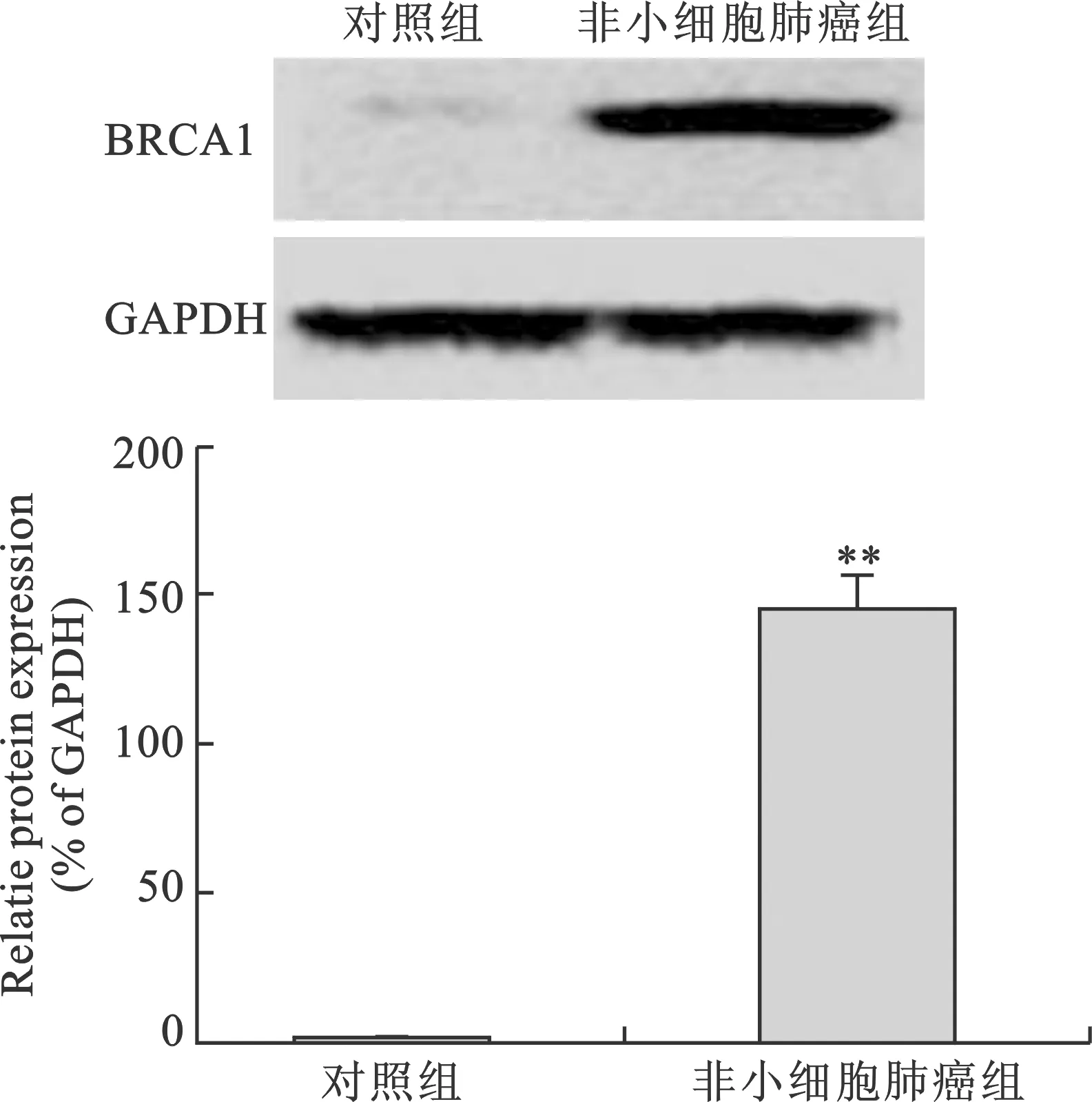
图4 对照组和非小细胞肺癌组组织中BRCA1
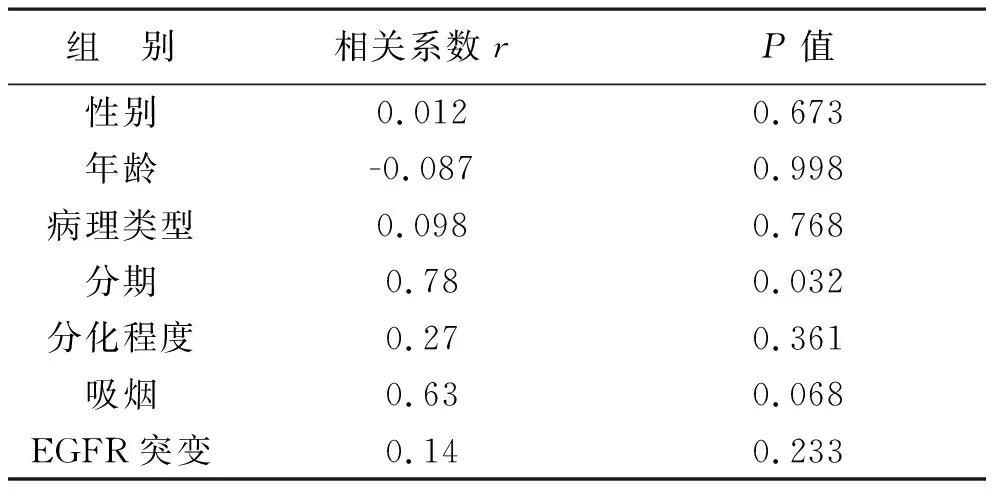
组 别相关系数rP值性别0.0120.673年龄-0.0870.998病理类型0.0980.768分期0.780.032分化程度0.270.361吸烟0.630.068EGFR突变0.140.233
讨 论
非小细胞肺癌长期以来作为高发恶性肿瘤严重的威胁着人类的健康[7]。中国癌症现状大数据指出,在男性中,非小细胞肺癌的发病率排在恶性肿瘤中的首位,而在女性中,非小细胞肺癌的发病率仅此于乳腺癌的发病率排在第二位[8]。随着经济和科学技术的发展,非小细胞肺癌的治疗已进入个体化治疗阶段,尤其是以EGFR、ALK等驱动基因为靶点的药物的研发,在非小细胞肺癌的诊断和治疗中有着里程碑式的意义,显著提高了部分患者的生存时间[9]。
PARP抑制剂Olaparib已被美国食品药品监督管理局推荐为BRCA1/2突变的铂类敏感的复发卵巢癌患者的靶向治疗[10],提示了BRCA1作为诊治靶点的可行性。BRCA1因与遗传性乳腺癌有关,而被研究者在1990年发现,后发现BRCA1是具有抑制恶性肿瘤发生的抑癌基因,与多种肿瘤的发生发展相关,在调节人体细胞的复制、DNA损伤修复、细胞的正常生长方面有重要作用[11]。BRCA1在非小细胞肺癌中可能与铂类、紫杉类的化疗疗效相关[12]。BRCA1的基因状况可能与非小细胞肺癌术后患者的复发风险相关[13]。还有研究提示BRCA1的表达水平与EGFR突变非小细胞肺癌患者的预后相关[14]。综上可知,BRCA1在特定肿瘤类型的发生和发展中具有关键作用,可能成为诊治非小细胞肺癌的靶点基因。
本研究选取资料完整的非小细胞肺癌患者32例,记录临床病理特征,并对EGFR突变的情况进行了检测。采用HE组织病理学染色方法区分正常肺组织和非小细胞肺癌的肿瘤组织,通过免疫荧光染色法、RT-PCR和Western blotting法分别证明了在非小细胞肺癌中BRCA1 mRNA和蛋白的表达较正常肺组织均显著升高。这些结果提示BRCA1可能与非小细胞肺癌的发生相关。接着,通过BRCA1 mRNA表达水平与患者临床病理特征的相关性分析,我们发现性别、年龄、病理类型、分化程度和吸烟等因素与BRCA1 mRNA表达水平无明显相关性,而非小细胞肺癌分期与BRCA1 mRNA表达水平之间具有最强的相关性,提示BRCA1可能在非小细胞肺癌的发展过程扮演一定的角色。BRCA1的表达水平与EGFR突变之间没有明显相关性。提示以BRCA1的表达水平来预测化疗的疗效等诊治时与患者是否存在EGFR突变之间并不互相排斥。本研究样本量较小,后续我们将继续收集病例,基于更大样本量对结果进行分析,提供更加有说服力的结论。同时,我们拟在细胞水平研究BRCA1与非小细胞肺癌细胞增殖、侵袭等特性的关系,为更深入的机制研究提供可能。
综上所述,我们的研究结果提示BRCA1可能与非小细胞肺癌的发生和发展过程具有密切关系,有望成为非小细胞肺癌的疾病预防、诊断和治疗的重要分子标志。
[1] Jemal A, Siegel R, Xu J,etal.Cancer statistics[J]. CA Cancer J Clin,2010,60:277-300.
[2] Siegel R, DeSantis C, Virgo K,etal. Cancer treatment and survivorship statistics[J]. CA Cancer J Clin,2012, 62:220-241.
[3] MG Kris,Johnson BE,Berry LD,etal.Using multiplexed assays of oncogenic drivers in lung cancers to select targeted drugs[J]. JAMA,2014,311 (19) :1998.
[4] Guha U, Chaerkady R, Marimuthu A,etal. (2008) Comparisons of tyrosine phosphorylated proteins in cells expressing lung cancerspecific alleles of EGFR and KRAS[J]. Proc Natl Acad Sci USA,2018,105: 14112-14117.
[5] Lynch TJ, Bell DW, Sordella R,etal. (2004) Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib[J]. N Engl J Med,2004,350: 2129-2139.
[6] Mo HW, Li LP, Liu Q,etal.ERCC1, BRCA1, RRM1 expression and the relationship between platinum-based chemotherapy in advanced NSCLC patients[J]. Chin J Clin Res, 2011,24:283-284.
[7] Pao W, Miller V, Zakowski M,etal. EGF receptor gene mutations are common in lung cancers from ‘never smokers’ and are associated with sensitivity of tumors to gefitinib and erlotinib[J]. Proc Natl Acad Sci USA, 2004,101: 13306-13311.
[8] Sequist LV, Martins RG, Spigel D,etal. Firstline gefitinib in patients with advanced non-small-cell lung cancer harboring somatic EGFR mutations[J]. J Clin Oncol,2008,26: 2442-2449.
[9] Bivona TG, Doebele RC. A framework for understanding and targeting residual disease in oncogene-driven solid cancers[J].Nature Medicine, 2016,22(5):472-478.
[10] Husain A, He G, Venkatraman ES,etal. Olaparib maintenance therapy in platinum-sensitive relapsed ovarian cancer[J]. N Engl J Med,2012,366(15):1382-1392.
[11] Quinn JE, Kennedy RD, Mullan PB,etal. BRCA1 functions as a differential modulator of chemotherapy-induced apoptosis[J]. Cancer Res,2006,63: 6221-6228.
[12] Moran T, Wei J, Cobo M,etal.Two biomarker-directed randomized trials in European and Chinese patients with nonsmall-celllung cancer: the BRCA1-RAP80 Expression Customization (BREC) studies[J]. Ann Oncol Nov,2014,25(11):2147-2155.
[13] Harada H, Miyamoto K, Yamashita Y,etal. Methylation of breast cancer susceptibility gene 1 (BRCA1) predicts recurrence in patients with curatively resected stage I non-small cell lung cancer[J].Cancer, 2013,119(4):792-798.
[14] Rosell R, Molina MA, Costa C,etal. Pretreatment EGFR T790M mutation and BRCA1 mRNA expression in erlotinib-treated advanced non-small-cell lung cancer patients with EGFR mutations[J]. Clin Cancer Res,2011,17(5):1160-1168.

