腰大池引流在神经内镜经鼻蝶垂体腺瘤手术中的应用研究*
郑 涛,吕文海,陈 隆,王 元,贺世明
空军军医大学唐都医院神经外科(西安 710038)
垂体腺瘤是起源于垂体前叶的内分泌肿瘤,系发病率第二的颅内原发性良性肿瘤,约占颅内肿瘤的10%,人群发病率为8.2~14.7/10万人。垂体腺瘤好发于青壮年,对患者的生长、发育、劳动能力、生育功能有严重损害,并造成一系列社会心理影响。垂体腺瘤的常见临床症状包括头痛、视力下降及视野缺损、内分泌功能紊乱等。垂体腺瘤的治疗选择包括手术、化疗,以及放射外科。自1907年Schloffer首次采用经鼻蝶窦切除垂体瘤以来,经过120余年的发展,随着照明技术的改进,借助于现代超高清内镜技术的发展,神经内镜经鼻蝶垂体瘤切除术已在全球各医疗机构广泛开展,已成为国际公认的安全、有效的手术方式[1]。内镜经鼻蝶手术切除垂体腺瘤,相对于传统的经颅手术,有其不可比拟的优势,其中,并发症少就是优势之一。但目前还有诸多难点尚需突破及妥善解决,如手术过程中鞍膈下降过快影响肿瘤全切,侵犯海绵窦及包绕颈内动脉致肿瘤全切率低,术后鞍底重建等。内镜经鼻蝶切除垂体腺瘤的严重并发症主要有:脑脊液漏、颅内感染、颈内动脉损伤、垂体功能减退等。上述情况还尚需进一步的研究及解决,已达到提高手术全切率,降低术后并发症的目的。
资料与方法
1 一般资料 选择我科内镜组 2012年1月至2014年1月连续收治的垂体大腺瘤(直径≥2cm)患者108例,行神经内镜经鼻蝶鞍区病变切除术,所有患者知情同意,术前均经1.5T或3.0T垂体增强核磁共振诊断,首发或复发性,均系单发,不合并颅内其他肿瘤,包括经内科治疗无效的泌乳素腺瘤,按手术方式不同分为研究组(术中行腰大池置管)、对照组(术前未行腰大池置管)两组,平均年龄(43.20±16.54)岁,其中,研究组46例(男20例,女26例),平均年龄(45.35±10.17)岁,鞍上侵袭程度分级(Wilson 改良Hardy分级):A级0例,B级31例,C级15例,海绵窦侵袭程度分级(Knosp分级):0级23例,1级8例,2级5例,3级5例,4级5例;对照组62例(男34例,女38例),鞍上侵袭程度分级:A级0例,B级39例,C级23例,海绵窦侵袭程度分级(Knosp分级):0级24例,1级11例,2级12例,3级8例,4级7例。
2 术前准备及评估 所有纳入本研究的患者均按照神经内镜经鼻蝶手术常规行术前准备。主要包括:①眼科检查:所有患者术前、术后均经眼科专业医师行视力、视野检查,必要的辅以眼底及视觉电生理检查;②内分泌检查:所有患者术前、术后及随访时均行血清生长激素(GH)、胰岛素样生长因子-1(IGF-1)、泌乳素(PRL)、促肾上腺皮质激素(ACTH)、皮质醇节律(Cortisol)、促甲状腺腺激素(TSH)、游离甲状腺素(FT4)、甲状腺素(T4)、黄体生成素(LH)、卵泡刺激素(FSH)、睾酮、雌二醇(E2)等;③影像学检查:分别为16排蝶窦CT平扫(明确蝶窦发育情况)及垂体增强核磁共振(明确肿瘤大小、鞍上及鞍内侵袭的范围、海绵窦及颈内动脉包绕的情况等);④其他准备:术前3 d给予氯霉素滴眼液,给予银尔通活性阴离子抗菌液漱口,对于术前内分泌功能检查提示存在内分泌功能紊乱的患者给予相应的生理量激素替代治疗,并常规给予氢化可的松琥珀酸钠50mg ,2次/d静滴。术前1 d行头孢曲松钠皮试,行鼻腔准备、备血、签署知情同意书等。
3 手术方法
3.1 研究组术前腰大池置管: 全麻满意后,患者取左侧卧位,保持背部与床面垂直,屈膝使脊柱尽量后弓,以增加椎间隙,便于进针,选择L3-4、L4-5椎间隙穿刺,局部消毒3次,铺设无菌巾于穿刺部位,使用特制的穿刺套管针进行腰椎穿刺,拔除针芯,明确有脑脊液涌出后,立即经穿刺针鞘置入硅胶软管,向头侧蛛网膜下腔置入软质导管15~20 cm, 拔出穿刺针及硅胶管内导丝,连接尾帽,自皮肤出口处用医用贴膜覆盖,再将导管沿后背正中皮肤上固定,直至肩部,连接三通阀门,另一端接引流管、引流袋,关闭阀门,待术中需要时开放引流管释放脑脊液。
3.2 神经内镜经鼻蝶切除垂体腺瘤:两组患者均由我中心副高及以上职称医师主刀,采用双人-四手-双鼻孔入路,术者位于患者头部右侧,助手位于患者头部左侧,盐酸肾上腺素及利多卡因(1∶3)棉片收缩鼻腔粘膜,用0°内镜(史托斯)详细检查鼻腔,探查蝶窦前壁的蝶窦开口,电凝止血后,切开蝶窦口周围1cm直径粘膜,运用高速显微磨钻向内磨出鼻中隔根部直径约2cm,将内镜伸入蝶窦内观察蝶窦内情况,明确鞍底位置,电凝鞍底粘膜显露鞍底,显微磨钻磨开鞍底直径约1~1.5cm,显露鞍底硬脑膜,穿刺抽吸(深度不超过0.5cm),证实无血液或脑脊液抽出,电凝后钩刀“十”字形切开鞍底硬脑膜,在内镜明视下,用吸引器、刮匙或取瘤钳按下方-两侧-后上方-后侧的顺序分块切除肿瘤,切除肿瘤的过程中,鞍膈蛛网膜通常会疝入鞍内,遮挡手术视野,此时由巡回护士打开腰大池引流管三通阀门,持续引流脑脊液并计量(首次释放20ml,以20ml为增量),主刀医师随时观察鞍膈蛛网膜上移情况,待鞍膈蛛网膜上移理想后,关闭腰大池三通阀门,术中待鞍隔再次下降时根据手术需要决定是否打开三通阀门引流,鞍膈完全上移后瘤腔内视野开阔,残余肿瘤完全暴露、下降,可全部切除残余肿瘤,更换30°镜头伸入鞍内观察鞍膈内壁有无肿瘤残留,如无残留则进入鞍底重建阶段,若术中出现脑脊液漏,术后应及时修补,以自体股外侧肌肉筋膜、脂肪封闭瘘口,使用凝胶海绵、止血纱、人工硬膜、人工诱导骨基质、自体鼻中隔粘膜瓣以适当的比例或步骤,个体化严密修补鞍底,球囊支架压迫后鼻孔,吸痰管吸除口腔及鼻腔内积血,手术结束。术后标本送检行常规切片染色及免疫组织化学检查。对照组术中按照垂体瘤手术操作常规进行。
4 术后管理 两组术后均给予头孢曲松钠2g/d行规范预防感染治疗。准确记录24 h出入量及监测体温,监测血电解质2次/d,术后第1天行16排蝶鞍CT平扫检查明确术区有无出血、肿瘤切除情况等。术后3 d以内复查内分泌激素水平,对有激素水平低下的,给予适当的激素替代治疗。对于术中有脑脊液漏的患者,术后腰大池引流3~5d后拔除,对于术中无脑脊液漏的患者,术毕第1天复查蝶鞍CT后拔除,其余常规治疗包括:观察鼻腔流液情况、鼻腔及口腔护理、半流质饮食、鼓励早期下地、避免剧烈咳嗽等。
5 随 访 所有患者均在出院后进行长期随访。第1次随访为术后1个月,所有患者均行眼科、内分泌及影像学复查,根据复查结果给予相应的指导,并制定后续随访方案,随访数据存档。
6 疗效判定 术中判定标准:切除肿瘤理想后,利用棉片将鞍膈蛛网膜往上推,神经内镜置入蝶鞍内,变换角度镜向四周观察,术区无肿瘤残余、光滑无鞍膈皱褶可判定为全切。术后判定标准:通过对比手术前后1.5T或3.0T垂体增强MRI T1加权像,术区无异常增强病灶可判断为全切。
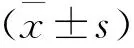
结 果
1 对两组患者的基线资料(年龄、性别、肿瘤分级)进行均衡性检验,具有可比性。研究组46例患者中,有15例在术中释放脑脊液10 ml后鞍隔开始松弛,20 ml后鞍隔完全上移;有14例患者释放20 ml后鞍隔松弛,40 ml后鞍隔完全上移;有16例患者释放30 ml后鞍隔松弛,60 ml后鞍隔完全上移;有1例患者释放40 ml后鞍隔松弛,80 ml后鞍隔完全上移,平均释放41.3 ml。
2 108例神经内镜经鼻蝶手术患者术后1月内均进行1.5T或3.0T垂体核磁增强扫描,与术前垂体增强T1加权像进行仔细对比。研究组术中全切44例(95.65%),术后增强核磁全切43例(93.48%),对照组62例患者,术中全切52例(83.87%),术后增强核磁全切50例(80.65%),研究组无论是在术中内镜下对比,还是在术后增强核磁对比,在全切率方面,均优于对照组(P<0.05)。
3 108例神经内镜经鼻蝶垂体瘤手术患者,术中脑脊液漏16例,其中研究组6例(37.5%),对照组10例(62.5%),具有统计学差异(P<0.05)。 术后脑脊液漏3例,其中研究组1例(33.3%),对照组2例(66.7%),两组比较具有统计学差异(P<0.05)。
4 研究组患者在院期间未发现引流管相关并发症(如穿刺点红肿、感染、神经根性疼痛、引流管断裂等)。
讨 论
垂体腺瘤是中枢神经系统最常见的良性肿瘤之一,对于有手术指征的病例,手术方法主要包括经颅手术和经蝶手术两种。近年来随着神经内镜技术发展,越来越多的神经外科医师均认为神经内镜经鼻蝶手术方式,是目前治疗垂体瘤最安全和有效的手术方式[1]。在神经内镜手术的优越性上,国内外神经外科医生的意见是一致的[2-3],即良好充分的近距离照明、全景视野和成角视野、通过自然腔道入路、创伤小、并发症少、住院时间短、费用低等诸多优点,且相对开颅手术来说,对于脑组织基本无牵拉,患者术后反应轻微。国内神经外科医生马箭等通过临床研究认为:神经内镜经鼻蝶入路切除垂体瘤手术风险小,疗效明显优于传统开颅手术[4]。传统观念认为,术中全切肿瘤是所有外科医生的惟一目标,但由于垂体腺瘤生长方式的多样化,尤其是瘤体侵袭海绵窦包绕颈内动脉海绵窦段、侵及第三脑室或侧脑室、侵及前额底等,使得这种手术方式仍存在许多瑕疵,如仍有部分垂体腺瘤不能全切,抑或强行全切后并发症增加等棘手问题,尤其是针对一些直径大于3 cm的巨大垂体腺瘤,马康孝等认为此类垂体瘤术后并发症发生率明显提高,如脑脊液漏、颅内感染、下丘脑损伤等,且瘤体越大,手术疗效越差[5],且术后常需要根据肿瘤残留情况选择二次开颅手术或辅助行立体定向放射治疗及化疗[6]。尽管在有条件的大型医疗机构,术中核磁共振可提高垂体腺瘤的全切率,降低肿瘤残留[7],但因其设备昂贵,限制了其在医疗机构中广泛的应用。在充分掌握鞍区解剖的前提下,只有通过不断学习及手术量的不断积累,才能总结出更加优化的手术策略,提高肿瘤全切率、降低并发症发生率[8-9]。
Michael等利用术中腰穿的方式,降低颅内压,达到利于垂体瘤术中操作,提高肿瘤全切率的目的[10]。国外学者如Christopher等提出了垂体腺瘤术中分步切除方法,即首先切除前下方和后下方的肿瘤,在向两侧切除,直至暴露海绵窦侧壁和下方的鞍背,然后再切除后上方肿瘤,对于向鞍上生长的肿瘤,在切除鞍内肿瘤后,鞍上肿瘤会逐渐落入鞍内,即可全切[11],但是在实践中还是不能控制瘤体过早下陷入鞍内,影响手术操作,稍有不慎,即可导致鞍膈蛛网膜破裂、脑脊液涌出。 Mehta等在2012年创新性地利用术中腰大池置管引流来减少垂体瘤术中脑脊液漏的发生[12]。该团队对44例垂体大腺瘤患者术前进行腰大池置管,并在术中肿瘤暴露和切除过程中根据需要进行脑脊液引流,以10 ml为起始,增量根据鞍隔上移程度决定,一般为10~20 ml,如此间断释放,利于肿瘤切除。观察术中、术后脑脊液漏的情况,并与114例未进行腰大池的手术病例进行对比,结果发现引流降低了术中脑脊液漏的发生率,且该措施降低了术中因脑脊液漏而进行严密修补的必要,同时也没有观察到严重的并发症。崔健等报道了在经颅及经蝶垂体瘤切除术中进行腰大池置管引流可降低颅内压,增加术区视野暴露,同时用于术后引流血性脑脊液,最终降低蛛网膜粘连和脑积水的发生[13]。
本研究的思路来自于上述文献的启发,并结合临床工作实践提出,即在切除垂体大腺瘤手术过程中,鞍膈蛛网膜往往会过早的疝入鞍内,遮挡术者手术视野,缩小术者操作空间,导致鞍内部分区域肿瘤不能探及,影响瘤体完全切除。我治疗组尝试在术前放置腰大池,切除肿瘤时只要发现鞍隔,随即打开引流管持续引流脑脊液,随着颅内压的降低,可以明显地发现鞍隔蛛网膜逐渐松弛、上移,由于鞍隔松弛,鞍膈张力随之降低,肿瘤剥离变得容易(稍硬的肿瘤我们进行假包膜剥离),大大减低了鞍膈蛛网膜破裂的风险,随着上方肿瘤进一步的切除,鞍膈也会完全暴露。这时再持续释放脑脊液,待鞍膈完全上移,使两侧和后上方肿瘤显露,便有足够的视野和空间来切除残余的肿瘤,从而提高了肿瘤的全切率。除了可以利用腰大池引流增加神经内镜经鼻蝶垂体瘤手术中瘤体的暴露,本治疗组在术中还常采用脑棉片将鞍膈向前上方推挤的方式来取得更好的暴露,二者在神经内镜经鼻蝶垂体瘤手术中相互配合,常能起到互补的作用。本研究中,研究组在术中脑脊液漏的发生率,较对照组有明显降低,且结论具有统计学差异,这与Mehta等[12]的研究结论一致。研究组在术后脑脊液漏的发生率,较对照组有明显降低,且结论也具有统计学差异,分析原因可能为:鞍膈的完整性在经鼻蝶垂体瘤手术中起到重要的屏障作用,两组患者术中脑脊液漏发生率有差别,在术毕进行严密的个体化修补后,术中脑脊液漏发生率偏高的,术后鞍底重建组织的在颅内脑脊液搏动性冲击下,愈合的难度增加,术后发生脑脊液漏的可能性也就增加了,即如果术中出现脑脊液漏,即便术毕进行严密的鞍底重建,术后并发脑脊液漏的可能性,仍较术中未出现脑脊液漏者偏高。国外学者Patrick Schuss在经蝶垂体瘤手术后两种不同修补方法对于术后脑脊液漏发生率的影响研究中,也发现术中脑脊液漏的病例,相对于术中未出现脑脊液漏的,术后更容易出现脑脊液漏[14]。
本研究的创新点在于将术前腰大池引流运用到神经内镜经鼻蝶垂体大腺瘤手术中,并通过研究发现了术中脑脊液引流可以提高肿瘤全切率,可降低术中脑脊液漏发生率,并且可降低术后脑脊液漏的发生率。存在的不足主要有:①根据手术需要引流脑脊液时,要达到手术要求所需引流的脑脊液量不定。所需要的时间也不定。本研究中引流脑脊液花费的时间在10~60min,无形中增加了手术及麻醉时间,间接增加了患者的经济负担及手术风险。②本研究样本量偏小,并且神经内镜经鼻蝶垂体瘤术后并发症发生率低,在分析两组手术中及术后脑脊液漏发生率时,因发生例数较少,可能存在一定偏倚。
本研究结果表明:术前腰大池置管,术中脑脊液外引流是安全有效的治疗方法,可以预防术中鞍膈蛛网膜过早向下突入鞍内影响手术操作,有利于术中肿瘤显露,扩大了手术操作空间,提高了肿瘤全切率,与此同时,术前腰大池置管引流,可以降低术中脑脊液漏的发生率,进而降低术后脑脊液漏的发生率,此外,研究组患者在院期间未发现引流管相关并发症,安全性高。该方法可以考虑用于常规神经内镜经鼻蝶切除垂体大腺瘤手术中。
[1] Ali E, Engin C. Using an autologous fibrin sealant in the prenventing of cerebrospinal fluid leak with large skull base defect following endoscopic endonasal transsphenoial surgery [J]. Turkish Neurosurgery,2013, (23):736-741.
[2] Paolo C, Luigi M C,etal. Endoscopic endonasal surgery for pituitary adenomas[J] .World Neurosurg,2014,(82):s3-s11.
[3] 周腾渊,陈来照.垂体腺瘤的诊疗现状及进展[J].中华临床医师杂志:电子版,2016,10(8):1191-1194.
[4] 马 箭,郭闻师.全麻神经内镜引导经鼻蝶入路切除术治疗垂体瘤的临床效果[J].陕西医学杂志,2016, 45(1):35-36.
[5] 马康孝,伏亚红.经单鼻孔蝶窦入路垂体瘤切除术的并发症及相关因素分析[J].陕西医学杂志,2015,44(10):1321-1322.
[6] 管修东,赵 敏.侵袭性垂体腺瘤的手术治疗策略[J]. 中华神经外科杂志,2016 ,11(11):1099-1033.
[7] Fomekong E, Duprez T. Intraoperative 3T MRI for pituitary macroadenoma resection: Initial experience in 73 consecutive patients[J]. Clin Neurol Neurosurg, 2014 (126):143-149.
[8] 王宏利,鲍 刚.经鼻蝶垂体瘤切除术后常见并发症原因分析[J].陕西医学杂志,2013,42 (9):1161-1162.
[9] Veejay B, Saurabh S. Surgery for pituitary tumours[J]. Endocrine Surgery,2017,(10):556-562.
[10] Michael P, Stafford L, Edward R,etal. Management of pituitary tumors-the clinician’s practical guide[M]. Humana Press, 2005:567-569.
[11] Christoph H, Vijay K,Anand H,etal. Endoscopic transsphenoidal pituitary surgery [J].Operative Techniques in Otolaryngology, 2011,(22):206-214.
[12] Mehta GU, Oldfield EH. Prevention of intraoperative cerebrospinal fluid leaks by lumbar cerebrospinal fluid drainage during surgery for pituitary macroadenomas [J]. J Neurosurg,2012 ,(6):1299-1303.
[13] 崔 健,杭 军.腰大池引流在垂体切除术的疗效分析[J].中国临床研究,2012,(25):771-772.
[14] Patrick S, Alexis H.Transsphenoidal pituitary surgery: comparison of two sellar reconstruction techniques and their effect on postoperative cerebrospinal fluid leakage[J]. Neurosurgical Review,2018,(1):110-116.

