胞内冰形成机理研究进展
宝林
(上海理工大学生物系统热科学研究所 上海 200093)
生物样本库的建立和细胞药物的兴起对生物样本的低温保存质量提出了更高的要求。如何有效保存各类生物样本,提高保存质量是目前亟待解决的问题。细胞是生物样本最小的结构单元,也是低温保存生物样本的基本单位。生物样本的低温保存主要有两种方式,低温冻存和玻璃化保存[1]。玻璃化保存是最理想的细胞低温保存方式,由于没有冰晶的形成和冰晶形成带来的未冻组分的溶液质量摩尔浓度上升,理论上认为不会造成细胞损伤[2],但实现玻璃化往往要求高质量摩尔浓度的低温保护剂或极快的降温速率,而高质量摩尔浓度的低温保护剂会对细胞产生毒性,超快的降温速率也意味着更高的设备要求及成本,面对大体积样本,受制于传热的问题, 要实现样本各部分的超快速降温非常困难[3]。在实验或医学中常用的是低温冻存,其设备要求更低,但是在冻存过程中,水分子结晶引起的一系列变化会造成细胞的损伤。Liu Baolin等[4]研究了低温冻存过程中冰晶对黏附成骨细胞的损伤机制,发现冰晶的生长会直接使细胞产生形变,相比于分散的细胞,黏附在载体上的细胞损伤更严重。郝保同等[5]发现冰晶生长方向的不同对黏附成骨细胞的损伤也不同,当冰晶生长的方向与黏附成骨细胞中轴线的夹角为0°~30°时,细胞的存活率最高。梁玮等[6]在基因层面上研究了低温保存对人肝癌细胞Hep-G2的影响,发现低温保存会影响细胞内凋亡基因的表达。所以提高生物样本的低温冻存质量,必须了解细胞在低温冻存过程中受损伤的原因。如图1所示,细胞在冻存过程中受到的最主要的损伤有两种[7]:溶质损伤和胞内冰损伤。溶质损伤是指在降温速率较慢的情况下,细胞外部生成冰晶使胞外溶液质量摩尔浓度上升,细胞内外的渗透压差异使细胞内部的水分扩散至胞外,使细胞内的细胞器以及其他内容物在较长时间内处于高渗的溶液中而造成的损伤。胞内冰损伤是指在降温速率较快时,细胞内的水分来不及渗出而在细胞内部形成冰晶,细胞内冰晶的形成对细胞结构产生破坏从而产生机械损伤[8]。
胞内冰的形成往往意味着细胞的死亡。在生物样本的低温保存过程中需要抑制胞内冰的形成,而在低温外科手术过程中要利用胞内冰有效杀死肿瘤细胞,因此了解胞内冰的形成机理至关重要。胞内冰形成的关键在于细胞膜,细胞膜被认为是阻止冰晶生长的天然屏障[9],关于胞内冰的形成机理围绕细胞膜分为两种观点,一种以P. Mazur等[10-11]为代表,认为胞内冰的形成破坏了细胞膜结构,胞内冰是细胞膜被破坏的原因;另一种以K. Muldrew等[9]为代表持相反意见,认为胞内冰是细胞膜被破坏的结果,在低温冻存过程中,由于胞外冰的生成造成细胞膜损伤,失去对冰晶的屏蔽作用,导致胞内冰的形成。但是关于胞内冰形成的假说至今没有直接的实验证据。本文在分析前人研究成果的基础上,综合现有实验结果,分析上述假说的合理性以及存在的问题。
1 降温过程的胞内冰
1.1 冰晶生长理论
冰晶的生长过程实际是水分子在晶核表面形成氢键并有序排列的过程,水分子结晶包括两个过程[12]:晶核的形成和冰晶的生长。晶核存在一个临界尺寸,晶核大于临界尺寸时冰晶才能进一步生长,晶核小于临界尺寸时则融化。晶核的大小和体系的过冷度相关[13],过冷度越大,晶核小而多,形成密集的小冰晶;过冷度小时,晶核大而少,形成大冰晶。对于低温保存而言,大冰晶意味着更大的机械损伤,小而密的冰晶保存效果更理想。对于低温外科手术而言,大冰晶的形成具有更大的杀伤力。在实际冰晶生长过程中存在匀相成核和异相成核两种情况:匀相成核是指整个体系中的冰晶成核概率一致,成核均匀地发生在体系中;异相成核是指体系中存在杂质,可以作为冰晶生长的晶核使水分子在表面结晶,实际水结晶过程大多数为非匀相成核。
低温保存过程中形成冰晶需要3个要素:1)足够高的自由水分子摩尔浓度;2)足够长的冰晶生长时间;3)足够低的成键温度。自由移动的水分子能够参与冰晶的生长,结合态的水分子不能参与冰晶的形成。足够高的自由水分子摩尔浓度保证水分子之间有足够大的有效碰撞几率来形成氢键,亲水性的低温保护剂能抑制冰晶生长的原因之一是分子中含有很多亲水性基团,能够与溶液体系中的自由水分子形成氢键,减少体系中的自由水分子摩尔浓度[14],减少或者抑制冰晶的生长。在玻璃化过程中使用高质量摩尔浓度的低温保护剂使体系中的自由水含量大大减少,极大地降低了冰晶的生成几率。冰晶的生长需要足够长的时间。在低温保存过程中随着温度的降低,水分子移动变缓,如果降温速率足够快,使冰晶没有足够的时间进行生长,玻璃化保存中的超高降温速率使水分子移动变得十分缓慢,且低的自由水含量使冰晶难以形成,形成了无冰晶的固体玻璃态。足够低的成键温度使氢键有效形成而不被破坏,维持冰晶不融化。
1.2 影响胞内冰形成的因素
P. Mazur[10]认为影响胞内冰形成的因素主要是降温速率、细胞对水的渗透率、胞外冰和细胞外悬浮介质等。体积小且渗透水能力高的细胞需要更高的降温速率才能生成胞内冰,如红细胞需要超过5 000 ℃/min的降温速率才能形成胞内冰,而体积更大且水渗透能力更低的酵母细胞则只要10 ℃/min的降温速率就能形成胞内冰[15]。
在降温过程中,细胞外的溶液先降温到溶液的凝固点以下,实验表明胞外冰的产生先于胞内冰[16],通过DSC测量整个胞内冰的形成过程,结果显示整个降温过程中出现两个放热事件,大的放热峰表示胞外冰的形成,小的放热峰表示胞内冰的产生,大放热事件总是先于小放热事件说明胞外冰的形成总是先于胞内冰。胞外冰的形成是细胞在降温过程中形成胞内冰的前提条件。
Huang H.等[3]研究海藻酸盐水凝胶对于细胞的保护作用时发现,当胶囊外部的溶液产生冰晶时会引起胞内冰,但是将胶囊外部替换成无法产生冰晶的矿物油,可以完全抑制胞内冰的产生。这和实际的细胞低温保存存在差异:1)细胞低温保存过程中细胞膜是直接接触到保护剂溶液,而在胶囊中与细胞直接接触的是水凝胶;2)当胶囊外部的液体由保护剂溶液替换成油时,不仅改变了胞外冰,也改变了胞外液体的导热率,需要进行进一步实验验证,如找到和低温保护剂相同热物性参数的油来减少变量。1970年,有学者通过研究DNA、可溶胶原蛋白、胰岛素及胶原酶等的水溶液在过冷下的成核能力,表明胞内生物大分子不能作为形成胞内冰的晶核[15]。M. Toner等[11]也观察到猪卵母细胞降温至-20 ℃时,在没有胞外冰的情况下,胞内冰也没有产生,直到-20 ℃以下胞内冰与胞外冰才同时产生。
胞外冰的形成总是先于胞内冰,但胞外冰如何引起胞内冰还未得到实验验证,因为胞内冰形成时间非常短,在人工置核的条件下,胞内冰的发生只有1.6 ms[17]。受制于有限的观测手段,现有实验都是间接的理论验证。此外,细胞外悬浮介质也能影响胞内冰的形成,胞内冰的生成温度与低温保护剂的质量摩尔浓度成正比,增加低温保护剂的质量摩尔浓度能很大程度上提高细胞的过冷度,抑制胞内冰的发生[17]。
1.3 孔理论
以P. Mazur[10]为代表的学者认为胞内冰晶生长的晶核直接来自于细胞外部的冰晶,胞外冰可以通过细胞膜上的微孔进入细胞,为胞内冰晶的生长提供晶核,胞外冰是胞内冰形成的必需条件。1960年,P. Mazur[10]以酵母、巴氏杆菌和黄曲霉孢子为研究材料,在确定低温本身对细胞无害的基础上,发现降温过程中存在一个使细胞存活率显著下降的较小的温度区间,且该区间为发生相变的区间,对细胞的伤害是瞬时的。
P. Mazur[10]综合实验结果认为胞内冰的具体生长过程为:细胞悬液在降温过程中随着温度降至0 ℃以下,细胞内外都没有冰晶形成,细胞内外的水分保持过冷状态,此时细胞没有受到损伤,实验表明:冰晶一旦生成,细胞的存活率会急剧下降,说明相比于体系能量的降低,水分的相变更为致命。如图2所示,随着温度的继续下降,细胞外介质开始结冰,当体系的温度足够低,降温速率足够快时,冰晶才能通过细胞膜上的小孔进入胞内引起胞内水分的结晶。P. Mazur[10]假设冰晶若要通过细胞膜上的小孔,其尖端必须有足够小的曲率半径,而提高降温速率或升高过冷度能够增大冰晶形成的驱动力,减小冰晶生长前端的曲率半径,同时提高降温速率也使细胞内的水分来不及运输到胞外。
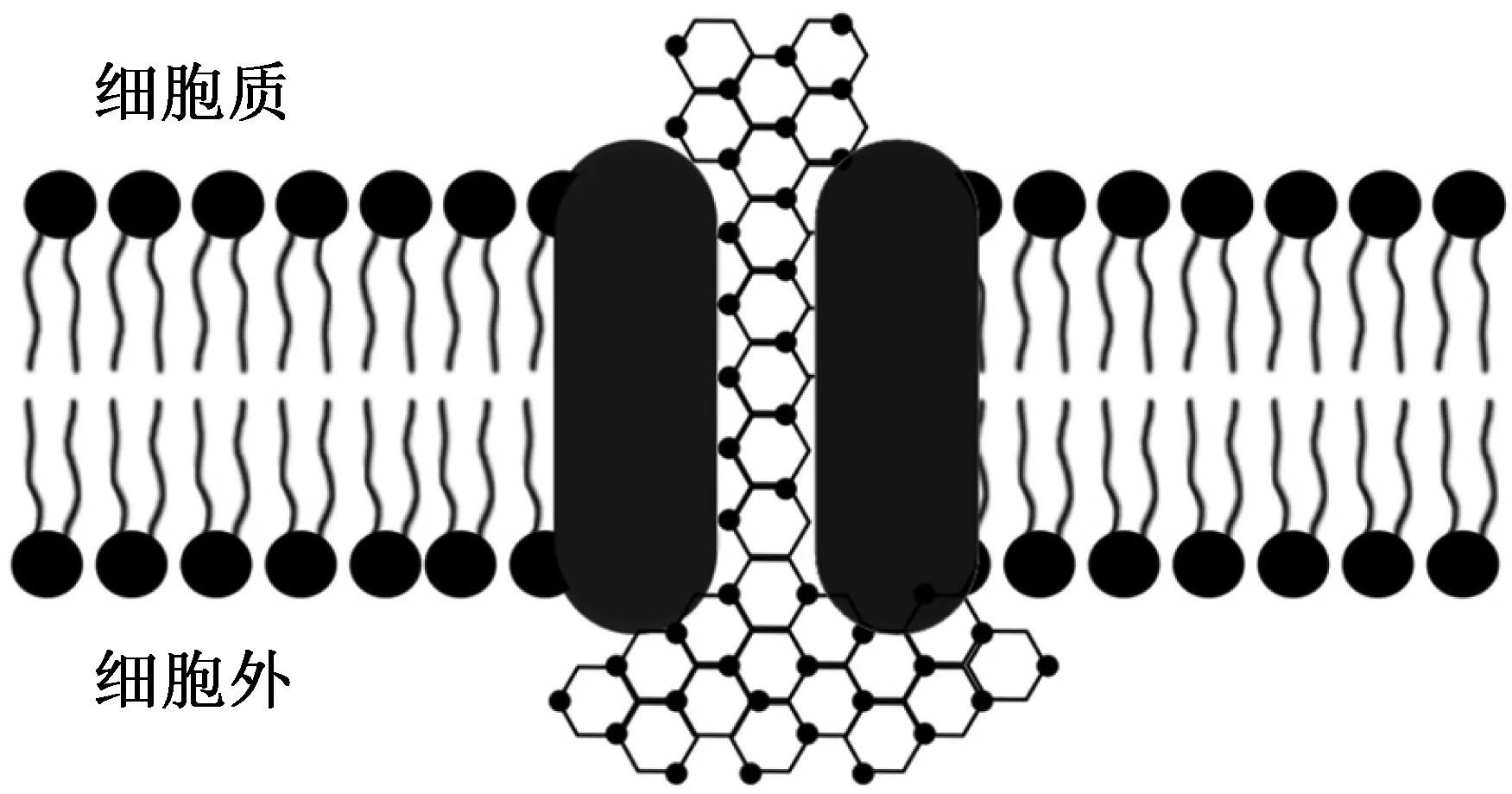
图2 冰晶通过细胞膜微孔进入细胞内部Fig.2 Ice crystals enter the cell through the cell membrane pore
P. Mazur[18]1965年给出了胞内冰形成温度和细胞膜小孔孔径的数学关系式:
(1)
(2)
式中:ΔT为水在膜孔内的凝固点与水在冰水平面界面上的凝固点Tf之间的差值,℃;v1为水的摩尔体积,m3;σsl为冰水界面自由能,10-7J/cm2;a为膜孔半径,10-10m;Lf为冰融化的摩尔热,J;θ为冰晶前端与孔壁的接触角;σsc为冰晶和孔壁的界面自由能,10-7J/cm2;σlc为水和孔壁的界面自由能,10-7J/cm2。其中,σsl≈2×10-6J/cm2,带入其他已知变量可得:
(3)
假设冰晶与孔壁之间的接触角θ=0°,则cosθ=1,当a=3×10-9m时,ΔT=10 ℃,符合对应的实验证据;当假设接触角θ=80°,a=5×10-10m,ΔT=10 ℃。方程显示对于指定大小的膜孔,水在膜孔内的凝固点与水在冰水平面界面上的凝固点之间存在一个固定的温度差值,决定了胞内冰能否通过该孔道生长。1996年W. K. Berger等[19]研究了冰晶在唾液腺组织细胞之间的传播,结果显示该传播过程和温度有很大相关性,在固定温度以上观察不到冰晶在细胞间的传播。该结果支持了冰晶可以通过孔道进行传播。2001年J. P. Acker等[20]在P. Mazur[18]基础上改进了孔理论模型。该模型考虑了实际细胞低温保存过程中,胞外是水溶液而不是纯水,公式为:
(4)
修正后的公式显示,在相同接触角下,相同的膜孔径,修正后的ΔT更大,原因是相比于纯水,水溶液的凝固点会有所下降,使生成胞内冰的温度更低,过冷度更大。
1.4 体积催化成核理论和表面诱发成核理论
M. Toner等[11]在1991年提出了体积催化成核理论和表面诱发成核理论。观察了小鼠卵母细胞在120 ℃/min降温速率下的胞内冰形成情况,随着温度的降低,胞内冰的形成概率逐渐增加,且随着溶液渗透压的增加,胞内冰的形成温度也不断降低,当渗透压升至735 mOsm/kg之后,胞内冰的形成曲线发生变化,当温度达到-31 ℃时,曲线的斜率陡然增加,以-31 ℃为界线,温度变化对胞内冰的形成有不同影响,表明在-31 ℃上下有两种不同的胞内冰形成机制。假设温度高于-31 ℃时,形成的胞内冰是由胞外冰催化形成的,胞内冰形成的温度较高;温度低于-31 ℃时,形成的胞内冰的晶核来自细胞内部,需要的温度更低,可能是细胞内的物质或细胞结构作为晶核异相成核,或者是细胞内部的过冷水匀相成核,细胞内部成核使在极短的温度区间内胞内冰的形成概率达到100%。
M. Toner等[11]还观察到存在两种不同类型的胞内冰,在没有加入保护剂的情况下,前者发生的温度较高,高于-17 ℃,表现为细胞在光学显微镜下变黑;后者的形成温度低于-24 ℃,表现为细胞照片的灰度没有变化,在静止的照片上无法区分,但在运动的影像上很容易区分,在两种类型的胞内冰中间存在一个温度区间-24~-17 ℃,在该区间内两种类型的胞内冰同时存在。中间过渡区域不涉及以-31 ℃为分界点的胞内冰生成机制的转变。出现该现象的原因可能是细胞的内冰晶分支的大小不同,取决于细胞质的过冷程度。但M. W. Scheiwe等[21]通过研究人粒细胞,认为变黑类型的胞内冰是异相成核的结果,由胞外冰引发;灰度不变的胞内冰是胞内颗粒异相成核的结果。
M. Toner等[22]认为胞内冰晶生长存在两种机制,如图3所示,在-31 ℃以上为表面诱发成核。胞外冰晶的形成会产生一些影响细胞膜的因素,如化学、电、机械、离子或热量等,而细胞膜受影响后产生的变化会间接地促使胞内冰在细胞膜内表面上形成,此过程从胞外到胞内没有传质过程。

图3 SCN理论Fig.3 SCN theory
如图4所示,在-31 ℃以下为体积催化成核,晶核来自细胞内部,可能是细胞内部存在的一些结构或生物大分子引发的胞内异相成核,或是胞内水分子的匀相成核。

图4 VCN理论Fig.4 VCN theory
M. Toner等[22]给出两种理论的数学模型:
(5)
式中:PIF为胞内冰的生成概率;B=(-∂T/∂t);As为发生成核的细胞膜区域。
(6)
式中:Ωhet和Khet分别为冰晶成核的动力学和热力学参数。
(7)
(8)

(9)
式中:θ为胞内冰晶形成时和细胞膜的接触角,取决于溶液和细胞膜基质、冰相和细胞膜基质及冰水界面三者之间的界面能。对于在渗透压为285 mOsm/kg,降温速率为120 ℃/min的小鼠卵母细胞的SCN模型,Ω0SCN=3.56×108(m25s)-1,K0SCN=4.60×109K5,接触角为35°,结果显示胞内冰形成温度区间在-10 ℃左右。对于在渗透压为1035 mOsm/kg,降温速率为120 ℃/min的小鼠卵母细胞的VCN模型,Ω0VCN=1.84×1050(m25s)-1,K0VCN=1.08×1012K5,对应的胞内冰生成温度在-31 ℃左右。模型拟合数据与实验数据相符。
M. Toner等[22]的胞内冰形成模型被运用在多种细胞保存的理论研究当中。张绍志等[23]利用M. Toner等[22]的胞内冰形成模型研究了脐带血干细胞的冻存特性,降温速率为30 ℃/min,并且采用人工置核引发胞外冰,发现脐带血干细胞在没有添加低温保护剂的情况下,细胞处于0.09%的等渗溶液中时,降温过程中胞内冰的生成温度为-13~-4 ℃,认为是细胞膜内表面催化引起的胞内冰,根据实验拟合得到的Ω0SCN=1.31×109(m25s)-1,K0SCN=2.22×108K5。当加入10%的二甲基亚砜作为低温保护剂时,胞内冰的生成温度为-38~-27 ℃,认为这是细胞内部组分异相成核VCN引起的。刘宝林等[24]对小鼠成骨细胞的胞内冰形成情况进行了研究,降温速率为400 ℃/min,胞内冰生成温度为-20~-4 ℃,并且在-10 ℃时包内冰发生的概率显著增大。易静如等[25]观察了子宫颈癌细胞在45 ℃/min和60 ℃/min降温速率下的胞内冰成核情况,利用SCN模型拟合得到了相关的动力学和热力学参数。
M. Toner等[22]的理论模型被用在多种细胞的低温保存过程中,验证了正确性,但还缺乏直接实验证据。在SCN理论中细胞膜是如何引发胞内异相成核的仍是未知,猜想的化学、电、机械、离子或热量等因素还需要逐项研究;在VCN理论中细胞内部是如何成核的,关于细胞内部是否存在有效的成核介质需要进一步研究,如果是细胞内匀相成核,那么需要的条件更为苛刻。只有理想状态下的纯水才能形成匀相成核[9],在细胞内部一个多组分的溶液体系里实现匀相成核的机机制也需要探讨。
1.5 膜受损理论
1990年K. Muldrew等[9]以小鼠成纤细胞为研究材料,得出膜受损理论。研究发现胞内冰的形成温度和降温速率无关,而与保护剂的质量摩尔浓度相关,结果显示小鼠成纤维细胞在降温速率50~200 ℃/min的温度区间内时,改变降温速率对胞内冰的形成温度没有显著性差异,根据P. Mazur[10]的孔理论,形成胞内冰需要足够快的降温速率使冰晶能通过细胞膜上的通道生长,而实验结果显示胞内冰形成和降温速率无关,因而不支持孔理论。此外,K. Muldrew等[9]发现随着溶液质量摩尔浓度的升高,形成胞内冰所需的冰水界面移动速率在降低。冰水界面的电势随着溶液质量摩尔浓度的升高而降低,随着冰水界面移动速率的加快而上升,理论上提高溶液的质量摩尔浓度,需要更高的冰水界面移动速率以达到破坏细胞膜的对应的电势。因此,K. Muldrew等[9]否定胞外冰形成移动时的冰水界面的电势造成细胞膜损伤从而引发胞内冰的理论,还发现胞内冰的形成温度随着过冷度的增加而降低,否定了存在一个关键的过冷度点决定胞内冰产生的理论。
K. Muldrew等[9]在否定已有的假说的基础上,提出细胞在降温过程中会在细胞膜两侧形成一个渗透梯度,且该梯度存在一个临界值,同时低温会造成细胞膜结构的变化,在低温下细胞膜流动性变差,变得更脆,这两个因素综合造成了细胞膜的损伤,细胞膜损伤之后,失去了对冰晶的屏障作用由此而形成胞内冰。他们选取整个体系中50%的细胞损伤时对应的细胞膜两侧渗透梯度为观察对象,发现随着胞内冰成核温度的降低,细胞膜两侧的渗透梯度逐渐降低,且呈线性关系。根据该线性关系得出:在0 ℃时,由于低温造成50%的细胞损伤率对应的细胞膜渗透梯度为9.11 MPa;将细胞直接置于0 ℃的溶液中,逐渐提高渗透压,对应的50%细胞损伤时的渗透梯度为9.15 MPa,与前者相近,因此认为细胞在低温保存过程中的损伤是由细胞膜两侧的渗透梯度造成的,胞内冰是细胞膜损伤的结果。此观点与一般材料的抗张强度均为温度的函数的解释一致。他们还假设膜的损坏不一定与渗透压本身有关,而与水分的运输速率有关。
K. Muldrew等[9]通过实验结合线性拟合研究胞内冰的方法很有借鉴意义,能有效找出影响胞内冰的因素,但实验设置还存在一些问题,在质疑孔理论时,采用的降温速率区间过高,没有覆盖低降温速率区间,从而错过了在低降温速率区间细胞膜的屏障作用,而这点是支持P. Mazur[10]的孔理论的。
2 胞内冰的实验观察
观察胞内冰晶的形成需要特殊的设备及方法,常用的仪器是低温显微镜,电子显微镜及共聚焦显微镜。在显微镜的基础上衍生出一系列观察方法[26]:1)“闪光法”,胞内冰晶的散射会使整个细胞内部变黑,借以判断胞内冰的形成;2)荧光法,利用荧光染料SYTO13TM对细胞内部的DNA以及RNA进行染色,胞内冰的生成会损坏细胞核以及胞质内的核酸,使细胞呈现一种蜂巢状的荧光图案;3)差示扫描量热法,冰晶的形成会释放结晶潜热,根据降温过程中的热量变化侧面反映胞内冰的生成情况。
2005年P. Mazur等[27]观察了非洲爪蛙和小鼠的卵母细胞在降温过程中的冰晶生长情况。他们指出,按照K. Muldrew等[9]的膜受损理论,在足够快的降温速率下,细胞内的水分运输是温度的函数而不受保护剂的质量摩尔浓度和种类的影响,但实验发现胞内冰的生成温度与保护剂的质量摩尔浓度和种类有很大关系,因此不支持K. Muldrew等[9]的膜受损理论。实验进一步支持胞内冰是由胞外冰引起的,结合实验结果,P. Mazur等[27]认为由胞外冰引起的细胞膜上孔结构的改变有可能和胞内冰的形成有关。
杨戈尔等[17,28]在细胞内的水生长可能是有方向的基础上,通过高速摄像机直接观察了胞内冰的生长过程。研究表明,在慢速降温过程中,胞内冰是在靠近细胞核的细胞膜内侧开始生长的,逐渐进入细胞核内,最后穿过细胞核,并在细胞核周围停止生长,冰晶并未覆盖整个细胞。这可能是由于细胞膜和核膜表面附近的水分子排列是有规律的[29],而细胞核与细胞膜相距最近的胞质空间区域的水分子的排列相比于细胞的其他部分更为规律,更利于冰晶的生长。而冰晶的生长过程实际上就是水分子的定向排列成键过程。研究指出胞内冰是在细胞膜上发生的,但由于细胞内水分排列的不同而表现出发生位置的特异性。此外,冰晶生长进入细胞核而不是绕过细胞核,他们认为这是由于细胞核内部的水分含量更多造成的,细胞核内部分水分含量更高有两个原因:1)在低温下水分子的扩散更加缓慢;2)核膜的阻挡作用。这两个假设还缺乏具体的实验证明,如何确定在核膜与细胞膜之间的水分子排列更加规律,如何测量细胞核与胞质的水分含量,测量之后如何用实验证明,这些问题都有待商榷。
2016年T. Ninagawa等[30]同样利用高速摄像机观察了天竺葵叶片背面的细胞在没有加入低温保护剂时的胞内冰生成情况,得到较为清晰的胞内冰形成图像,研究发现胞内冰在植物叶片细胞中的形成模式分为3种:1)胞内冰在细胞膜内表面开始形成,然后沿着细胞四周生长;2)胞内冰在细胞膜内表面开始形成,然后向细胞中心生长;3)胞内冰在细胞中间而不是细胞膜内表面形成,然后向四周生长,该模式研究揭示了细胞内存在着有效的晶核。验证了VCN理论的可行性。
3 复温过程的胞内冰
复温过程中的胞内冰是指经过低温冻存或玻璃化保存的细胞在复温过程中经历的细胞内部的冰晶再生长过程。H. Bank[31]研究了低温冻存的酵母细胞在慢速复温下的胞内冰生长情况,结果显示在慢速复温过程中,细胞被复温到-50 ℃保持24 h,细胞内部也只有小冰晶,当细胞被复温到-30 ℃且维持30 min时,胞内出现部分大体积冰晶,当细胞被复温到-20 ℃且只维持5 min时,胞内出现大量大体积冰晶。结合A. P. Maclenzie[32]对酵母细胞在复温过程中细胞存活率的研究表明:复温过程中的胞内冰相比于降温过程中的胞内冰更为致命,胞内冰晶在由小冰晶生长到大冰晶的过程中对细胞造成的损伤更大。目前更倾向于在复温阶段使用快速复温来解冻细胞,使细胞在复温过程中快速通过危险温区,从而避免胞内冰晶再生长对细胞产生的损害。利用交变磁场对磁纳米粒子进行加热[33],此种加热方式快速且均匀,被认为是复温细胞最有效的手段。
4 水通道蛋白与胞内冰
一个生物体或器官由很多不同种类的细胞构成,若想实现整个机体或器官的低温冻存,必须分别对不同类型的细胞进行研究。了解胞内冰在不同细胞内的生成机理并避免在冻结过程中的冰晶损伤对于整个机体或器官的保存至关重要。但由于采用不同的细胞进行研究,导致很多结论难以统一,经典假说的研究过程中采用不同物种的不同细胞进行研究,P. Mazur[10]采用微生物,M. Toner等[11]采用小鼠卵母细胞,K. Muldrew等[9]采用小鼠成纤细胞。尽管不同的细胞有不同的表现,但在整个过程中细胞膜和胞内水分含量是关键。
细胞膜上的水通道蛋白调控着水分的运输,水通道蛋白于1988年被Arge发现并命名为CHIP28,并于1991[34]年被证实参与水分的运输。其形成的通道直径很小,只允许单个水分子通过,比如AQP1水通道蛋白形成的亲水通道直径约为0.28 nm[35]。研究表明水通道蛋白通过其内部特定氨基酸结构使水分子以适当的角度穿过通道到达细胞内部[34],而这种使水分子有序排列的功能可以降低冰晶形成所需的能量使冰晶能在通道内部生长。
无毒水通道蛋白阻断剂是一类可以阻断水通道蛋白的试剂,一般是具有巯基活性的汞复合物被广泛用于水通道蛋白的研究[36]。采用无毒水通道蛋白阻断剂将细胞膜上面的水通道关闭,在低温显微镜和DSC上观察胞内冰的生成情况,通过低温显微镜直接观察胞内冰的形成情况。如果由于水通道蛋白的关闭引起冰晶无法穿过通道,造成胞内溶液过冷度提高,胞内冰形成温度下降,证明水通道蛋白在胞内冰的形成过程中起了很重要的作用。利用DSC研究细胞的冻结过程,前人的研究显示细胞在降温过程中会出现两个放热峰,大的峰是细胞外溶液结晶的放热峰,小的峰是胞内溶液冻结的放热峰,如果水通道被阻断后,胞内冰发生的热事件后移,也表明水通道蛋白是胞外冰进入细胞内部的通道。可通过分子生物学手段,用基因敲除的办法减少水通道蛋白的数量来研究水通道蛋白对胞内冰的影响。此外,可通过相应的模拟软件对实验无法进行的部分进行模拟计算。
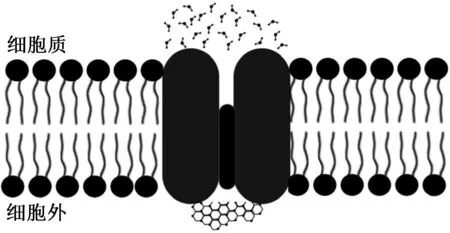
图5 冰晶无法通过关闭后的水通道生长Fig.5 Ice crystals can not grow through the closed water channel
如果胞内冰是由胞外冰通过水通道蛋白进入细胞内引发的,可以通过减少细胞膜表面的水通道蛋白的数量,减少胞内冰的发生概率,但同时降低水通道蛋白也会降低细胞对水分的运输能力,所以在保存细胞前可对细胞进行适当脱水处理使细胞内部水分含量降低,再结合水通道蛋白数量的减少或关闭来抑制胞内冰的形成。此外,组织或器官中不同细胞的水分渗透能力不同,这也是组织或器官难以长期低温保存的原因,通过修饰水通道蛋白使不同类型的细胞具有相同的水分渗透能力也许是解决组织或器官长期保存的有效方法。相反,利用增加水通道蛋白的数量增加胞内冰发生的概率,可用于低温外科手术中以增加治疗效果。
5 结论与展望
本文详细分析了目前关于胞内冰形成的假说,现有假说都有相对应的实验证据,但都是从侧面进行验证,由于采用不同的细胞进行研究,难以得到统一的结论。冰晶要在胞内形成,需要两个条件:有效的晶核和足够的自由水分子数。围绕晶核的来源衍生出的孔理论、SCN理论、VCN理论都能解释对应的实验结果。目前的实验观测到细胞内部存在有效的晶核,说明VCN理论是可行的。关于孔理论和SCN理论,区分这两个假说是研究的关键。对于孔理论存在的问题是:细胞膜上的水通道蛋白能否作为冰晶生长的通道;对于SCN理论存在的问题是:细胞膜内表面如何催化冰晶形成,如何界定细胞膜催化冰晶形成的能力。围绕这些问题需要仔细地设计实验进一步研究。
本文受上海东方学者跟踪计划项目的资助。(The project was supported by the Project Tracing Program of Oriental Scholars.)
[1] HEO Y S, NAGRATH S, MOORE A L, et al. “Universal” vitrification of cells by ultra-fast cooling[J]. Technology, 2015, 3(1):64-71.
[2] MACFARLANE D R. Physical aspects of vitrification in aqueous solutions[J]. Cryobiology, 1987, 24(3):181-195.
[3] HUANG H, CHOI J K, RAO W, et al. Alginate hydrogel microencapsulation inhibits devitrification and enables large-volume low-CPA cell vitrification[J]. Advanced Functional Materials, 2015, 25(44):6939.
[4] LIU Baolin, JOHN M. Freezing osteoblast cells attached to hydroxyapatite discs and glass coverslips: mechanisms of damage[J]. Science in China Series E(Technology Sciences), 2007, 50(2):248-256.
[5] 郝保同, 刘宝林, 林萍, 等. 冰晶对黏附成骨细胞损伤的实验研究[J]. 制冷学报, 2010, 31(1):59-62. (HAO Baotong, LIU Baolin, LIN Ping, et al. Damage of extracellular ice to attached osteoblast cell during cryopreservation[J]. Journal of Refrigeration, 2010, 31(1):59-62.)
[6] 梁玮, 姚岚, 刘宝林. 低温保存对Hep-G2细胞凋亡的影响[J]. 制冷学报, 2017, 38(1):113-118. (LIANG Wei, YAO Lan, LIU Baolin. Effect of cryopreservation on apoptosis in Hep-G2 cells[J]. Journal of Refrigeration, 2017, 38(1):113-118.)
[7] HOFFMANN N E, BISCHOF J C. The cryobiology of cryosurgical injury[J]. Urology, 2002, 60(2):40-49.
[8] MAZUR P, LEIBO S P, CHU E H Y. A two-factor hypothesis of freezing injuryevidence from Chinese hamster tissue culture cells[ J]. Experimentak Cell Research, 1972, 71(2):345-355.
[9] MULDREW K, MCGANN L E. Mechanisms of intracellular ice formation[J]. Biophysical Journal, 1990, 57(3):525-532.
[10] MAZUR P. Physical factors implicated in the death of microorganisms at subzero temperatures[J]. Annals of the New York Academy of Sciences, 1960, 85:610-629.
[11] TONER M, CRAVALHO E G, KAREL M. Thermodynamics and kinetics of intracellular ice formation during freezing of biological cells[J]. Journal of Applied Physics, 1990, 67(3):1582-1593.
[12] 华泽钊, 任禾盛. 低温生物医学技术[M]. 北京:科学出版社,1994:23-25. (HUA Zezhao, REN Hesheng. Technology of cryobiology and medical[M]. Beijing: Science Press, 1994:23-25.)
[13] 陶乐仁, 华泽钊. 低温保护剂溶液结晶过程的显微实验研究[J]. 工程热物理学报, 2001, 22(4):481-484. (TAO Lereng,HUA Zezhao. A microscopic study of the crystallization in cryoprotectent agents[J]. Journal of Engineering Thermophysics, 2001, 22(4):481-484.)
[14] BOUTRON P, MEHL P, KAUFMANN A, et al. Glass-forming tendency and stability of the amorphous state in the aqueous solutions of linear polyalcohols with four carbons: I. Binary systems water-polyalcohol[J].Cryobiology,1986, 23(5): 453-469.
[15] MAZUR P. Cryobiology: the freezing of biological systems[J]. Science, 1970, 168(3934):939-949.
[16] 王雅博, 诸凯, 安娜, 等. 不同降温速率对肾细胞内、外冰形成温度的影响[J]. 低温工程, 2012(3):62-66. (WANG Yabo, ZHU Kai, AN Na, et al. Effect of different cooling rate on ice formation temperature of intra-and-extracellular[J]. Cryogenics, 2012(3):62-66.)
[17] 杨戈尔.低温冷冻过程中胞内冰晶生长机制与应用研究[D]. 上海:上海交通大学, 2011. (YANG Ge′er. Mechanistic study of intracellular ice formation and application[D]. Shanghai: Shanghai Jiao Tong University, 2011.)
[18] MAZUR P. The role of cell membrane in the freezing of yeast and other single cells[J]. Annals of the New York Academy of Sciences, 1965, 125(2):658-676.
[19] BERGER W K, UHRIK B. Freeze-induced shrinkage of individual cells and cell-to-cell propagation of intracellular ice in cell chains from salivary glands[J]. Experientia, 1996, 52(9):843-850.
[20] ACKER J P, ELLIOTT J A,MCGANN L E. Intercellular ice propagation: experimental evidence for ice growth through membrane pores[J]. Biophysical Journal, 2001, 81(3):1389-1397.
[21] SCHEIWE M W, KORBER C. Quantitative cryomicroscopic analysis of intracellular freezing of granulocytes without cryoadditive[J]. Cryobiology, 1987, 24(5):473-483.
[22] TONER M, CRAVALHO E G, KAREL M. Thermodynamics and kinetics of intracellular ice formation during freezing of biological cells[J]. Journal of Applied Physics, 1990, 67(3):1582-1593.
[23] 张绍志, 王葳, 陈光明, 等. 低温显微装置及其对细胞胞内冰晶形成现象的观察[J]. 中国细胞生物学学报, 2003, 25(4):231-234. (ZHANG Shaozhi,WANG Wei,CHEN Guangming, et al. Cryomicroscope and its use in the observation of intracellular ice[J]. Chinese Journal of Cell Biology, 2003, 25(4):231-234.)
[24] 刘宝林,MCGRATH John, 华泽钊. 低温保存过程中老鼠成骨细胞胞内冰的研究[J]. 制冷学报, 2007, 28(1):22-25. (LIU Baolin, MCGRATH John,HUA Zezhao. Intracellular ice formation of mouse obseoblasts during cryopreservation[J]. Journal of Refrigeration, 2007, 28(1):22-25.)
[25] 易静如, 贾异之, 赵刚. HeLa细胞胞内冰成核现象实验研究[J].工程热物理学报, 2015(2):380-382. (YI Jingru, JIA Yizhi, ZHAO Gang. Experimental study on intracellular ice nucleation in HeLa cells[J]. Journal of Engineering, 2015(2):380-382.)
[26] ACKER J P, CROTEAU I M. Pre- and post-thaw assessment of intracellular ice formation[J]. Journal of Microscopy, 2004, 215(Pt 2):131-138.
[27] MAZUR P, SEKI S, PINN I L, et al. Extra- and intracellular ice formation in mouse oocytes[J]. Cryobiology, 2005, 51(1):29-53.
[28] BISCHOF J C, RUBINSKY B. Large ice crystals in the nucleus of rapidly frozen liver cells[J]. Cryobiology, 1993, 30(6):597-603.
[29] CHENG J X, PAUTOT S, WEITZ D A, et al. Ordering of water molecules between phospholipid bilayers visualized by coherent anti-stokes raman scattering microscopy[J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(17):9826-9830.
[30] NINAGAWA T, EGUCHI A, KAWAMURA Y, et al. A study on ice crystal formation behavior at intracellular freezing of plant cells using a high-speed camera[J]. Cryobiology, 2016, 73(1):20-29.
[31] BANK H. Visualization of freezing damage. II. Structural alterations during warming[J]. Cryobiology, 1973, 10(2):157-170.
[32] MACKENZIE A P. Death of frozen yeast in the course of slow warming[J]. Cryobiology, 1973, 10:157-170.
[33] 王建业. Fe3O4纳米颗粒对细胞低温保存过程传递现象的影响及其应用[D]. 合肥:中国科学技术大学, 2015. (WANG Jianye. Effect of Fe3O4nanoparticles on biotransport and its application in cryopreservation[D]. Hefei: University of Science and Technology of China, 2015.)
[34] AGRE P, PRESTON G M, SMITH B L, et al. Aquaporin CHIP: the archetypal molecular water channel[J]. American Journal of Physiology, 1993, 265(2):463-476.
[35] 王晶, 桑建利. 水通道蛋白的基本结构与特异性通透机理[J]. 生物学通报, 2011, 46(2):19-22. (WANG Jing, SANG Jianli. The basic structure and specific permeability mechanism of aquaporins[J]. Bulletin of Biology, 2011, 46(2):19-22.)
[36] KOSINSKA E U, FISCHER G, FRIEMANN R, et al. Subangstrom resolution X-ray structure details aquaporin-water interactions[J]. Science, 2013, 340(6138):1346-1349.
[37] HASEGAWA H, MA T, SKACH W, et al. Molecular cloning of a mercurial-insensitive water channel expressed in selected water-transporting tissues[J]. Journal of Biological Chemistry, 1994, 269(8):5497-5500.
[38] SEKI S, MAZUR P. Kinetics and activation energy of recrystallization of intracellular ice in mouse oocytes subjected to interrupted rapid cooling[J]. Cryobiology, 2008, 56(3):171-180.
[39] MAZUR P, KOSHIMOTO C. Is intracellular ice formation the cause of death of mouse sperm frozen at high cooling rates[J]. Biology of Reproduction, 2002, 66(5):1485-1490.
[40] MAZUR P, COLE K W. Influence of cell concentration on the contribution of unfrozen fraction and salt concentration to the survival of slowly frozen human erythrocytes[J]. Cryobiology, 1985, 22(6):509-536.
[41] PEGG D E. The relevance of ice crystal formation for the cryopreservation of tissues and organs[J]. Cryobiology, 2010, 60(Suppl. 3):36-44.
[42] ACKER J P, MCGANN L E. Membrane damage occurs during the formation of intracellular ice[J]. Cryo Letters, 2001, 22(4):241-254.
[43] MORRIS G J. Rapidly cooled human sperm: no evidence of intracellular ice formation[J]. Cryobiology, 2006, 53(3):2075-2083.

