甲氧氯普胺联合氟哌啶醇改善癌性恶心呕吐及乏力的临床研究
李 玲,马桂霞,司壮丽,王 鹏,袁慧丽,高天慧,马 望,王 炜
1. 郑州市第九人民医院姑息缓和治疗暨安宁疗护中心,河南 郑州 450053;
2. 郑州市第一人民医院妇科,河南 郑州 450000;
3. 郑州大学护理学院基础教研室,河南 郑州 450052;
4. 河南省人民医院肿瘤内科,河南 郑州 450003;
5.郑州大学第一附属医院肿瘤内科,河南 郑州 450052
恶心、呕吐及乏力是晚期癌症患者的常见症状。有研究显示,30%~60%的晚期癌症患者会出现恶心呕吐,超过75%的晚期癌症患者持续存在乏力[1-2]。癌性恶心呕吐(cancer-related nausea and vomiting,CRNV)是指与癌症及其治疗与非治疗因素相关的恶心呕吐,常见于多发转移的晚期癌症患者,其复杂性、病程及处理措施均不同于化疗所致的恶心呕吐(chemotherapyinduced nausea and vomiting,CINV)[3]。癌性恶心呕吐及乏力可使晚期癌症患者机体功能进一步受损,出现明显的焦虑或恐惧以及多种并发症如脱水、营养不良及代谢失衡等,严重影响患者的生活质量,甚至导致患者死亡。目前美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)、美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)及多国癌症支持治疗学会(Multinational Association of Supportive Care in Cancer,MASCC)等临床止吐指南已明确给出CINV的有效控制措施[4-5],但对晚期癌症患者CRNV的控制尚未提及,在我国临床尚属空白。为探讨改善晚期癌症患者CRNV的止吐方案,本研究联合应用甲氧氯普胺和氟哌啶醇,与昂丹司琼比较,并分别与两药单用进行平行对照,观察对CRNV和乏力的控制效果。
1 资料和方法
1.1 一般资料
收集2013年12月—2016年12月郑州市第九人民医院姑息(缓和)治疗暨安宁疗护中心、郑州大学第一附属医院肿瘤内科、河南省人民医院肿瘤内科、郑州市第一人民医院妇科罹患恶性肿瘤晚期伴恶心呕吐、乏力的患者600例(图1),排除64例,共纳入536例,男性300例,女性236例,年龄35~90岁,中位年龄56.3岁。均经过病理确诊(病理类型不限),入院时体力状态评分采用美国东部肿瘤协作组织(Eastern Cooperative Oncology Group,ECOG)标准小于等于2分。排除标准:CINV患者;患有精神系统疾病者;颅内高压、消化道梗阻或其他原因引起的顽固性呕吐者;前庭疾病如梅尼埃病等;本研究所用药物容易引起药物毒性的患者,如帕金森病、癫痫患者等;语言沟通障碍者。
1.2 方法
采用电脑产生的随机序列将纳入对象随机分成4组,昂丹司琼阳性对照组133例,甲氧氯普胺组135例,氟哌啶醇组132例,甲氧氯普胺联合氟哌啶醇组136例。该研究通过了我院及合作医院伦理委员会的批准,所纳入的患者均签署了知情同意书。
1.3 用药方案
各组药物用量参考说明书和相关文献[6-7]。甲氟联合组分别给予:甲氧氯普胺(购自常州康普药业有限公司,批号HB2021278)口服10 mg,每天3次;氟哌啶醇(购自江西制药有限责任公司,H36020751)口服1 mg,每天2次;或静脉/皮下注射甲氧氯普胺(购自河南润弘制药股份有限公司,H41020322)40 mg,每天1次;氟哌啶醇静脉/皮下注射(购自山东鲁抗医药集团泰安制药厂,H37024042)5 mg,每天1次;两药单用方法和剂量同前。昂丹司琼[购自宁波天衡药业股份有限公司(原宁波市天衡制药有限公司),C14202018230]口服4~8 mg,每天2~4次。记录服药期间出现的常见不良反应,并给予对症处理。4组患者均给予以改善患者症状和提高生活质量为目的的姑息治疗,其治疗要素主要包括癌痛及其他不适症状的处理、营养支持、心理辅导和人文关怀等。
1.4 评价指标
1.4.1 止吐效果评价
一方面采用非患者自陈式评价方法,判断标准依据WHO抗癌药不良反应中恶心呕吐的分级:0级,无恶心呕吐;Ⅰ级,恶心;Ⅱ级,暂时性呕吐;Ⅲ级,呕吐,需治疗;Ⅳ级,难控制的呕吐。本研究中经治疗后0~Ⅱ级为有效,Ⅲ~Ⅳ级为无效。另一方面,采用患者自陈式评价工具,恶心、呕吐及干呕指数评价量表(Index of Nausea,Vomiting,and Retching,INVR)[8]进行评价,INVR已经过汉化且进行信度效度的检验。该量表从症状持续时间、频率及严重程度3个维度来评估临床患者恶心、呕吐症状。总分越高表示患者恶心呕吐程度越严重。
1.4.2 止吐药物不良反应
给予患者应用止吐药物后,密切观察药物不良反应,记录最常见不良反应,并给予患者相应的对症处理措施。
1.4.3 多维疲乏症状量表-简表(Multidimensional Fatigue Symptom Inventory-Short Form,MFSI-SF)[9]
选用中文版MFSI-SF简表,该量表含30个条目,分别从整体、生理、情绪、心理、精神和精力6个方面评定,采用5级评分法,总分为前5项之和减去精力得分。得分越高表示患者疲乏程度越重。
1.5 统计学处理
采用SPSS 18.0进行统计学分析,计量资料以±s 表示,计数资料以百分比表示,组间均数的比较采用单因素方差分析,两组间率比采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 一般情况
共纳入536例癌症相关性恶心呕吐患者。其中,男性占44.0%,女性占56.0%,60岁以上的患者占65.3%。体力活动评分为2分(表示日间约一半的时间可自主站立或行走)的患者占72.0%。4组患者在性别、年龄、病理类型、ECOG体力活动评分差异均无统计学意义(P均>0.05,表1)。
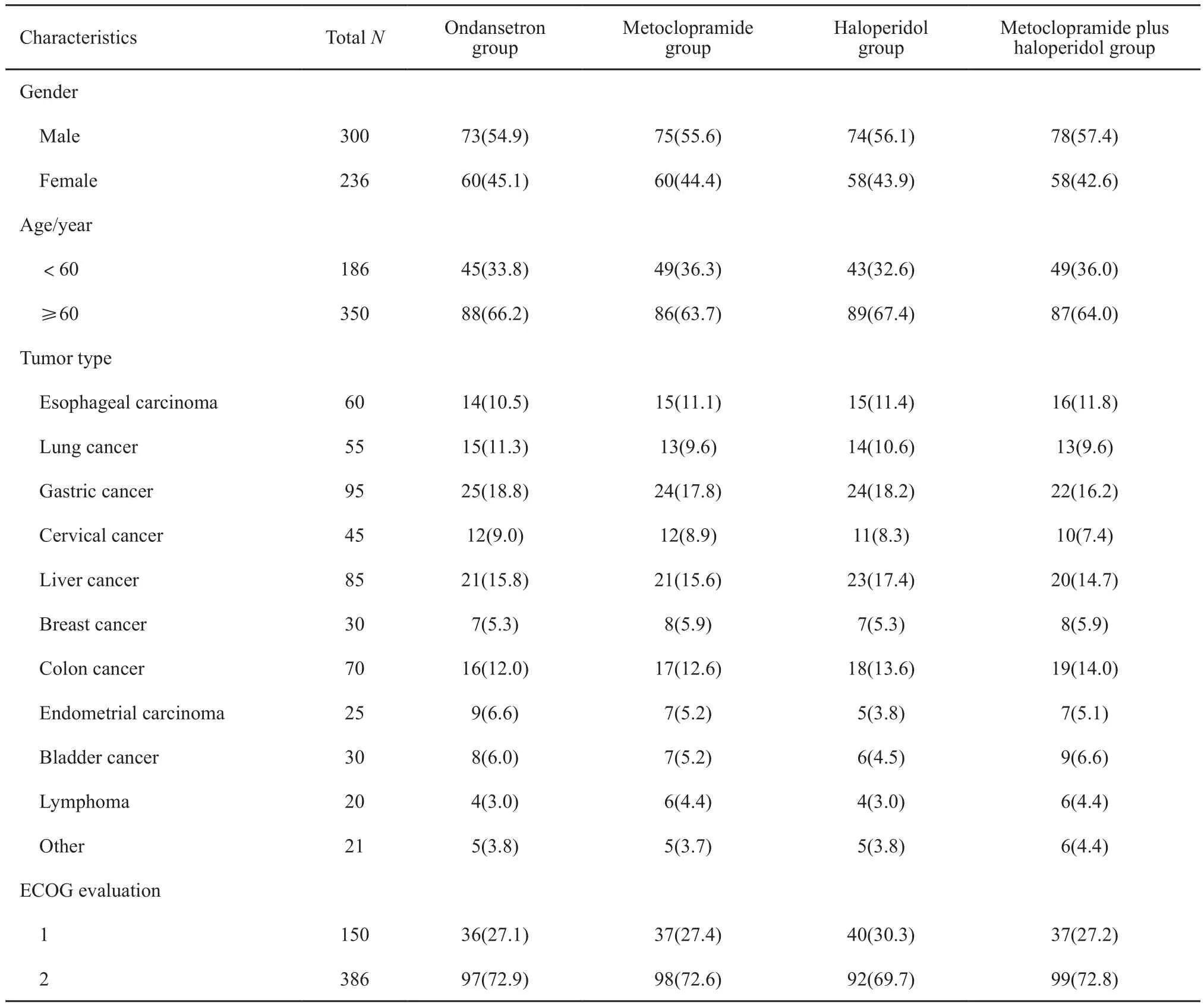
表1 4组患者一般情况Tab.1 The characteristics of four operation groups[n(%)]
2.2 止吐效果评价
2.2.1 采用非患者自陈式评价止吐效果
本研究周期历时4周,分为3个阶段,包括入院服药48 h、2周和出院继续服药至第4周。针对患者出现的其他不适症状采用以缓解患者不适症状和提供生活质量的姑息治疗为主的相应处理措施。由临床医师对患者进行院外随访,每周1~2次跟进并记录用药情况同时给予相应的指导。采用非患者自陈式评价止吐效果的结果见表2。其中,甲氧氯普胺和氟哌啶醇联合组在住院用药48 h、2周和出院随访4周时的止吐作用有效率分别为53.7%、86.8%和94.9%,其中,甲氟联合组服药第2、4周时止吐效果均显著优于对照组和单药组(P<0.05)。
2.2.2 采用患者自陈式评价工具INVR评价止吐效果
患者院内用药48 h,昂丹司琼组INVR评分显著高于甲氧氯普胺和氟哌啶醇联合组及单药组(P<0.05);患者院内服药2周及院外4周时,甲氟联合组INVR评分较对照组和单药组显著降低,差异有统计学意义(P<0.05)。
2.3 止吐药物不良反应
4组患者服用止吐药物不良反应结果见表4。昂丹司琼对照组在应用第2周时出现的不良反应明显高于其他组,随着用药时间的延长,止吐药物不良反应增加。而甲氟联合组不良反应发生率与两药单用相近,显著优于对照组(P <0.05),且不随用药时间显著增加。
2.4 乏力评价
4组患者疲乏评分结果见表5。甲氟联合组在院用药2周时,患者疲乏症状评分较48 h显著降低,且低于对照组和单药组,差异均有统计学意义(P<0.05)。患者院外服药第4周时,甲氟联合组MFSI-SF评分仍显著低于对照组和单药组(P<0.05),且乏力改善优于第2周。
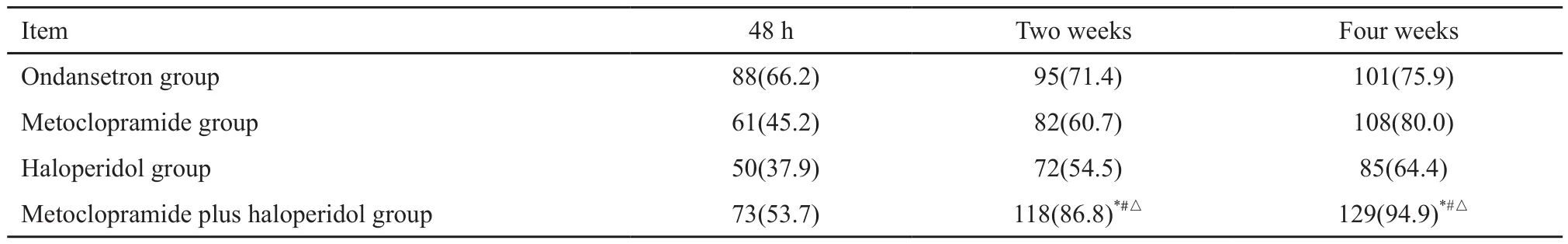
表 2 患者在住院用药48 h、2周和出院4周时止吐效果评价Tab. 2 Evaluation of antiemetic efficiency in patients taking antiemetics at 48 h, 2 weeks and 4 weeks after discharge[n(%)]
表3 患者不同时间的INVR评分Tab.3 The INVR score in 4 groups at different time(±s)

表3 患者不同时间的INVR评分Tab.3 The INVR score in 4 groups at different time(±s)
*: P<0.05, compared with ondansetron group; # : P<0.05, compared with metoclopramide group; △: P<0.05, compared with haloperidol group
48 h Two weeks Four weeks Ondansetron group 17.87±2.42* 14.87±1.54 12.17±1.64 Metoclopramide group 19.53±2.15 8.54±1.26* 6.04±1.28*Haloperidol group 20.34±2.08 9.29±1.48* 7.24±1.34*Metoclopramide plus haloperidol group 19.16±2.54 6.06±1.23*# 3.78±0.97*#△Item
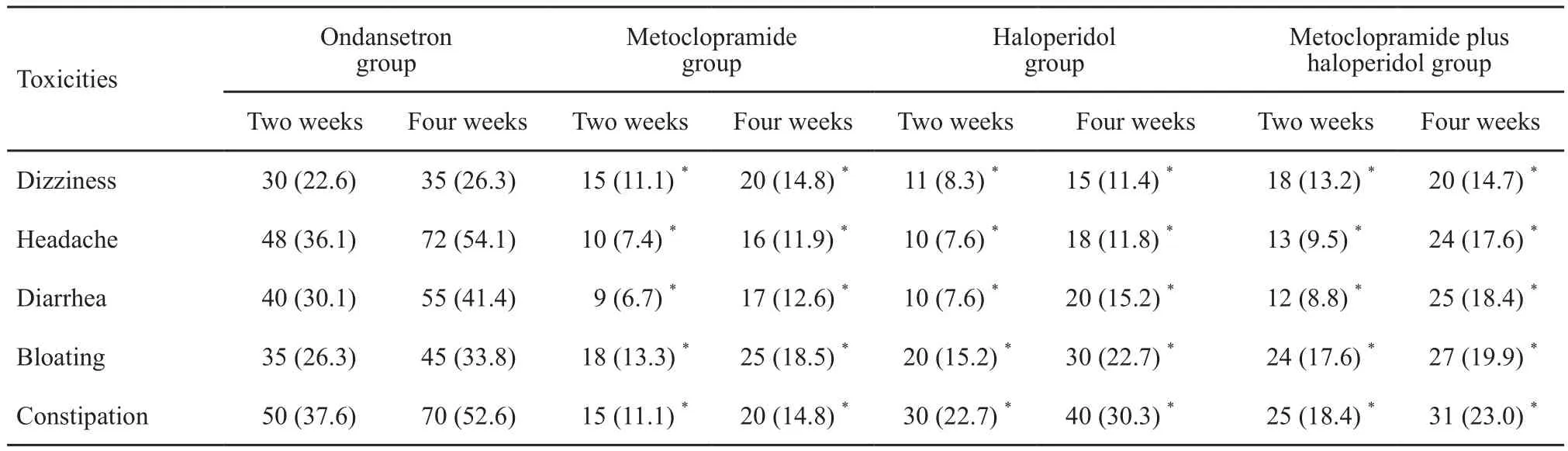
表 4 4组患者在服用止吐药不同时间出现不良反应Tab. 4 The adverse events of patients in 4 groups taking antiemetics at different time
表5 各组患者不同时间MFSI-SF评分Tab.5 The MFSI-SF score of patients in 4 groups at different time(±s)
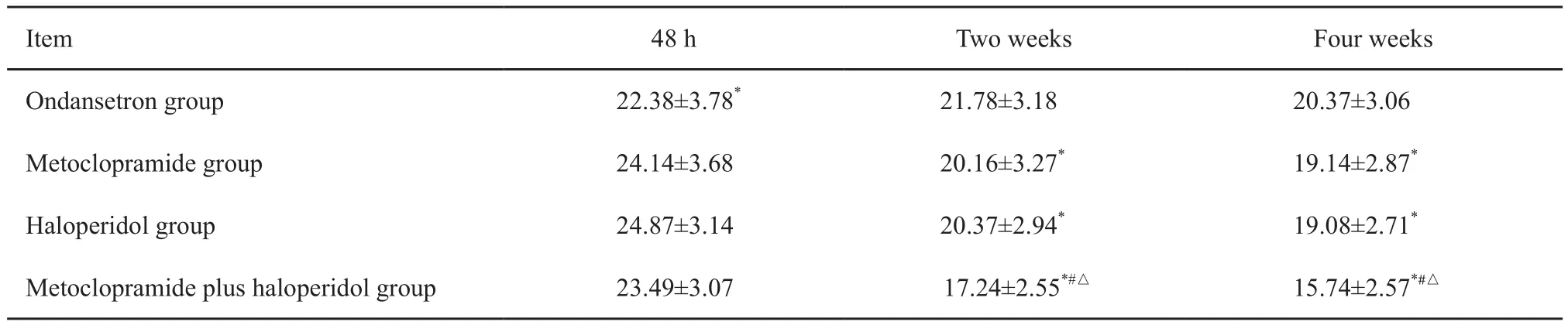
表5 各组患者不同时间MFSI-SF评分Tab.5 The MFSI-SF score of patients in 4 groups at different time(±s)
*: P<0.05, compared with ondansetron group; #: P<0.05, compared with metoclopramide group; △: P<0.05, compared with haloperidol group
48 h Two weeks Four weeks Ondansetron group 22.38±3.78* 21.78±3.18 20.37±3.06 Metoclopramide group 24.14±3.68 20.16±3.27* 19.14±2.87*Haloperidol group 24.87±3.14 20.37±2.94* 19.08±2.71*Metoclopramide plus haloperidol group 23.49±3.07 17.24±2.55*#△ 15.74±2.57*#△Item
3 讨 论
CRNV及乏力病因学复杂,常与胃肠道、肿瘤本身、药物、精神病学及诱发因素等有关[1,10]。癌症本身及其相关治疗均为严重的应激性事件,常导致患者应激性心理和生理反应,表现出各种不良情绪和心理症状。CRNV表现为局部消化道的刺激反应和全身性、精神性的有害应激。慢性持续性恶心呕吐常导致患者乏力,持续乏力使患者活动障碍并进一步加重心理负担。以往临床上单纯给予的止吐药物并不能改善患者的精神状态和情绪。因此,治疗上应联合使用止吐和抗精神药物。本研究选用止吐药甲氧氯普胺和抗精神药氟哌啶醇,采用INVR、MFSI-SF和WHO药物不良反应恶心呕吐分级标准3项评估工具,从医患双维度评价联合用药的临床效果。
甲氧氯普胺联合氟哌啶醇具有协同止吐作用,能持续控制CRNV症状。本研究通过联合治疗方案,试验组用药2和4周后的有效率分别为86.8%和94.9%,INVR评分由用药前的(18.76±2.54)分下降至用药4周后(3.78±0.97)分,止吐有效率的提高、INVR评分的下降显示了甲氟联合方案有效止吐作用。本研究应用的甲氧氯普胺被美国克利夫兰临床指南[1,11]作为一线止吐药应用于姑息治疗单元癌性恶心呕吐的治疗。其机制除有效抑制多巴胺受体外,还可通过外周兴奋胃肠道,发挥促进胃排空的作用。联合应用的氟哌啶醇能抑制多巴胺受体[10],同样具有强大的镇吐作用。二者联用有效证明了甲氧氯普胺联合氟哌啶醇具有协同止吐作用,能持续改善晚期癌症患者癌性恶心呕吐症状。
甲氧氯普胺联合氟哌啶醇不良反应发生率较低并可长期服用。本研究对象为晚期癌症患者,均需要长期服药,所选药物应首先考虑减轻患者躯体不适症状,避免使用药物不良反应影响治疗效果和患者耐受性的药物。本研究选择的甲氧氯普胺和氟哌啶醇均为多巴胺受体拮抗剂,两药的不良反应主要为椎体外系反应,本研究观察结果均未发现该不良反应。且甲氟联合组头晕、头痛及腹泻等不良反应发生率与两药单用相近,长时间服用(4周),其药物不良反应无不显著增加,说明甲氟联合方案并未出现不良反应叠加现象。相反,昂丹司琼对照组超过1/3的患者出现了头痛、便秘症状,且随着干预周期,其不良反应发生率分别达到了54.1%和52.6%。因此,甲氟联合用药安全、有效,可长期服用,更适用于晚期癌症CRNV患者。
甲氧氯普胺联合氟哌啶醇能持续改善乏力症状并减轻精神因素的有害应激。本研究通过联合方案的治疗,试验组MFSI-SF乏力评分由用药前的(23.49±3.07)分下降至用药2周后的(17.24±2.55)分和用药4周后的(14.74±2.17)分,说明乏力症状持续改善。慢性持续性恶心呕吐常导致患者乏力、焦虑和恐惧,乏力将进一步影响患者的精神状态,所产生的焦虑、恐惧反过来加重患者的躯体不适。本研究采用的氟哌啶醇为抗精神药,具有抗焦虑作用,减轻了精神心理因素的有害应激。联合应用的甲氧氯普胺具有止吐和胃排空的作用,胃肠功能的改善,可使患者的进食量有所增加。因此,二者联合协同改善了患者的乏力症状。
综上所述,晚期癌症CRNV及乏力患者,其治疗方案的选择除考虑症状解除外,还应注重药物的不良反应及精神心理等因素。本研究采用的甲氧氯普胺联合氟哌啶醇的止吐方案体现了对晚期癌症患者症状控制、精神心理因素的重视,达到了显著稳定的临床止吐效果,安全、实用性强,值得临床推广。该方案是否具有更长时期稳定的止吐效果尚待今后进一步观察。
[1] GUPTA M, DAVIS M, LEGRAND S, et al. Nausea and vomiting in advanced cancer: the Cleveland Clinic Protocol[J]. J Support Oncol, 2013, 11(1): 8-13.
[2] MORROW G R, SHELKE A R, ROSCOE J A, et al.Management of cancer-related fatigue [J]. Cancer Invest,2005, 23(3): 229-239.
[3] GORDON P, LEGRAND S B, WALSH D. Nausea and vomiting in advanced cancer[J]. Eur J Pharmacol, 2014 (722): 187-191.
[4] NCCN Clinical Practice Guidelines in Oncology: Antiemetic.Inc. version 2, 2014.
[5] ROILA F, HERRSTEDT J, AAPRO M, et al. Guideline update for MASCC and ESMO in the prevention of chemotherapyand radiotherapy-induced nausea and vomiting: results of the Perugia consensus conference[J]. Ann Oncol, 2010,21(Suppl 5): 232-243.
[6] BRUERA E, SEIFERT L, WATANABE S, et al. Chronic nausea in advanced cancer patients: a retrospective assessment of a metoclopramide-based antiemetic regimen[J]. J Pain Symptom Manage, 1996, 11(3): 147-153.
[7] HARDY J R, O’SHEA A, WHITE C, et al. The efficacy of haloperidol in the management of nausea and vomiting in patients with cancer[J]. J Pain Symptom Manage, 2010,40(1): 111-116.
[8] FU M R, RHODES V, XU B. The Chinese translation of the Index of Nausea, Vomiting, and Retching[J]. Cancer Nurs,2002, 25(2): 134-140.
[9] LI C P, CHU H, CHEN W C, et al. Reliability and validity of a Chinese version of the Multidimensional Fatigue Symptom Inventory-Short Form (MFSI-SF-C)[J]. J Clin Nurs, 2011,20(15-16): 2224-2232.
[10] WATSON M S. Oxford handbook of palliative care[M].Oxford University Press, 2005.
[11] 中国临床肿瘤学会抗肿瘤药物安全管理专家委员会. 肿瘤治疗相关呕吐防治指南(2014版)[J]. 临床肿瘤学杂志,2014(3): 263-273.

