头颈部腺样囊性癌的磁共振成像特点
张云燕,顾雅佳,吴 斌,,邓 霖,张光远,彭卫军,
1.上海市质子重离子医院放射诊断科,上海 201321;
2.复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032
腺样囊性癌(adenoid cystic carcinoma,ACC)是起源于涎腺组织的一种少见恶性肿瘤,年发病率为(3.0~4.5)例/106人,约占头颈部恶性肿瘤的1%、涎腺肿瘤的10%[1]。ACC常见于腮腺、颌下腺及小涎腺,肿瘤生长缓慢且持续,临床症状通常不典型,易侵犯神经和局部复发,晚期可发生远处转移。目前ACC的主要治疗手段为根治性手术治疗和术后放疗,而治疗前对病变范围进行准确的评估对于制定治疗计划及患者预后都非常重要[2]。本研究总结了26例头颈部ACC患者的临床及磁共振成像(magnetic resonance imaging,MRI)资料,旨在探讨MRI对该疾病的临床应用价值。
1 材料和方法
1.1 病例资料
收集上海市质子重离子医院2015年5月—2017年9月收治的经手术病理证实的26例头颈部ACC患者的临床及影像学资料。19例为原发肿瘤,主要临床症状包括局部肿块或头面部疼痛10例,鼻塞鼻出血5例,眼睑下垂1例,张口受限1例,听力视力下降1例,另有1例局部无症状因体检发现肝、肺转移就诊。自出现症状到就诊间隔时间为0~36个月,中位时间为6个月。7例为局部复发肿瘤,其中5例为第1次复发,2例为多次复发,自确诊至初次复发时间间隔为7个月至30年。1例患者局部复发1年后随访发现肺转移。
1.2 MRI检查
M R I检查使用德国S i e m e n s公司的MEGNETOM Skyra扫描仪。所有患者均行平扫及增强检查。平扫包括TSE序列T1WI[重复时间(repetition time,TR)为370~550 ms,回波时间(echo time,TE)为12 ms]和T2WI(TR为2 500~5 100 ms,TE为78 ms)横断位扫描,以及T1-TIRM序列(TR为1 500 ms,TE为9 ms)矢状位扫描和(或)T2-TIRM序列(TR为3 690 ms,TE为55 ms)冠状位扫描。增强扫描对比剂为钆喷酸葡胺(Gd-diethylenetriamine pentaacetic acid,Gd-DTPA),剂量为0.1 mmol/ kg,行横断位、矢状位及冠状位扫描。矩阵320×320~384×384,层厚3~5 mm,层间隔0.5~1.0 mm。
2 结 果
2.1 发病年龄及部位
26例患者中,男性10例,女性16例,年龄16~69岁,平均年龄42岁。肿瘤位于鼻咽8例,腭6例,鼻腔4例,上颌窦3例,颌下腺和舌各2例,喉1例。
2.2 MRI表现
26例ACC中有3例(腭1例,舌2例)呈类圆形改变,边界较清;其余23例肿瘤形态不规则,呈浸润性生长,边界不清(图1)。肿瘤大小为15 mm×25 mm~52 mm×75 mm。肿瘤的MRI信号特征见表1,在T1WI上,肿瘤与正常肌肉组织相比,26例均呈等信号,其中25例不均匀,1例相对均匀。在T2WI上,25例呈不均匀的高或稍高信号,其中5例伴有明显的低信号分隔;另1例呈相对均匀的稍高信号。增强后25例可见明显不均匀强化,其中5例低信号分隔均见强化,囊性变坏死区无强化,呈多发小囊状改变(图2);另1例呈均匀的明显强化。17例伴有神经侵犯征象(表2),其中累及翼腭窝16例,表现为局部脂肪信号消失,代之以软组织信号影,并伴有异常强化(图3);累及海绵窦10例,表现为海绵窦增宽伴异常强化软组织影(图4);累及卵圆孔8例,圆孔4例,眶上裂2例,视神经管2例,舌下神经管2例,翼管1例,表现为孔道的扩大和异常强化,其中2例可见三叉神经走行径路上神经的增粗及强化(图5)。21例侵犯邻近骨质,表现为骨质信号异常伴强化。11例侵犯颅内,表现为海绵窦及Meckel腔增宽,4例同时伴有颅底脑膜增厚强化。2例伴有颈部淋巴结肿大。
2.3 远处转移
26例中有2例可见远处转移,1例就诊时即发现肝肺转移,1例确诊后4年发现肺转移。
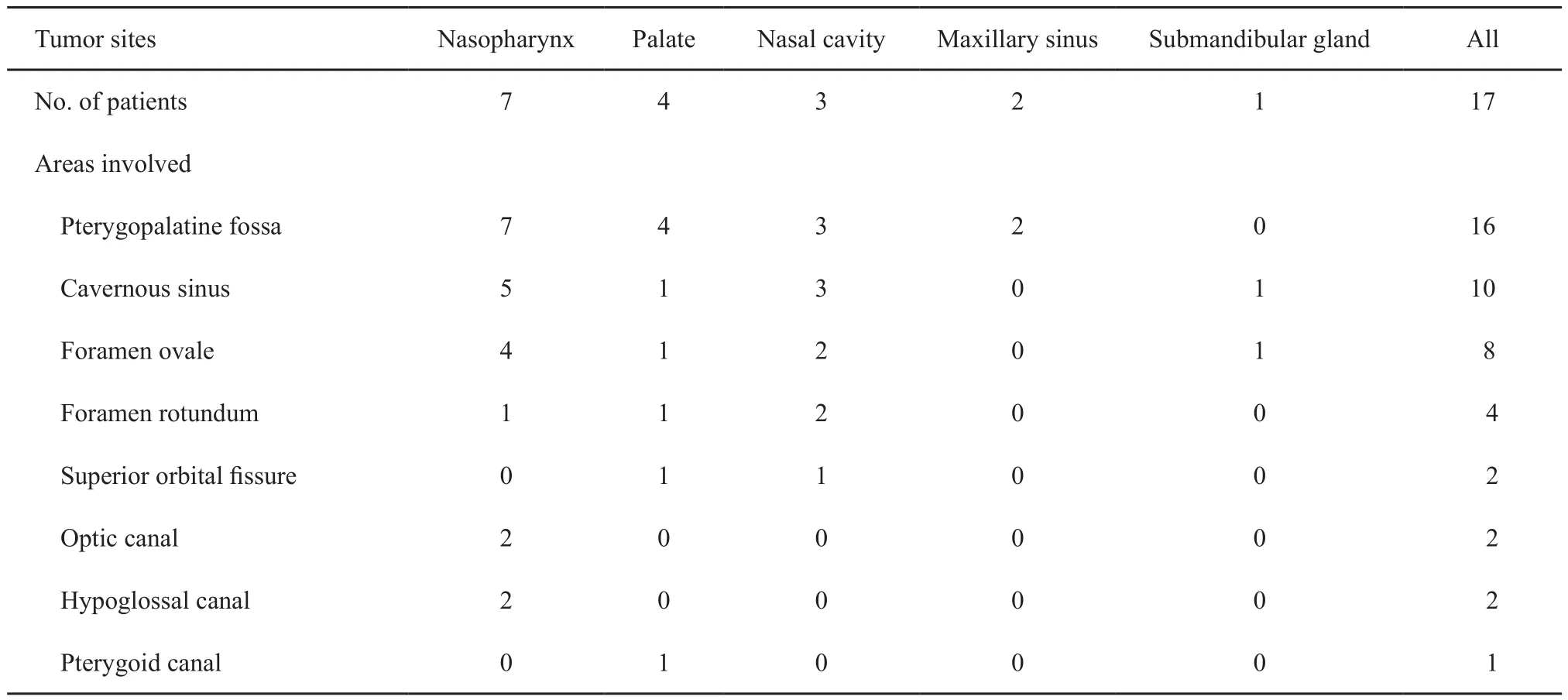
表2 17例不同部位ACC的神经侵犯表现Tab.2 Perineural spread in 17 patients with ACC of different sites
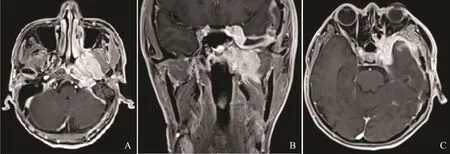
图1 鼻咽部ACC伴周围结构侵犯Fig.1 ACC of left nasopharynx with involvement of adjacent tissues
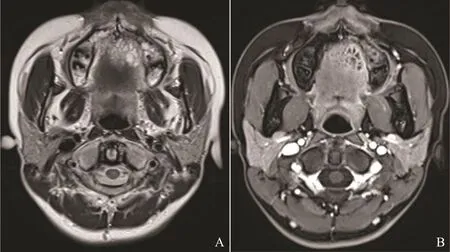
图2 硬腭ACC伴内部分隔Fig.2 ACC of the palate with septations
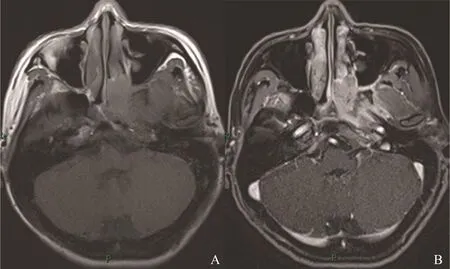
图3 左侧鼻腔ACC伴神经侵犯Fig.3 ACC of left nasal cavity with perineural spread
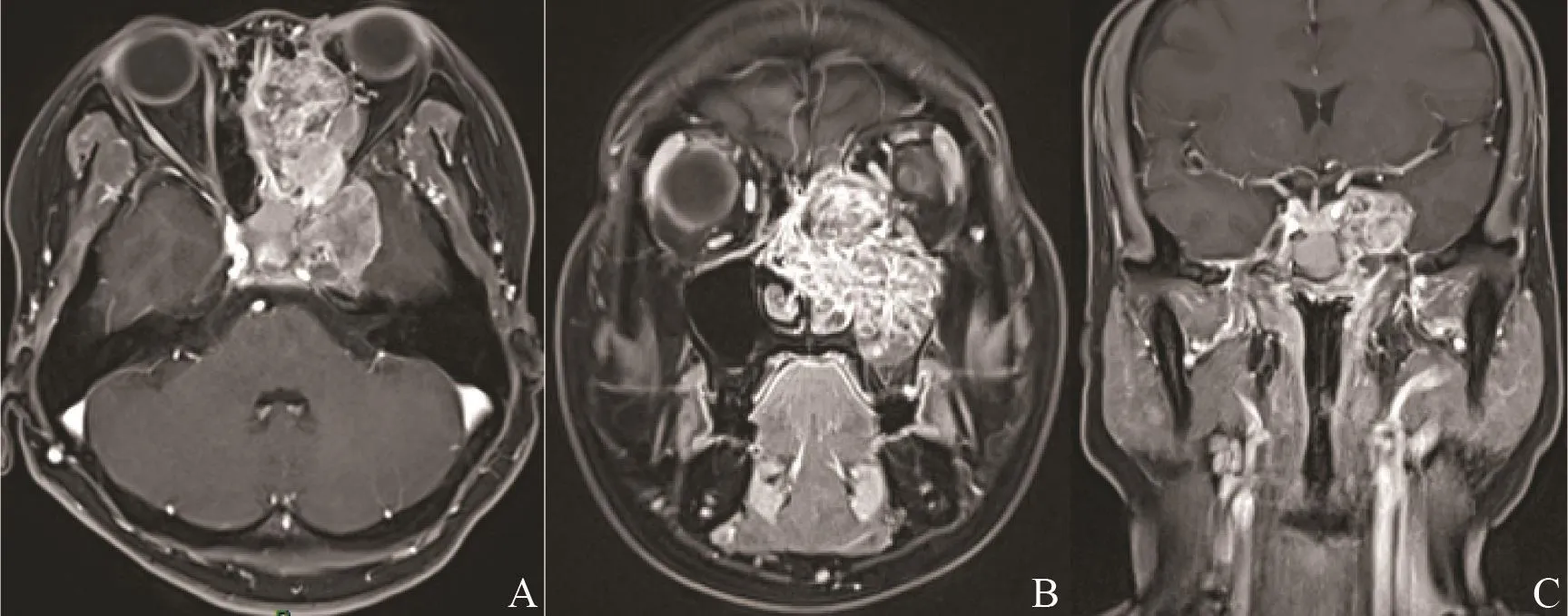
图4 左侧鼻腔鼻窦ACC侵犯海绵窦Fig.4 ACC of left nasal cavity and paranasal sinuses with involvement of cavernous sinus
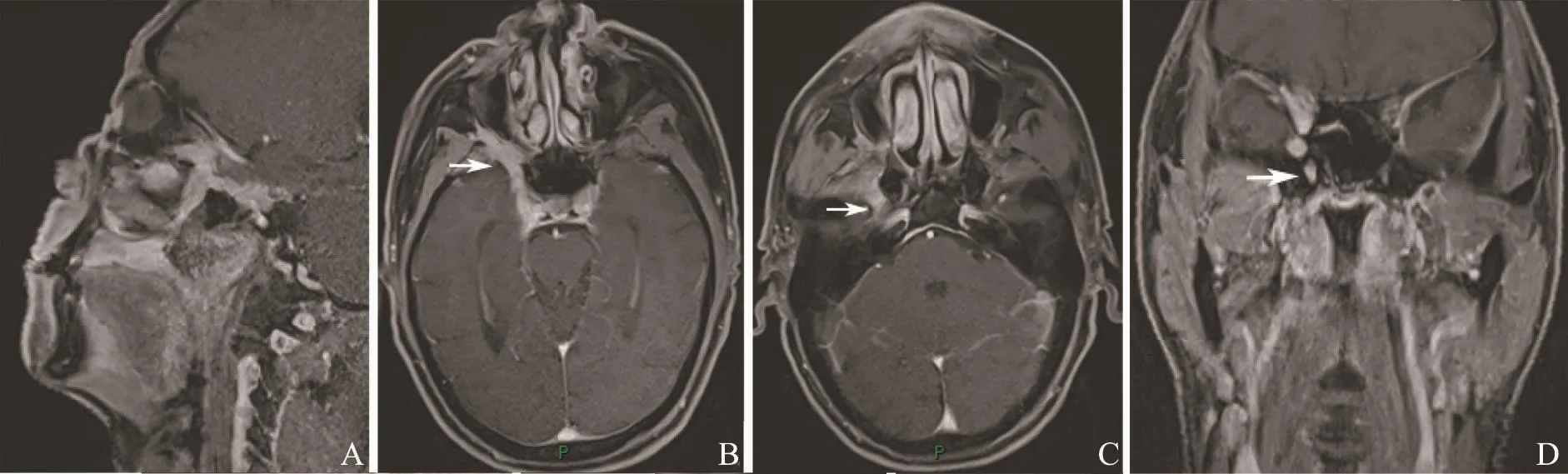
图5 右侧腭部ACC沿三叉神经分支蔓延Fig.5 ACC of right palate with extension along branches of trigeminal nerve
3 讨 论
ACC好发于小涎腺,是小涎腺的最常见恶性肿瘤,占32%~71%,也是大涎腺的常见恶性肿瘤之一,另有少数可见于泪腺、耵聍腺及身体其他部位,如乳腺、气管及喉等[1]。起源于小涎腺的ACC最常发生部位为腭,其次为副鼻窦及口腔其他部位[3]。大涎腺中最常见于腮腺,其次为颌下腺,但ACC在颌下腺恶性肿瘤中所占比例较腮腺更高,约40%[1]。本组26例患者中仅2例位于颌下腺,1例位于喉,其余23例均起源于小涎腺,与文献报道一致。此23例肿瘤中位于鼻咽部最多,其余依次为腭、鼻腔、副鼻窦和舌,均为ACC的常见部位,但所占比例与文献报道有所不同,可能与本组病例数较少及上海市质子重离子医院的专科性质有关。ACC常见于成年人,以40~70岁居多,男女发病率无明显差异,没有明确的危险因素[4]。ACC生长缓慢,临床症状不典型,早期常为无痛性肿块,随着疾病的渐进性发展,患者因部位不同而出现各种症状,如位于腮腺者可见面神经麻痹,位于腭部可见溃疡或瘘管,位于喉部可见呼吸困难,位于鼻腔鼻窦时可见鼻塞、鼻衄、面部疼痛和眼部症状。本组病例中有52.6%(10/19)的患者因局部肿块或疼痛就诊,自出现症状至就诊的中位时间为6个月,最长1例长达3年。病理上ACC有管状型、筛状型和实体型3个亚型,其中筛状型最常见,实体型最少见。有研究表明,ACC的肿瘤实性成分越多,预后越差,因此根据实性成分所占比例,Szanto等[5]建立了如下病理分级系统,目前已经被广泛应用。I级:肿瘤为管状或筛状型,无实性型成分;Ⅱ级:主要为筛状型,实性型成分小于30%;Ⅲ级:主要为实性型。本组病例未进行组织学分型。ACC具有嗜神经生长和局部易复发的特点,晚期可远处转移至肺、骨,但淋巴结转移不常见。本研究中26.9%(7/26)为局部复发患者,其中2例为多次复发。7.7%(2/26)患者出现远处转移,其中1例就诊时即发现肝肺转移。另有2例出现颈部淋巴结肿大,但病理上未得到证实。
MRI具有较高的软组织分辨率,可多平面成像,能清晰显示肿瘤的大小形态及信号特征,并准确地评估病灶范围及周围结构受累情况。本研究中大部分肿瘤呈浸润性生长,形态不规则,边界不清,T1WI呈等信号,T2WI呈不均匀的高或稍高信号,增强后可见明显强化,与之前文献报道类似[6-7]。19%(5/26)的病灶在T2WI上出现低信号分隔,增强后分隔强化,呈多发小囊状改变。此征象对于ACC的诊断具有一定的特异性,但在本组病例中发生率不高,可能与肿瘤的病理类型有关。ACC具有嗜神经生长的生物学特点,其沿神经的直接蔓延在微观上是连续的,但肉眼上可见与主瘤块不连续的区域[8],侵犯鼻腔、眼眶、翼腭窝及颅底,甚至颅内。神经侵犯是头颈部ACC患者预后不良的危险因素之一[9],其最常累及的是三叉神经和面神经。三叉神经的眼支V1穿行海绵窦外侧壁经眶上裂入眶,上颌支V2穿入海绵窦经圆孔出颅、进入翼腭窝经眶下裂入眶,下颌支V3经卵圆孔出颅分布于咀嚼肌间隙。CT可以很好地显示骨结构,对神经侵犯的诊断也依赖于这些神经径路上颅底孔道的骨质变化,表现为骨质破坏、边缘硬化和直径增大,但这些征象的出现相对滞后,而MRI凭借较高的软组织分辨率可以更早地发现肿瘤对神经的侵犯。MRI诊断神经侵犯的征象包括正常脂肪间隙消失、神经增粗及异常强化。国外文献报道,ACC侵犯神经的比例为51.1%~81.8%[10-12]。本组病例中MRI显示,65.4%(17/26)的患者有神经侵犯,典型者可见完全沿三叉神经走行径路的神经增粗及强化。神经侵犯是ACC的典型特点之一,但并不具有特异性,也常见于头颈部的其他肿瘤,如发病率更高的鳞状细胞癌。此外,神经的炎性增粗或水肿有时表现也类似于肿瘤浸润。Hanna等[13]对26例ACC患者的影像及病理资料进行对比研究,结果显示,CT评估神经侵犯的灵敏度和特异度分别为88%和89%,而MRI的灵敏度和特异度分别为100%和85%。Gandhi等[14]的研究亦表明,MRI不仅可以准确诊断有无神经侵犯,且对其侵犯范围的评估准确率高达83.3%。由此可见对于神经侵犯的诊断评估,MRI检查要优于CT,且可以更早地发现。
不同部位ACC需与不同疾病相鉴别。口腔上腭、舌及颊膜等部位小涎腺的ACC需与上皮来源其他恶性肿瘤、转移瘤鉴别。鼻腔鼻窦的ACC需与鳞状细胞癌、嗅神经母细胞瘤、淋巴瘤、肉瘤、黑色素瘤等恶性肿瘤及慢性炎性反应息肉鉴别。鳞癌在T2WI上信号相对略低,肿瘤坏死多见于中央,单发、较大且边缘模糊,骨质“虫蚀状”破坏更常见,骨壁受压和窦腔扩大相对少见。嗅神经母细胞瘤以青年或中年患者多见,肿瘤邻近嗅沟,强化明显,并常累及颅内。腮腺、颌下腺及舌下腺的ACC低度恶性者需与涎腺的良性肿瘤相鉴别,高度恶性时虽在病变形态边缘等方面有别于良性肿瘤,但与其他恶性肿瘤鉴别困难,最终诊断有赖于病理检查。
综上所述,MRI由于具有较高的软组织分辨率,可多面成像,准确评估ACC病灶范围及神经受累情况,从而有利于手术切缘的确定及放疗边界的选择,优化患者的治疗方案,具有较高的临床应用价值。在诊断方面MRI表现缺乏特异性,但因其具有嗜神经生长的生物学特性,一旦发现头颈部恶性肿瘤有神经侵犯的征象,需考虑到ACC的可能性。
[1] COCA-PELAZ A, RODRIGO J P, BRADLEY P J, et al.Adenoid cystic carcinoma of the head and neck-an update[J].Oral Oncol, 2015, 51(7): 652-661.
[2] VANDER POORTEN V, HUNT J, BRADLEY P J, et al. Recent trends in the management of minor salivary gland carcinoma[J]. Head Neck, 2014, 36(3): 444-455.
[3] VAN WEERT S, BLOEMENA E, VAN DER WAAL I, et al.Adenoid cystic carcinoma of the head and neck: a single-center analysis of 105 consecutive cases over a 30-year period [J].Oral Oncol, 2013, 49(4): 824-829.
[4] BJØRNDAL K, KROGDAHL A, THERKILDSEN M H, et al.Salivary gland carcinoma in Denmark 1990–2005: a national study of incidence, site and histology. Results of the Danish Head and Neck Cancer Group (DAHANCA) [J]. Oral Oncol,2011, 47(7): 677-682.
[5] SZANTO P A, LUNA M A, TORTOLEDO M E, et al. Histologic grading of adenoid cystic carcinoma of the salivary glands [J].Cancer, 1984, 54(6): 1062-1069.
[6] LIU X W, XIE C M, LI H, et al. Nasopharyngeal adenoid cystic carcinoma: magnetic resonance imaging features in ten cases[J]. Chin J Cancer, 2012, 31(1): 19-28.
[7] KATO H, KANEMATSU M, SAKURAI K, et al. Adenoid cystic carcinoma of the maxillary sinus: CT and MR imaging findings[J]. Jpn J Radiol, 2013,31(11): 744-749.
[8] BADGER D, AYGUN N. Imaging of perineural spread in head and neck cancer [J]. Radiol Clin North Am, 2017, 55(1):139-149.
[9] JU J, LI Y, CHAI J, et al. The role of perineural invasion on head and neck adenoid cystic carcinoma prognosis: a systematic review and meta-analysis [J]. Oral Surg Oral Med Oral Pathol Oral Radiol, 2016, 122(6): 691-701.
[10] CHUMMUN S, MCLEAN N R, KELLY C G, et al. Adenoid cystic carcinoma of the head and neck [J]. Br J Plast Surg,2001, 54(6): 476-480.
[11] BIANCHI B, COPELLI C, COCCHI R, et al. Adenoid cystic carcinoma of intraoral minor salivary glands [J]. Oral Oncol,2008, 44(11): 1026-1031.
[12] RAPIDIS A D, GIVALOS N, GAKIOPOULOU H, et al. Adenoid cystic carcinoma of head and neck. Clinicopathological analysis of 23 patients and review of literature [J]. Oral Oncol, 2005,41(3): 328-335.
[13] HANNA E, VURAL E, PROKOPAKIS E, et al. The sensitivity and specificity of high-resolution imaging in evaluating perineural spread of adenoid cystic carcinoma to the skull base[J]. Arch Otolaryngol Head Neck Surg, 2007, 133(6): 541-545.
[14] GANDHI M R, PANIZZA B, KENNEDY D. Detecting and defining the anatomic extent of large nerve perineural spread of malignancy: comparing “targeted” MRI with the histologic findings following surgery [J]. Head Neck, 2011, 33(4): 469-475.

