18F-FAC PET/CT在体监测肾癌脂肪酸代谢动态变化
孙玉云,张 健,郑营营,顾丙新,罗建民,张建平,徐俊彦,章英剑,王明伟
1.复旦大学附属肿瘤医院核医学科,复旦大学上海医学院肿瘤学系,复旦大学生物医学影像研究中心,上海分子影像探针工程技术研究中心,上海 200032;
2.复旦大学核物理与离子束应用教育部重点实验室,上海 200433;
3.上海师范大学生命与环境科学学院,上海 200234
最新统计显示,我国肾细胞癌(renal cell carcinoma,RCC)发病率位居泌尿系统肿瘤第3位,高达6.8/10万[1],且和经济欠发达地区相比,其发病率在经济发达地区明显较高[2]。18F-FDG作为临床最常规和广泛使用的PET/CT显像剂,其PET/CT显像诊断肾细胞癌的灵敏度仅有47%~60%,可能是由于葡萄糖代谢并非肾癌的主要代谢方式。有研究提出,肾细胞癌脂肪酸代谢异常增高,并且以脂肪酸从头合成为主[3]。近来有研究报道[4-6],11C-乙酸(11C-acetate,11C-AC)作为一种小分子脂肪酸,其PET/CT显像可用于诊断肾细胞癌,能弥补18F-FDG PET/CT显像在肾癌诊断方面的不足。然而,由于11C半衰期很短(t1/2=20.4 min),极大地限制了11C-AC PET/CT显像在临床中的广泛应用。因此,近年来18F标记乙酸盐(18F-fluoroacetate,18F-FAC)的研究开始出现[7-8]。18F-FAC作为11C-AC类似物,并且18F具有较长的半衰期(t1/2=109.7 min),其PET/CT显像具有很大的应用前景。例如,最新的一项研究显示,18F-FAC PET/CT对低级别肾癌的检出率为82.6%,显著高于18F-FDG显像的8.7%[8]。然而,截至到目前,尚没有18F-FAC PET/CT分子影像在体监测肾癌脂肪酸代谢动态变化的研究,因而也不清楚肾细胞癌摄取18F-FAC与脂肪酸代谢之间的关系。我们课题组的前期研究发现,肾细胞癌摄取11C-AC与脂肪酸合成酶(fatty acid synthase,FAS)有关[4],而FAS正是脂肪酸从头合成途径的关键酶之一。多项基础研究发现,PI3K/AKT/mTOR为FAS的上游调控因子之一[9-11],因此抑制该信号转导途径可以抑制FAS基因和蛋白的表达[12]。在本项研究中,我们选用mTOR抑制剂依维莫司作为干预药物,在药物处理前后的多个时间点,开展肾癌模型鼠的纵向性在体18F-FAC PET/CT显像,对比观察肾癌18F-FAC摄取和FAS表达的变化,从而探讨肿瘤18F-FAC摄取量与FAS表达量的相关性并研究18F-FAC PET/CT能否在体监测肾癌脂肪酸代谢变化。
1 材料和方法
1.1 主要实验试剂和仪器
18F-FAC由复旦大学附属肿瘤医院核医学科自制,合成方法见参考文献 [13]。依维莫司购自大连美仑生物技术有限公司,于-20 ℃冰箱中保存,临用时取适量该药物溶于30%丙二醇(先溶解),再加入5%Tween 80及去离子水,使药物浓度为2 mg/mL。兔抗人FAS抗体购自英国Abcam公司,使用时按1∶100配比。Inveon小动物PET/CT仪器为复旦大学附属肿瘤医院核医学科拥有。
1.2 肾癌细胞培养与肿瘤模型
将人肾透明细胞癌ACHN加入DMEM培养基,在37 ℃、CO2体积分数为5%的培养箱中温育。取对数期生长的ACHN细胞,经胰酶消化后,加入10.0 mL PBS,以1 000 r/min,离心3 次,每次5 min。重新加入PBS制成细胞悬液,等待接种。
50只BALB/c裸小鼠(6周龄,雌性)购买于上海斯莱克实验动物有限公司,于右侧大腿皮下接种1×107个ACHN细胞,在SPF环境下饲养20~30 d成瘤,待肿瘤直径达到5 mm时开始进行实验。
1.3 实验设计
荷瘤鼠分为3组,分别为18F-FAC microPET/CT显像组(n=6)、免疫组织化学组(n=24)和生存期观察组(n=20)。其中每组又分为2个亚组,即实验组和对照组(图1),实验组每天给予依维莫司(10 mg/kg),连续给药14 d,对照组每天给予等体积的0.9%NaCl溶液。
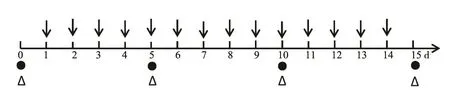
图1 18F-FAC microPET/CT显像组、免疫组织化学组和生存期观察组实验设计示意图Fig1 Experimental design for longitudinal 18F-FAC microPET/CT imaging, immunohistochemistry staining and treatment protocols
18F-FAC microPET/CT显像实验中,实验组和对照组各3只ACHN荷瘤鼠,分别在第0(干预前)天和干预后第5、10和15天行18F-FAC microPET/CT显像。免疫组织化学实验中,实验组和对照组各12只ACHN荷瘤鼠,分别在第0、5、10和15天随机处死3只荷瘤裸鼠,获取肿瘤组织,进行FAS免疫组织化学染色。生存期实验中,实验组和对照组各10只ACHN荷瘤鼠,每隔1 d测量、记录荷瘤鼠肿瘤直径,依据公式V=a×b2/2计算肿瘤体积(长径记为a,短径记为b),同时观察荷瘤鼠死亡时间,记录、绘制生存期曲线。
1.4 18F-FAC microPET/CT显像
荷瘤鼠于第0、5、10和15天,经尾静脉注射7.3~9.2 MBq(200~250 µCi)18F-FAC,注射后2 h采集10 min静态PET图像和CT图像。利用仪器的工作软件Inveon Research Workshop,通过OSEM3D/MAP法重建,获得经过衰减校正后的PET/CT图像,在肿瘤部位及对侧大腿肌肉部位勾画感兴趣区(region of interest,ROI),测定每克组织放射性占注入量的百分比最大值(the maximum of the percent injected dose per gram tissue,%ID/gmax),并计算出靶本比(T/M)。
1.5 FAS免疫组织化学染色及分析
分别于第0、5、10和15天处死3只荷瘤鼠,剥离获取肿瘤组织。然后,将瘤块置于4%多聚甲醛中固定48 h,常规石蜡包埋,脱蜡,抗原修复;加入一抗(兔抗人FAS抗体,1∶100),4 ℃温育过夜;再加入HRP-山羊抗兔/鼠通用二抗(DAKO)及DAB显色剂;最后脱水封片,并显微镜检,图像采集分析(×200)。FAS阳性率=阳性区域光密度值(integral optical density,IOD)/视野面积(mm2)。
1.6 统计学处理
采用SPSS 20.0统计软件分析处理数据。所有定量数据均以x±s表示,组间比较采用单因素方差分析,组内比较采用独立t检验。采用Kaplan-Meier法和log-rank检验比较ACHN荷瘤鼠生存差异,P<0.05为差异有统计学意义。
2 结 果
2.1 18F-FAC PET/CT显像在体监测肾癌脂肪酸代谢随时间的动态变化
图2A是实验组和对照组肾癌模型在第0(基线)、5、10和15天的静态18F-FAC PET/CT图像,图2B和2C是对应的肿瘤组织18F-FAC摄取值%ID/gmax及其与对侧肌肉摄取值的比值(T/M)随时间定量变化关系图。对照组肾癌摄取18F-FAC随着时间明显升高,第5、10和15天的%ID/gmax分别为10.560±0.677、12.325±0.275和13.450±0.517,与基线值8.425±0.549相比差异均有统计学意义[P<0.05(第5天),P<0.01(第10和15天),图2A、B]。实验组肾癌组织摄取18F-FAC也随时间不断增加,但与对照组相比明显趋缓。第5、10和15天%ID/gmax分别为9.708±0.792、10.285±0.751和10.859±1.100,与基线值8.087 ± 0.792相比差异也均有统计学意义(P均<0.01)。进一步组间比较分析发现,基线时两组肿瘤组织的18F-FAC摄取值基本相当,差异无统计学意义;而在之后的时间点实验组摄取值均明显低于对照组,差异有统计学意义[P<0.01(第5天),P<0.05(第10和15天)]。本研究又采用T/M值分析肾癌的18F-FAC摄取变化,获得类似的结果,即除基线值相当外,实验组T/M均显著低于对照组,且各时间点差异均有统计学意义[P<0.01(第5和10天),P<0.001(第15天),图2C]。18F-FAC PET/CT显像实验结果说明,肾癌摄取18F-FAC随时间及干预处理呈动态变化,且和对照组比较,依维莫司的干预可以降低肾癌的脂肪酸代谢。
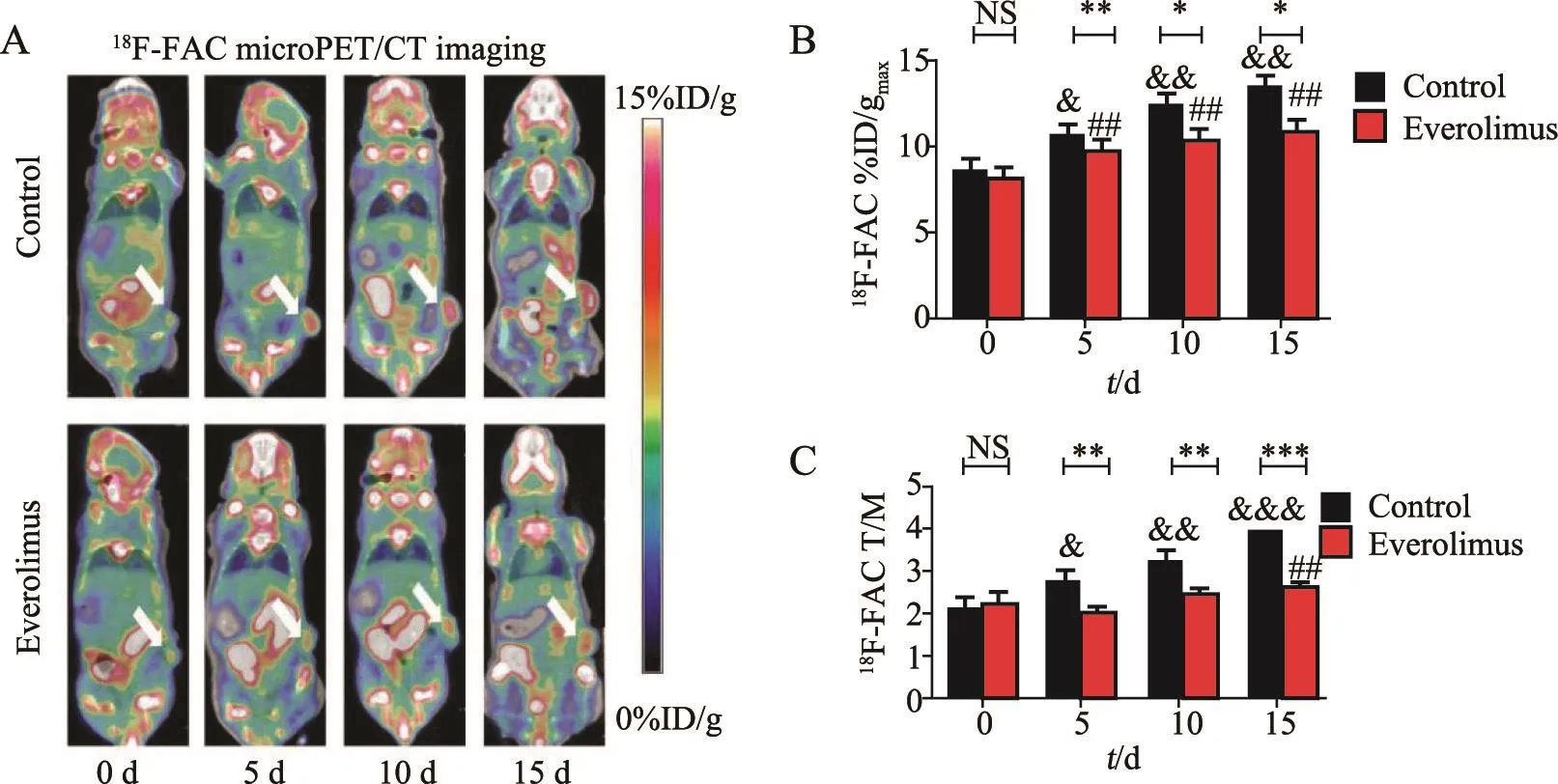
图2 18F-FAC小动物PET/CT显像及定量分析Fig2 18F-FAC microPET/CT imaging and the quantitative analysis
2.2 肾癌FAS表达的变化
图3A为肾癌组织的FAS免疫组织化学染色图像,其阳性表现为棕色的细胞质染色,图3B为对应的FAS表达水平的定量计算。结果显示,对照组肾癌组织FAS表达水平随时间推移明显升高,第5、10和15天的IOD/mm2分别为0.073±0.003、0.117±0.002和0.213±0.017,与基线值0.032±0.003相比差异均有统计学意义(P均<0.001)。实验组肾癌组织FAS表达程度随时间推移也在不断增加,但与对照组相比明显趋缓,第5、10和15天IOD/mm2分别为0.037±0.001、0.074±0.001和0.106±0.012,与基线值0.032±0.000相比差异也均有统计学意义[P<0.01(第5天),P<0.001(第10天),P<0.05(第15天)]。进一步组间对比发现,基线时两组肿瘤组织的FAS的表达水平基本相当,差异无统计学意义;而在之后的时间点实验组FAS表达均明显低于对照组,然而第5天的差异无统计学意义,第10和15天的差异均有统计学意义(P均<0.05)。免疫组织化学实验结果显示,肾癌FAS表达水平随时间及干预处理呈动态变化,与上述18F-FAC变化趋势一致,且和对照组比较,依维莫司干预可降低肾癌的FAS表达程度。

图3 FAS免疫组织化学染色及定量分析Fig3 IHC staining of FAS and the quantitative analysis
2.3 肾癌18F-FAC摄取与FAS表达的相关性
图4为肾癌18F-FAC摄取与FAS表达的相关性关系图。肾癌18F-FAC摄取(%ID/gmax)(图4A)和T/M(图4B)均与FAS表达具有良好的正向相关性(P均<0.001)。该实验结果进一步说明,18F-FAC摄取与FAS表达具有一致的变化趋势,即FAS表达升高,18F-FAC摄取增加,反之亦然。
2.4 依维莫司处理明显抑制肿瘤体积增长和延长荷瘤鼠的生存期
我们进一步开展了肿瘤体积变化和生存期实验,以观察依维莫司干预肾癌引起的抗肿瘤效应。实验组肿瘤生长缓慢,而对照组的肿瘤生长迅速,其肿瘤体积显著增大,并且两者的体积在第9天开始差异有统计学意义(图5A)。实验组荷瘤鼠的中位生存期为35 d,而对照组仅为23 d,差异有统计学意义(P<0.01,图5B)。该实验结果表明,依维莫司可抑制肾癌生长,延长ACHN荷瘤鼠中位生存期。
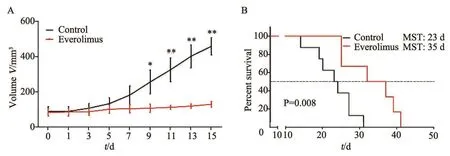
图5 依维莫司处理对肿瘤体积(A)和荷瘤鼠生存期(B)的影响Fig5 Effect of everolimus on tumor volume (A) and the survival (B) of ACHN tumor-bearing mice
3 讨 论
核素11C和18F等标记的11C-AC和18F-FAC在肾癌PET/CT显像方面具有重要的作用。自1995年Shreve等[14]首次将11C-AC用于肾脏肿瘤PET显像以来,11C-AC PET/CT在肾脏肿瘤的临床应用越来越多,认为其肾癌诊断的灵敏度明显高于18F-FDG[15-17]。近年来,有研究显示,18F-FAC PET/CT对肾癌亦有较高的诊断效能[6]。然而,到目前为止,还未见到18F-FAC PET/CT分子影像在体监测肾癌脂肪酸代谢的动态变化的报道,因而也不清楚肾癌摄取18F-FAC与脂肪酸代谢及FAS之间的关系。
本实验首先选择mTOR抑制剂依维莫司作为干预药物,将肾癌模型分为实验组和对照组,在药物干预前后的不同时间点,开展纵向性在体18F-FAC PET/CT显像和FAS免疫组织化学实验,以观察18F-FAC摄取与FAS表达的动态变化。目前,常见的有效抑制FAS表达的药物为苏氨酸和C75,然而,两者都会影响患者营养物质摄取,减轻体质量[18],这些因素阻碍了它们的临床应用。另外,根据本课题组前期研究经验,抑制剂量的C75容易导致实验鼠死亡。依维莫司是一种mTOR抑制剂,临床上已用于肾癌的二线治疗,同时已有研究提出PI3K/AKT/mTOR是FAS上游通路[19],可通过抑制mTOR从而抑制FAS基因及蛋白的表达,因此我们选择依维莫司作为建模干预药物。需要指出的是,为了确保实验结果不受干扰,我们设置了3个独立实验组,分别进行18F-FAC显像实验、FAS免疫组织化学实验及生存期观察实验。鉴于荷CWR22乳腺癌小鼠的18F-FAC PET/CT研究发现,在注射后2 h肿瘤与肌肉摄取的T/M比1 h高[20],因此,我们选择注射18F-FAC后2 h开展PET/CT显像。在体小动物microPET/CT显像结果表明,实验组肾癌18F-FAC摄取明显低于对照组。相应的免疫组织化学结果发现,实验组肿瘤组织FAS表达也均显著低于对照组。Yan等[19]采用另一种mTOR抑制剂雷帕霉素同样降低了乳腺癌细胞FAS蛋白表达,与该研究结果类似。
综合18F-FAC PET/CT显像和FAS免疫组织化学实验可见,肾癌摄取18F-FAC和FAS表达均随时间呈现出动态增加的变化趋势,而实验组的增加幅度明显小于对照组。Pflug等[21]通过对转基因前列腺癌小鼠模型的研究发现,随着小鼠周龄增加及疾病进展,FAS表达呈明显上升趋势。本实验也观察到对照组肿瘤FAS表达随时间推移不断上升。有研究表明,肿瘤负荷越高,FAS表达也越高[22-23],因此,本实验中肾癌FAS表达水平随时间推移而升高的可能原因是肿瘤负荷在不断增加,脂肪酸代谢越来越旺盛。且第5天对照组肾癌FAS表达水平明显高于基线值(2.2倍),这与前期研究结果一致[24-25]。Furuta等[24]在乏氧和存在活性氧自由基环境中(模拟肿瘤微环境),培养乳腺癌细胞,FAS基因及蛋白表达明显上调。其中在氧自由基存在条件下,12 h后MDA-MB-157乳腺癌细胞FAS mRNA表达水平增加约3倍。Lee等[25]发现在乏氧环境下,24 h后UCB-hMSC干细胞FAS表达增加2倍。此外,依维莫司处理期间FAS表达仍然缓慢增加,可能原因是抑制FAS并非依维莫司的主要药理作用[26],FAS表达也可能受其他多种因素调节,如乙酰转移酶P300[27]。进一步的相关性分析发现,肾癌组织18F-FAC摄取与FAS表达程度之间呈显著正相关。这些都说明两者具有一致的变化趋势,即FAS表达升高,18F-FAC摄取增加,反之亦然。
我们继续开展了肿瘤体积变化和生存期实验,以观察依维莫司处理肾癌引起的抗肿瘤效应。实验组肿瘤体积较对照组明显缩小,生存期则明显延长。由此可见,依维莫司既能降低肾癌脂肪酸代谢和FAS表达,又具有明显抑制肾癌生长的作用。
本实验室的前期研究已经评估了18F-FAC人体器官的内照射剂量[28],结果显示,全身有效剂量低于国际辐射防护委员会(International Commission on Radiological Protection,ICRP)发布的ICRP 118号报告[29]中关于个人每年最高有效剂量限值。其他研究也证明了18F-FAC的安全性,适合于人体显像[30]。由此可见,18F-FAC是安全有效的PET显像剂,其PET/CT显像在临床应用中将有广阔的前景。
综上所述,我们开展了纵向性、多时间点的在体肾癌18F-FAC PET/CT分子影像学研究,发现了肾癌摄取18F-FAC的动态变化与FAS表达的变化趋势一致,并且二者具有良好的正向相关性。因此,本研究认为18F-FAC PET/CT显像可用于在体监测肾癌脂肪酸代谢动态变化,也有望用于靶向抗脂肪酸代谢药物的疗效评价。
[1] CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132.
[2] 孙盼盼, 刘 莉, 平智广, 等. 不同地区癌症发病分布特征及聚类分析[J]. 中国癌症杂志, 2016, 26(6): 499-507.
[3] HORIGUCHI A, ASANO T, ASANO T, et al. Fatty acid synthase over expression is an indicator of tumor aggressiveness and poor prognosis in renal cell carcinoma[J]. J Urol, 2008,180(3): 1137-1140.
[4] 徐俊彦, 章英剑, 程竞仪, 等.11C-乙酸联合18F-FDG PET/CT显像在肾占位鉴别诊断中的应用价值[J]. 肿瘤影像学,2014, 23(2): 137-142.
[5] 徐俊彦, 郑宇佳, 罗建民, 等. 肾癌摄取11C-乙酸的分子机制及相关研究[J]. 肿瘤影像学, 2014(3): 200-204.
[6] VAVERE A L, KRIDEL S J, WHEELER F B, et al.1-11C-acetate as a PET radiopharmaceutical for imaging fatty acid synthase expression in prostate cancer[J]. J Nucl Med,2008, 49(2): 327-334.
[7] 何婷婷, 王 卉, 徐白萱, 等. 不同侵袭转移特性肝癌模型的18F-FDG和2-18F-乙酸盐联合显像[J]. 中国临床医学影像杂志, 2016, 27(4): 267-270.
[8] 周 硕, 朱庆国, 叶烈夫, 等.18F-氟乙酸联合18F-FDG PET/CT显像在肾肿瘤鉴别诊断中的价值[J]. 大连医科大学学报, 2016, 38(4):340-343.
[9] CARON A, RICHARD D, LAPLANTE M. The roles of mTOR complexes in lipid metabolism[J]. Annu Rev Nutr, 2015,35(1): 321-348.
[10] CORNU M, OPPLIGER W, ALBERT V, et al. Hepatic mTORC1 controls locomotor activity, body temperature, and lipid metabolism through FGF21[J]. Proc Natl Acad Sci U S A, 2014, 111(32): 11592-11599.
[11] VAN DE SANDE T, DE SCHRIJVER E, HEYNS W, et al. Role of the phosphatidylinositol 3’-kinase/PTEN/Akt kinase pathway in the overexpression of fatty acid synthase in LNCaP prostate cancer cells[J]. Cancer Res, 2002, 62(3): 642-646.
[12] LIU D D, HAN C C, WAN H F, et al. Effects of inhibiting PI3K-Akt-mTOR pathway on lipid metabolism homeostasis in goose primary hepatocytes[J]. Animal, 2016, 10(8): 1319-1327.
[13] 张勇平, 章英剑, 王明伟, 等. 利用Explora FDG4模块进行18F-氟乙酸盐自动化合成[J]. 中华核医学与分子影像杂志, 2009, 29(3): 185-188.
[14] SHREVE P, CHIAO P C, HUMES H D, et al. Carbon-11-acetate PET imaging in renal disease[J]. J Nucl Med, 1995,36(9): 1595-1601.
[15] OYAMA N, ITO H, TAKAHARA N, et al. Diagnosis of complex renal cystic masses and solid renal lesions using PET imaging:comparison of11C-acetate and18F-FDG PET imaging[J].Clin Nucl Med, 2014, 39(3): e208-e214.
[16] HO C L, CHEN S, HO K M, et al. Dual-tracer PET/CT in renal angiomyolipoma and subtypes of renal cell carcinoma[J].Clin Nucl Med, 2012, 37(11): 1075-1082.
[17] OYAMA N, OKAZAWA H, KUSUKAWA N, et al.11C-acetate PET imaging for renal cell carcinoma[J]. Eur J Nucl Med Mol Imaging, 2009, 36(3): 422-427.
[18] MENENDEZ J A, VELLON L, MEHMI I, et al. Inhibition of fatty acid synthase (FAS) suppresses HER2/neu (erbB-2)oncogene overexpression in cancer cells[J]. Proc Natl Acad Sci U S A, 2004, 101(29): 10715-10720.
[19] YAN C, WEI H, MINJUAN Z, et al. The mTOR inhibitor rapamycin synergizes with a fatty acid synthase inhibitor to induce cytotoxicity in ER/HER2-positive breast cancer cells[J]. PLoS One, 2014, 9(5): e97697.
[20] PONDE D E, DENCE C S, OYAMA N, et al.18F-fluoroacetate:a potential acetate analog for prostate tumor imaging-in vivo evaluation of18F-fluoroacetate versus11C-acetate[J]. J Nucl Med, 2007, 48(3): 420-428.
[21] PFLUG B R, PECHER S M, BRINK A W, et al. Increased fatty acid synthase expression and activity during progression of prostate cancer in the TRAMP model[J]. Prostate, 2003,57(3): 245-254.
[22] MIGITA T, RUIZ S, FORNARI A, et al. Fatty acid synthase: a metabolic enzyme and candidate oncogene in prostate cancer[J]. J Natl Cancer Inst, 2009, 101(7): 519-532.
[23] VAZQUEZ-MARTIN A, COLOMER R, BRUNET J, et al.Overexpression of fatty acid synthase gene activates HER1/HER2 tyrosine kinase receptors in human breast epithelial cells[J]. Cell Prolif, 2008, 41(1): 59-85.
[24] FURUTA E, PAI S K, ZHAN R, et al. Fatty acid synthase gene is up-regulated by hypoxia via activation of Akt and sterol regulatory element binding protein-1[J]. Cancer Res, 2008,68(4): 1003-1011.
[25] LEE H J, RRU J M, JUNG Y H, et al. Novel pathway for hypoxia-induced proliferation and migration in human mesenchymal stem cells: involvement of HIF-1α, FASN, and mTORC1[J]. Stem Cells, 2015, 33(7): 2182-2195.
[26] 马建辉. 肾癌细胞mTOR信号通路异常与依维莫司作用机制[J]. 中华泌尿外科杂志, 2013, 34(3): 229-231.
[27] 刚晓坤. 乙酰转移酶p300对脂肪酸合成的调控机制及其在前列腺癌中的作用[D]. 吉林大学, 2015.
[28] ZHANG J P, ZHANG Y J, XU J Y, et al. Radiation dosimetry estimates of18F-fluoroacetate based on biodistribution data of rats[J]. Appl Radiat Isot, 2012, 70(1): 332-335.
[29] STEWART F A, AKLEYEV A V, HAUER-JENSEN M, et al.ICRP publication 118: ICRP statement on tissue reactions and early and late effects of radiation in normal tissues and organsthreshold doses for tissue reactions in a radiation protection context[J]. Ann Icrp, 2012, 41(1-2): 1-322.
[30] NISHII R, TONG W, WENDT R R, et al. Pharmacokinetics,metabolism, biodistribution, radiation dosimetry, and toxicology of18F-fluoroacetate (18F-FACE) in non-human primates[J].Mol Imaging Biol, 2012, 14(2): 213-224.

