腐熟堆肥中维素降解菌筛选鉴定及酶学特性研究
周东兴,王广栋,邬欣慧, 宁玉翠,李 晶,李 磊,曹 旭
(1.东北农业大学资源与环境学院,哈尔滨 150030;2.黑龙江省科学院微生物研究所,哈尔滨 150030)
我国是农业大国,每年农作物秸秆年产量高达7亿t[1],但利用率仅3%,每年有超过70%秸秆作为燃料或在田间被直接焚烧,污染环境。纤维素作为秸秆主要成分,是自然界中数量最大、分布最广泛、来源最丰富的碳水化合物,也是地球上数量最大可再生资源之一[2]。纤维素具有降解困难、降解率低特性[3-4],高效、充分利用纤维素成为研究热点[5-6]。传统物理、化学降解成本高,难以大规模推广并应用。近年开发的新纤维素资源利用技术,仍存在转化利用率低、时间长等问题[7]。利用微生物产生纤维素酶降解纤维素,具有条件温和、产物产率高和无二次污染等特点,成为目前有效且更接近自然生态的纤维素处理方法[8]。研究者从筛选纤维素酶生产菌[9]和优化菌产纤维素酶条件[10]等方面开展研究。纤维素酶来源广泛,昆虫、软体动物、原生动物、细菌、放线菌、真菌等均可产生纤维素酶[11],发现高效降解纤维素微生物是研究重点。
堆肥中含有大量纤维素降解微生物,刘晓梅等利用杏鲍菇菌渣分离筛选出高效纤维素菌株为菌渣发酵腐熟堆肥提供优质菌种[12],易旻等从鸡粪蘑菇渣高温堆肥中解淀粉芽孢杆菌[13],张喜庆从自然发酵牛粪中筛选一株枯草芽孢杆菌,在堆肥发酵方面具有较大应用潜力[14]。本研究从以牛粪和秸秆为原材料腐熟堆肥中筛选具有较强纤维素降解能力菌株,采用纤维素刚果红平板识别、滤纸崩解试验初筛及液体发酵产酶复筛法得到2株产CMC酶活和FPA酶活较高菌株(枯草芽孢杆菌与隐球酵母菌),并以羧甲基纤维素钠为主要碳源培养基研究其产酶性能,分类鉴定菌株,以期为秸秆快速腐解提供优质菌种。
1 材料与方法
1.1 材料
牛粪和秸秆以质量1∶1混合发酵堆肥,供试玉米秸秆和畜禽粪便均取自哈尔滨市周边养殖户。玉米秸秆经晒干、粉碎,畜禽粪便为牛粪,晒干备用。
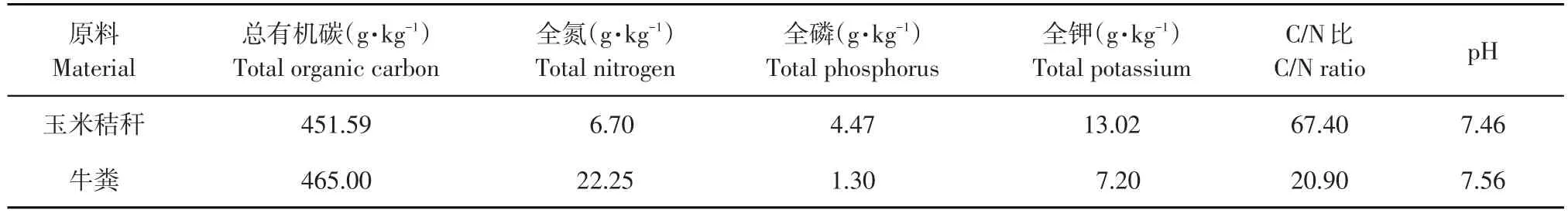
表1 堆肥物料基本化学性质Table 1 Chemical properties of compost materials
1.2 方法
1.2.1 菌株分离与纯化
取堆肥物10.0 g,无菌条件下加入装90 mL无菌水摇瓶。置于摇床上,30℃下振荡培养15 min。取上清液5 mL加入45 mL无菌水中,梯度稀释成10-1至10-5浓度梯度,常规划线法接种于NYD培养基[15]上,30℃恒温培养2 d。培养后分离平板菌落计数后挑选形态差异明显菌落,重复划线接种于培养基,直至纯化得到单菌落。
1.2.2 纤维素降解菌初筛
采用刚果红培养基[16]水解圈指标对纯化菌株初筛[7]。30℃下于NYD培养基上培养48 h活化菌种,刚果红培养基上点接菌株,经3~4 d培养,分别测定水解圈直径(D)和菌落直径(d),计算D/d比值(即HC比值),挑取生长速度快且HC值较大菌株纯化和保种,作为初筛菌株。
1.2.3 纤维素降解菌复筛
种子培养液配制:将菌种接种到液体发酵培养基[18]中,置于振荡培养箱中30℃、180 r·min-1振荡培养2 d,制成种子培养液备用。
粗酶液制备:取3%种子培养液接种于产酶培养基中,三角瓶摇床培养,取定量培养液,4 000 r·min-1下离心20 min上清液即粗酶液,粗酶液应马上使用,若暂时不用置于4℃冰箱中冷藏,以免失活。
将初筛获得菌株接种到液体发酵培养基中发酵培养,30℃,180 r·min-1振荡培养4 d,测其粗酶液CMC酶活和FPA酶活,选出酶活力高产菌株,作为复筛菌株。
1.2.4 酶活力测定
CMC酶活、FPA酶活测定分别参照文献[19-20]方法。酶活按国际单位规定:每分钟催化纤维素水解生成1 μmol葡萄糖酶量为一个酶活力,单位IU。
1.2.5 滤纸崩解试验
移取5 mL粗酶液到滤纸条培养基[21]中,并以不加菌液滤纸条作为对照,在与初筛温度相同条件下培养10 d,观察滤纸条溃烂情况,以“+”表示滤纸崩溃程度,“+”越多说明该菌株纤维素降解能力越强[22]。将滤纸条用水轻轻冲洗,60℃烘干至恒重后称重计算滤纸失重率[23]。
1.2.6 纤维素降解菌产酶条件研究
①培养时间对菌株酶活影响。在容积为150 mL三角瓶中,装入50 mL液体发酵培养基,分别取3%1号和7号菌株种子培养液接种于其中,30℃下180 r·min-1摇振培养,分别于12、24、48、72、96、120、144 h取样测定 CMC酶活和FPA酶活。
②调节初始液体发酵培养基pH,研究初始pH对菌株酶活影响[24]。在容积150 mL三角瓶中,分别装入50 mL起始pH分别为4.0、4.5、5.5、6.5、7.0、7.5、8.0、9.0、10.0液体发酵培养基,分别取3%1号和7号菌株种子培养液接种于不同pH液体发酵培养基中,30℃下180 r·min-1摇振培养48 h,取样测定CMC酶活和FPA酶活。
1.3 纤维素分解菌鉴定
1.3.1 菌种形态观察及生理生化特性
将所获菌株划线接种于LB固体培养基,37℃恒温培养箱中倒置培养24 h,观察菌株生长状况和菌落形态特征及革兰氏染色表现,光学显微镜观察。吲哚试验、V-P试验、淀粉水解、明胶水解等主要生理生化特征参考《伯杰氏细菌鉴定手册》[25]和《常见细菌系统鉴定手册》[26]方法测定。
1.3.2 菌种分子生物学鉴定
采用Ezup柱式细菌基因组DNA抽提试剂盒提取菌株基因组DNA,使用引物7 F(5'CAGAGTT TGATCCTGGCT3')和 1540 R(5'AGGAGGTGATCC AGCCGCA3')对菌株16S rDNA序列扩增。酵母菌26S rDNA D1/D2区域基因序列分析以提取酵母菌总DNA为模板,用真菌26S rDNA D1/D2区通用引物 NL1(NL1∶5'GCATATCAATAAGCGGAAAAG3')和NL4(5'GGTCCGTGTTTCAAGACG3')作为上下游引物,扩增菌株26S rDNA D1/D2区域片段。PCR条件为:94℃预变性4 min,94℃变性45 s,56℃退火45s,72℃延伸1min,72℃修复延伸10min,4℃保存。
获得PCR产物送至上海生工生物工程技术服务有限公司测序,将所得序列通过Blast程序和GenBank核酸数据在美国国立生物技术信息中心(National Center of Biotechnology Information,NCBI)数据库比对分析,MEGA5.0软件构建系统发育进化树。
2 结果与分析
2.1 菌落统计及菌落形态描述
本试验筛选10株菌落形态具有明显特征菌株,观察其菌落和菌种形态特征,描述菌落形态,结果见表2。
2.2 纤维素降解菌分离与筛选
将纯化菌株转接至刚果红培养基,培养2 d后测量透明圈直径和菌落直径见表3,由表3知,共4株菌产生较为清晰透明圈,选取HC(D/d)比值≥3菌株下一步筛选试验。
2.3 初筛菌株滤纸条降解效果
将初筛菌株滤纸条降解试验,结果见表4。可知,添加7号菌株滤纸溃烂成糊状,滤纸条失重率为52.01%;添加1号菌株滤纸条接近糊状,失重率为49.23%;添加2号和9号菌株滤纸条仅存在明显弯曲现象,但未呈糊状;3、4、5、8号菌株对滤纸条降解作用较小,滤纸未断裂,仅边缘出现毛边;6号和10号对滤纸条基本不降解。因此,1
号和7号菌株对滤纸条降解能力较强。
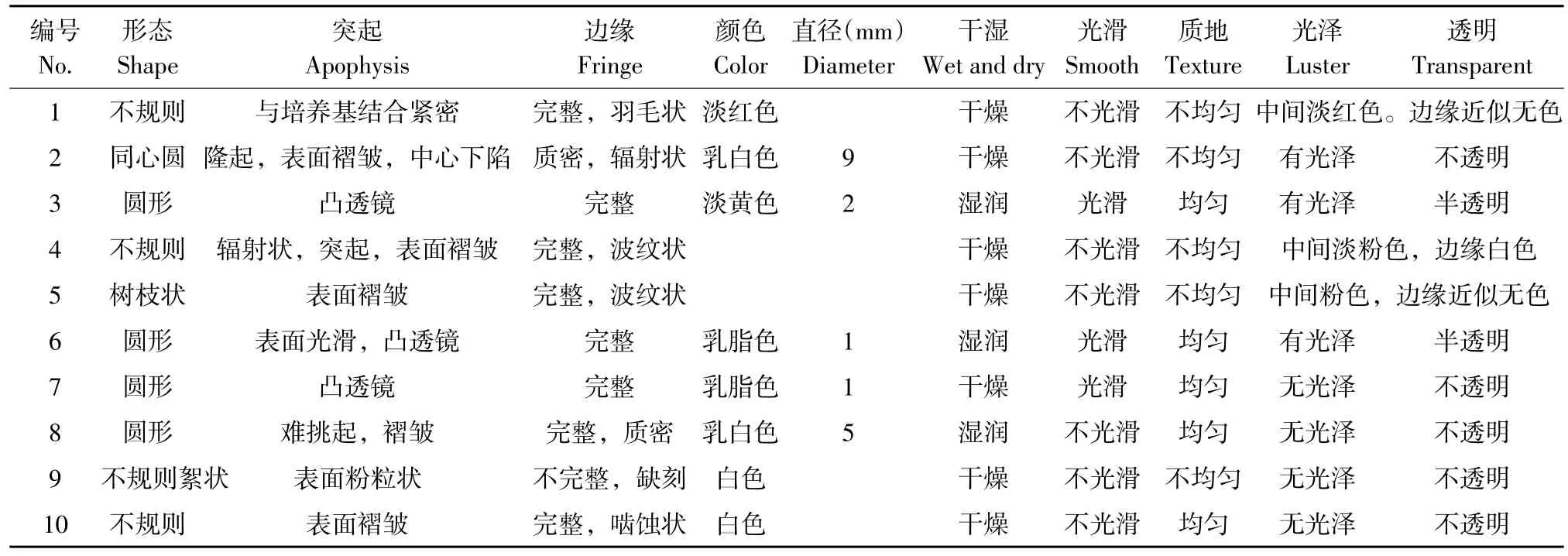
表2 分离得到菌株菌落形态Table 2 Morphology of strains screened from enrichment cultivation
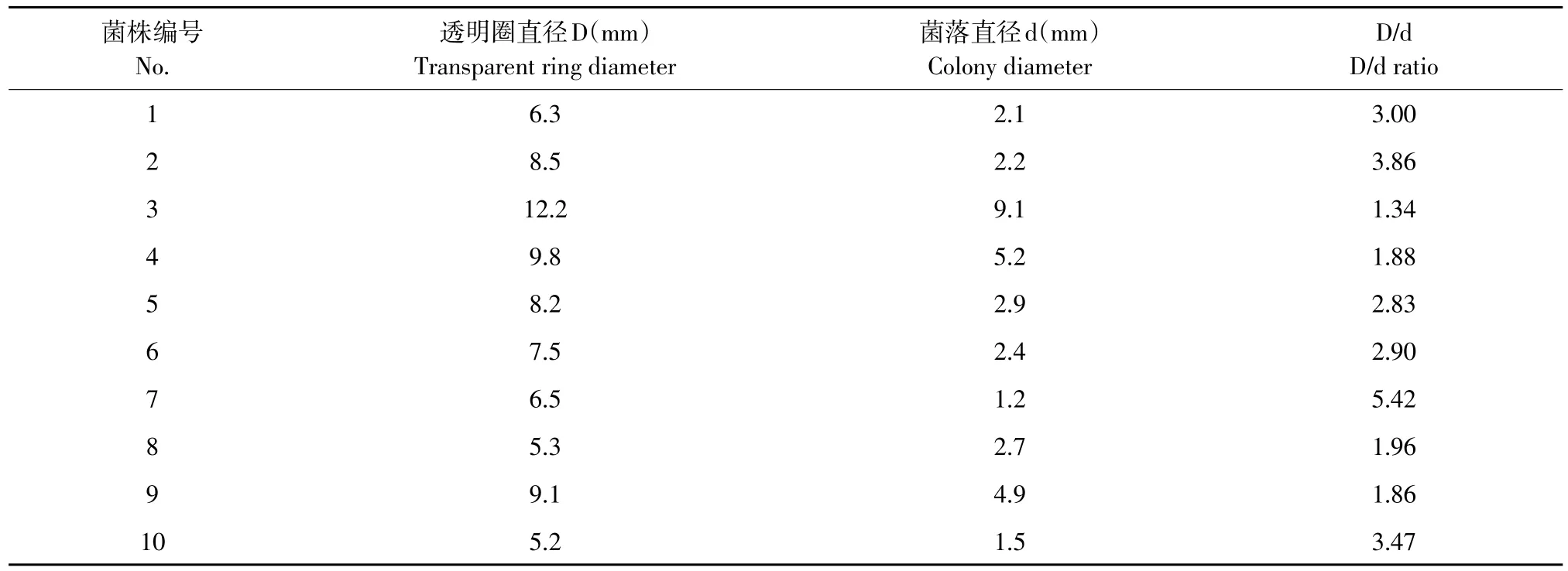
表3 纤维素降解菌透明圈直径和菌落直径Table 3 Diameters of transparent circles and colonies of strains
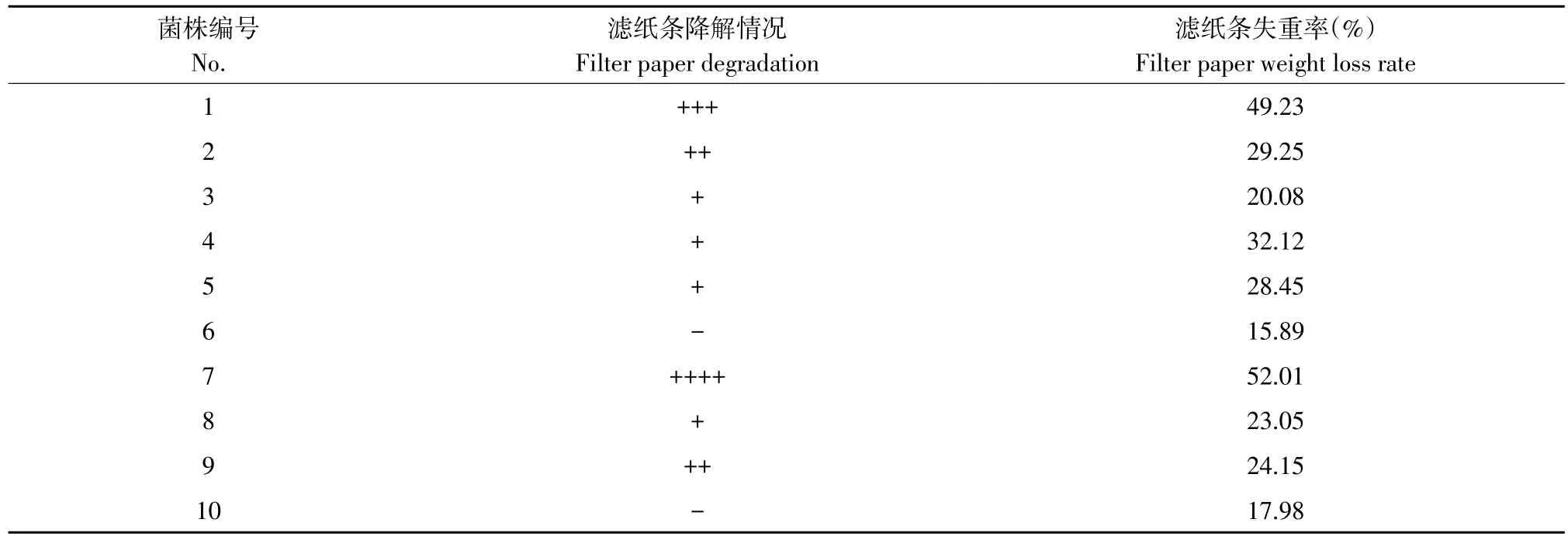
表4 纤维素降解菌对滤纸条降解结果Table 4 Filter paper degradation capacity of the celluloses degrading microbes
2.4 酶活力测定结果
将菌株置于液体发酵培养基中发酵培养2 d,设置3次重复,测定纤维素酶活和滤纸酶活,滤纸条降解效果、HC比值共同评价降解效果,复筛。最终得到2株CMC酶活和FPA酶活较高菌株(见图1)。降解滤纸能力强菌株1号和7号CMC酶活和FPA酶活均较高,1号和7号菌株CMC酶活分别达26.82和31.28 U·mL-1,FPA酶活分别达20.32和30.82 U·mL-1,高于其他菌株。因此,将1号和7号菌株作为复筛菌,发酵产酶条件分析。
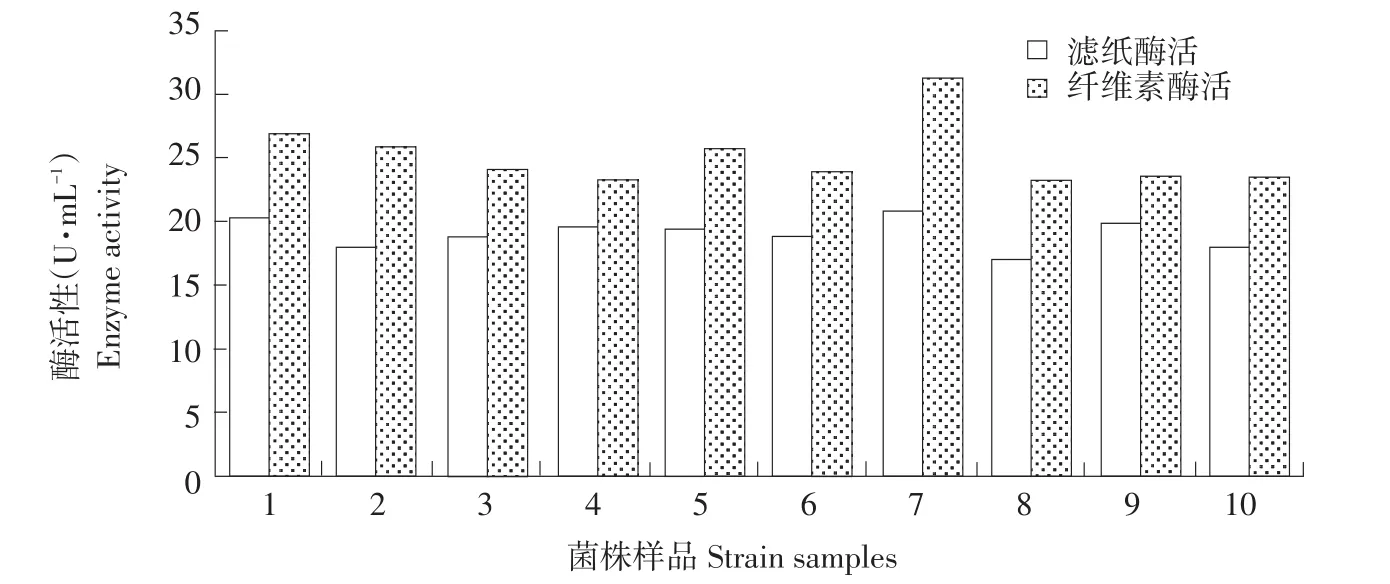
图1 纤维素降解菌株酶活性Fig.1 Enzyme activities of celluloses degrading microbes
2.5 纤维素降解菌产酶条件
2.5.1 培养时间对菌株酶活力影响
由图2可知,0~48 h内,两种酶活均随培养时间增加而增加,在48~72 h内,FPA酶活力轻微下降,但基本处于稳定;而纤维素酶活迅速下降,说明培养时间对CMC酶活影响高于FPA酶活。因此,应将48 h作为菌株最优产酶时间。
2.5.2 培养基初始pH值对菌株产酶影响
培养基初始pH值对菌株产酶影响见图3。
由图3可知,当pH在4.0~10.0范围时,CMC酶活和FPA酶活性随pH增加迅速升高,至pH为6.0左右达到最大值;当pH 6.0~7.0之间时,酶活性基本稳定;pH超过7.5时,酶活性开始逐渐降低,说明中性条件下,1号和7号菌株发酵产酶活力较高。因此,将pH为6.5作为最佳产酶pH。
2.6 纤维素降解菌分子生物学鉴定
2.6.1 16S rDNA鉴定
将测序在NCBI中比对,发现其与枯草芽孢杆菌属(Bacillus subtilis)16S rDNA序列一致性高达100%。结合菌株形态学观察、生理生化特征及扫描电镜图(见表5和图4),可判定该菌是Bacillus subtilis。将所得全部序列提交GenBank数据库,其登录号为MF592134。通过CLustal W软件作序列比较和MEGA 5.0软件分析得到以16S rDNA序列为基础构建系统发育树(见图5)。结果表明1号菌株与Bacillus subtilis亲缘关系较近。PCR产物片段经电泳检测(见图8),图中有明显单一条带,长度约为1 400 bp,与Bacillus subtilis片段长度一致。
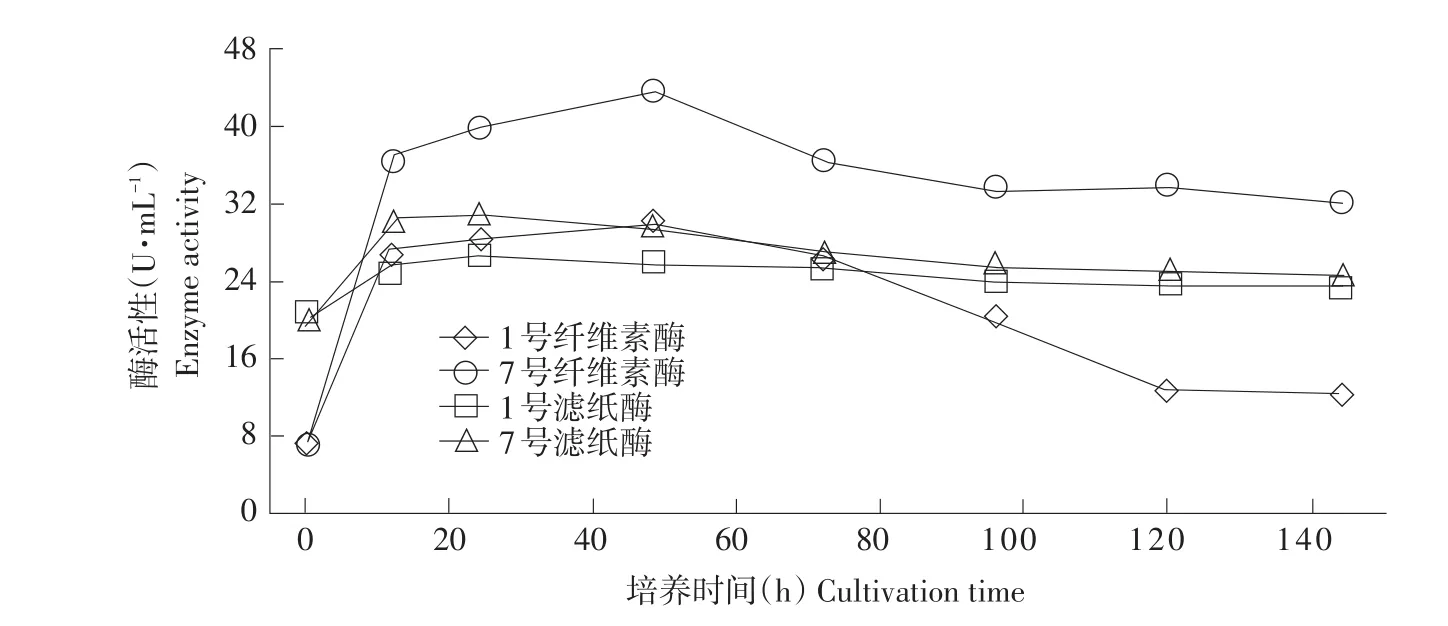
图2 培养时间对酶活性影响Fig.2 Effect of culture time on enzyme activities
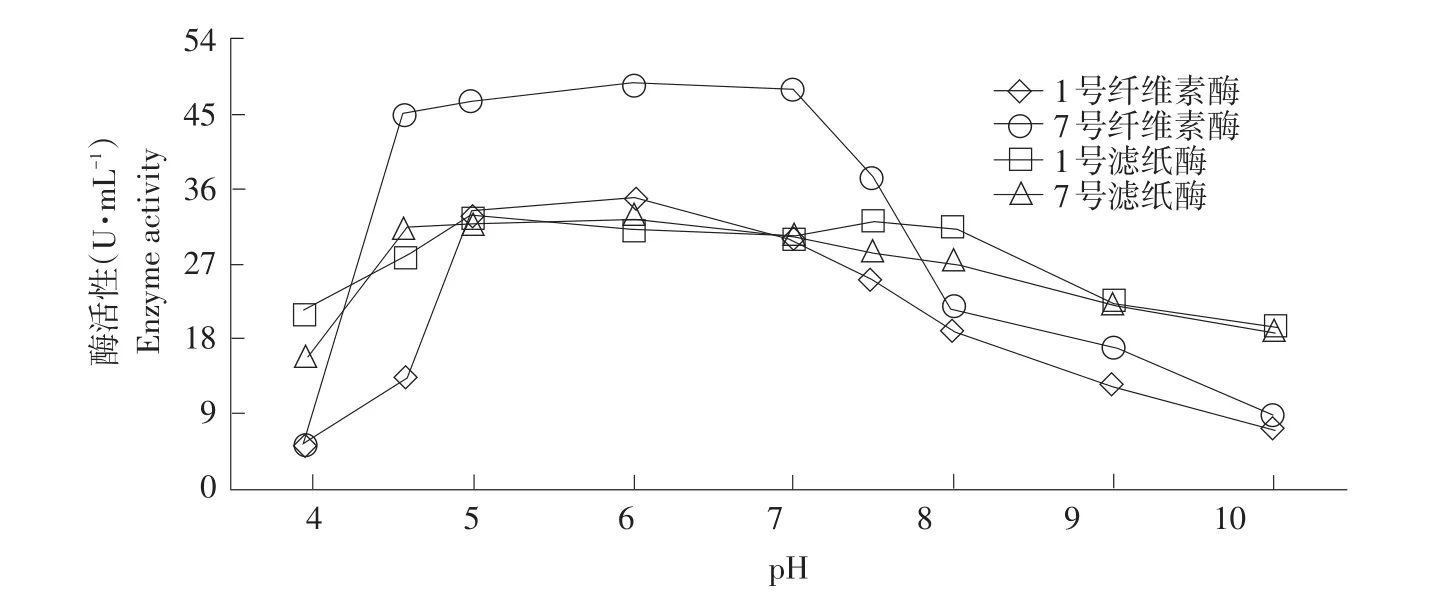
图3 pH对酶活性影响Fig.3 Effect of pH on enzyme activity

表5 1号菌株生理生化鉴定结果Table 5 Physiological and biochemical identification result of strain1

图5 菌株1基于16S rDNA序列同源性构建系统发育树Fig.5 Phylogenetic tree of strains 1 based on 16S rDNA sequence homology

图4 菌株1扫描电镜图Fig.4 SEM picture of strain 1
2.6.2 26S rDNA鉴定
将26S rDNA D1/D2区序列在NCBI中比对,发现与7号菌株相似性最高类群为隐球酵母菌(Cryptococcus flavescens),相似性达100%,该菌株在平板上菌株形态为圆形或者卵圆形,菌落为乳脂色、圆形、凸起、边缘光滑,观察扫描电镜中菌落形态(见图6)。
通过CLustal W软件多序列比较和MEGA 5.0软件分析得到以26S rDNA序列为基础构建系统发育树(见图7)。结果表明7号菌株与Cryptococcus flavescens亲缘关系较近。将所得全部序列提交GenBank数据库,其登录号为MF620126(26S rDNA D1/D2序列)。以NL1和NL4作为上下游引物,扩增菌株26S rDNAD1/D2区域片段,片段长度在506 bp,电泳结果见图6,图中7号菌株片段长度与Cryptococcus flavescens一致。

图6 菌株7扫描电镜图Fig.6 SEM picture of strain 7
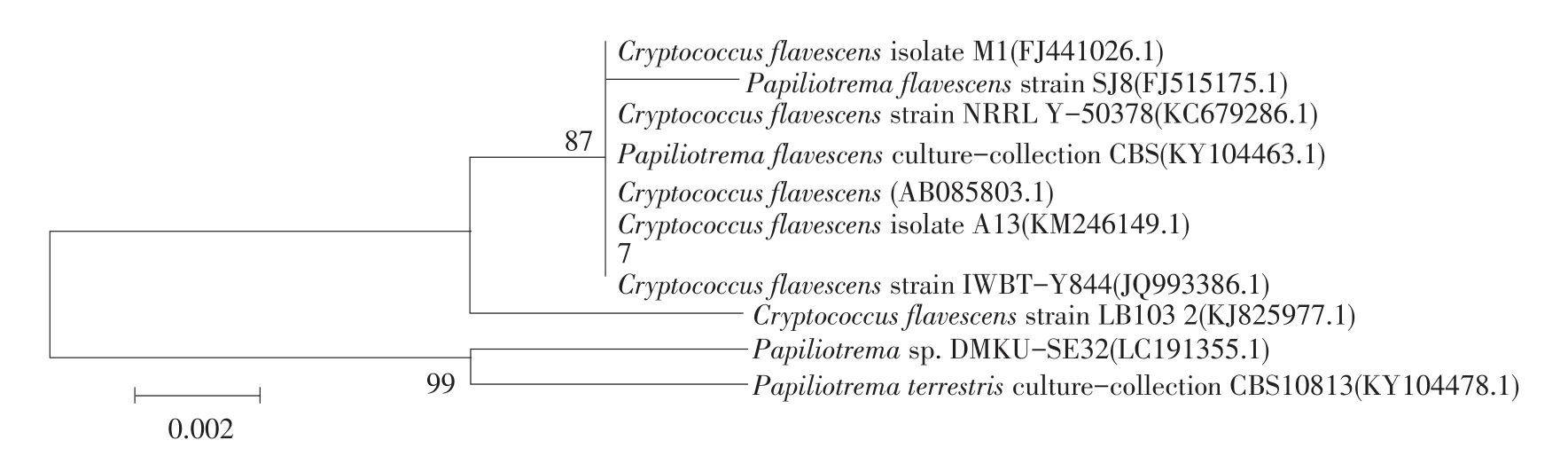
图7 菌株7基于26S rDNA序列同源性构建系统发育树Fig.7 Phylogenetic tree of strains 7 based on 26S rDNA sequence homology
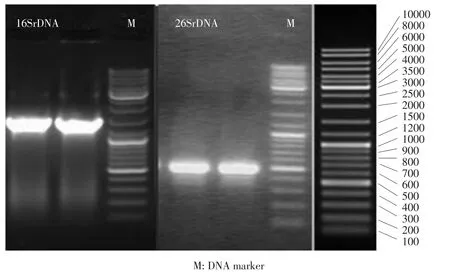
图8 菌株Bacillus subtilis与Cryptococcus flavescens凝胶电泳Fig.8 Analysis of strain Bacillus subtilis and Cryptococcus flavescens fragment amplified by gel electrophoresis
3 讨论
本试验筛选菌株1号属于芽胞杆菌属,与枯草芽胞杆菌(Bacillus subtilis)生理生化特征相似,其CMC酶活可达26.82 U·mL-1,FPA酶活可达20.32 U·mL-1。测定其生长特性,发现菌株1号最适生长pH为6.5,芽胞杆菌具有耐碱、耐酸、耐高温等明显优势,适应环境能力很强,便于实际操作和工业生产[27-28]。李春凤等研究表明,枯草芽孢杆菌生物同化作用较强,可有效降低粪便中吲哚、氨气等有害气体浓度,有利于粪便资源化利用[29]。
菌株7号属于隐球酵母菌(Cryptococcus flavescens),其CMC酶活达31.28 U·mL-1,FPA酶活达30.82 U·mL-1。隐球酵母是一种用于采后保鲜的生防酵母菌[30],具有拮抗效果好、抑菌谱广、营养要求低、生长快、不产生毒素、对多数化学杀菌剂不敏感等特点[31],可与多种化学及物理方法结合使用,防治果实采后病害[32]。目前,国内堆肥发酵研究尚无有关隐球酵母对堆肥效果影响报道,该菌株对纤维素降解效果研究相对较少。
纤维素酶活力决定菌株对纤维素物质分解能力。刘清锋等对产纤维素酶菌株青霉T24-2优化后,获得最大滤纸酶活力和内切酶活力分别为6.89、45.01 U·mL-1[33];李保深等研究对秸秆降解效果较好的斜卧青霉产酶条件,28℃、120 r·min-1培养4 d,滤纸酶活力和内切酶活力分别达7.085、3.856 IU·mL-1[34]。本试验筛选出菌株1号和7号在30℃、pH 6.5培养48 h,FPA酶活和CMC酶活分别可达20.32、26.82 U·mL-1和30.82、31.28 U·mL-1,高于以上报道真菌和放线菌酶活力。说明2株细菌属于高产优良纤维素分解菌,有利于堆体中纤维素物质降解。本试验仅研究不同pH和培养时间条件下菌株产酶情况,由于酶产生和酶活力受诸多因素影响[35-36],试验菌株产酶条件有待进一步优化。
4 结论
以刚果红培养基和滤纸条降解试验作为初筛,从中选出透明圈与菌落直径比值较大、滤纸条分解能力较强菌株,并对其液体发酵培养,测定酶活力,得到CMC酶活和FPA酶活均较高2株菌——1号和7号。采用形态学、生理生化特征、16S rDNA及26S rDNA鉴定方法,初步确定1号菌属于枯草芽孢杆菌(Bacillus subtilis),7号菌属于隐球酵母菌(Cryptococcus flavescens)。
研究枯草芽孢杆菌与隐球酵母在羧甲基纤维素钠为唯一碳源产酶培养基中产酶特性,结果表明,1号和7号在刚果红培养基上培养48 h后HC(D/d)比值为3.00、5.42,在pH 6.5,培养时间48 h条件下,1号和7号菌株CMC酶活达26.82和31.28 U·mL-1,FPA酶活达20.32和30.82 U·mL-1。
[1] Hasunuma T,Okazaki F,Okai N.A review of enzymes and microbes for lignocellosic biorefinery and the possibility of their application to consolidated bioprocessing technology[J].Bioresource Technology,2013,135(39):513-522.
[2] 石文卿,陶能国,刘跃进,等.一株高产纤维素酶真菌的分离及产酶特性研究[J].环境工程学报,2011,5(6):1435-1440.
[3] 耿丽平,陆秀君,赵全利,等.草酸青霉菌产酶条件优化及其秸秆腐解能力[J].农业工程学报,2014,30(3):170-179.
[4] Boyarsky A,Ruchayskiy O.Characterization of thermostable cellulases produced by Bacillus and Geobacillus strains[J].Bioresource Technology,2010,101(22):8798-8806.
[5] Park I,Kim I,Kang K,et al.Cellulose ethanol production from waste newsprint by simultaneous saccharifi cation and fermentation using Saccharomyces cerevisiae KNU5377[J].Process Biochemistry,2010,45(4):487-492.
[6] Cardona C A,Sánchez O J.Fuel ethanol production:Process design trends and integration opportunities[J].Bioresource Technology,2007,98(12):2415-2457.
[7] Goh C S,Tan K T,Lee K T,et al.Bioethanol from lignocellulose:Status,perspectives and challenges in Malaysia[J].Bioresource Technology,2010,101(13):4834-4841.
[8] 刘锁珠,李龙,付冠华,等.藏猪源高产纤维素酶菌株的筛选及鉴定[J].西北农林科技大学学报:自然科学版,2017,45(3):43-49.
[9] Maki M,Leung K T,Qin W S.The prospects of cellulase-producing bacteria for the bioconversion of Lignocelleulosic biomass[J].International Journal of Biological Sciences,2009,5(5):500-516.
[10] 胡海红,孙继颖,高聚林,等.低温高效降解玉米秸秆复合菌系发酵条件优化及腐解菌剂的研究[J].农业环境科学学报,2016,35(8):1602-1609.
[11] 张耿崚,韩业钜,陈细妹,等.产纤维素酶嗜热地芽孢杆菌HTA426的筛选鉴定、酶学性质分析及其应用[J].环境科学学报,2017,37(4):1444-1453.
[12] 刘晓梅,邹亚杰,胡清秀,等.菌渣纤维素降解菌的筛选与鉴定[J].农业环境科学学报,2015,34(7):1384-1391.
[13] 易旻,杨玉婷,李梦霖,等.一株耐高温纤维素降解菌的分离筛选及鉴定[J].吉首大学学报:自然科学版,2017,38(4):72-77.
[14] 张喜庆,勾长龙,娄玉杰,等.高效纤维素分解菌的分离鉴定及堆肥效果研究[J].农业环境科学学报,2016,35(2):380-386.
[15] Krogh K B R M,Kastberg H,Jrgensen C I,et al.Cloning of a GH5 endoglucanase from genus Penicillium and its binding to different lignins[J].Enzyme and Microbial Technology,2009,44(6):359-367.
[16] Zhang Y H.Reviewing the carbohydrate economy via multiproduct Lignocellulose biorefineries[J].Journal of industrial Microbiology&Bbiotechnology,2008,35(5):367-375.
[17] Emsley A M.Cellulosic ethanol reignites the fire of cellulose degradation cellulose[J].Cellulose,2008,15(2):187-192.
[18] Wada M,Ike M,Tokuyasu K.Enzymatic hydrolysis of cellulose I is greatly accelerated via its conversion to the cellulose II hydrate form[J].Polymer Degradation and Stability,2010,95(4):543-548.
[19] 国家发展和改革委员会.QB 2583—2003纤维素酶制剂[S].北京:中国轻工业出版社,2004.
[20] 刘洁,李宪臻,高培基.纤维素酶测定方法评述[J].工业微生物,1994,24(4):27-32.
[21] Himmel M E,Ding S Y,Johnson D K,et al.Biomass recalcitrance:Engineering plants and enzymes for biofuel production[J].Science,2007,315:804-807.
[22] 郑豪盈,樊永欣,张林,等.书虱伴生菌中纤维素酶产生菌的筛选、鉴定及最佳产酶发酵条件的优化[J].环境工程学报,2015,9(8):4090-4096.
[23] Dinis M J,Bezerra R M,Nunes F,et al.Modifieation of wheat straw lignin by solid state fermentation with white-rot fungi[J].Bioresource Technology,2009,100(20):4829-4835.
[24] Li D,Cao X,Ji B.Spectrophotometric studies on the interaction between myricetin and lysozyme in the absence or presence of Cu2+or Fe3+[J].Journal of Luminescence,2010,130(10):1893-1900.
[25] 布坎南R E,吉本斯N E,等.伯杰细菌鉴定手册(第8版)[M].北京:科学出版社,1984.
[26] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[27] Yun H,Wang J M,Huo K,et al.Comparative studies on interactions of baicalein,baicalin and scutellarin with lysozyme[J].European Journal of Medicinal Chemistry,2011,46(12):6039-6045.
[28] 聂文翰,戚志萍,冯海玮,等.复合菌剂秸秆堆肥对土壤碳氮含量和酶活性的影响[J].环境科学,2017,38(2):783-791.
[29] 李春凤,林显华,谷巍.枯草芽孢杆菌在饲料生产及环境防治中的应用[J].中国饲料,2013,12(1):10-13.
[30] 魏桃员,张素琴,邵林广,等.一株纤维素降解细菌的分离及特性研究[J].环境科学与技术,2004,27(5):1-2.
[31] 吴勇,黄巧云,陈雯莉.低温生防菌枯草芽胞杆菌BS303的选育及其效果验证[J].华中农业大学学报,2017,36(3):19-24.
[32] 樊程,李双江,李成磊,等.大熊猫肠道纤维素分解菌的分离鉴定及产酶性质[J].微生物学报,2012,52(9):1113-1121.
[33] 刘清锋,支晓鹏,徐惠娟,等.纤维素降解菌青霉T24-2的分离及产酶特性[J].工业微生物,2007,37(3):15-19.
[34] 李保深,高大文,张博.一株产纤维素酶真菌的筛选鉴定及降解[J].东北林业大学学报,2011,39(7):135-137.
[35] Bautista-Rosales P U,Calderon-Santoyo M,Servín-Villegas R,et al.Biocontrol action mechanisms of Cryptococcus laurentii on Colletotrichum gloeosporioides of mango[J].Crop Protection,2014,65(4):194-201.
[36] Guo J,Fang W,Lu H,et al.Inhibition of green mold disease in mandarins by preventive applications of methyl jasmonate and antagonistic yeast Cryptococcus laurentii[J].Postharvest Biology&Technology,2014,88(1):72-78.

