利用游离型表达质粒强化毕赤酵母表达木聚糖酶
潘阳,吴丹,吴敬
1 江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122
2 江南大学 生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122
巴斯德毕赤酵母已成为最广泛的外源蛋白表达系统之一,已有上千种蛋白在毕赤酵母系统中得到成功表达,重组蛋白产品涉及食品、饲料、医药等众多行业[1]。用于食品或者饲料行业的多种酶制剂如植酸酶、脂肪酶、甘露聚糖酶、木聚糖酶、α-葡萄糖苷酶等利用毕赤酵母实现了产业化规模的生产[2-3]。近些年,毕赤酵母被美国FDA认定为Generally recognized as safe (GRAS) 微生物[4],使得毕赤酵母在食品领域具备极大的应用潜力。毕赤酵母目前常用的表达质粒根据不同的启动子分为 pPIC系列甲醇诱导型表达载体 (如pPIC3.5k、pPIC9K、pPICZ、pAO815等) 和 pGAP系列组成型表达载体。其中pPIC系列质粒含醇氧化酶 (AOX) 启动子,该启动子是以甲醇为唯一诱导物并受其严谨控制的强启动子,由于 AOX表达是受转录水平调控的,其强诱导型启动子AOX能非常有效地控制外源基因的表达[5]。但其也有不足之处,毕赤酵母在不受控制的条件下细胞先生长至高密度,然后通过甲醇诱导启动外源蛋白表达,这增加了工程菌的培养时间和工作量。同时在大规模生产过程中,甲醇的使用也存在诸多弊端,如易挥发、浓度不易检测、有潜在的火灾隐患、具有毒性、不适于药品和食品蛋白的生产等[6],因而制约了毕赤酵母表达系统的大规模应用。pGAP系列质粒含 3-磷酸甘油醛脱氢酶(GAP) 启动子,GAP启动子受碳源调控[7],葡萄糖为碳源时其转录水平最高,其次是甘油、油酸,甲醇最低[8]。相对于AOX启动子,虽然GAP启动子表达外源蛋白的水平较低,但是该组成型启动子不需甲醇诱导,发酵工艺简单,具有适合于食品规模化应用的优势。因此如果能改造 pGAP质粒进而提高异源蛋白的表达水平,将极大促进毕赤酵母在食品领域的应用。
基因拷贝数是毕赤酵母表达重组蛋白的一个影响因素。目前基因拷贝数对表达量的影响仍然无法预测,大多数情况下,外源蛋白的表达量会随着拷贝数的增加而相应增加[9]。目前在毕赤酵母系统中多采用在基因组上插入多个外源基因拷贝来增加基因剂量,如通过增加博来霉素浓度来筛选高拷贝外源基因菌株[10],或者应用BglⅡBrick方法将目的基因表达盒用同尾酶连接在一起,构建成含多拷贝表达盒的重组表达质粒并整合到宿主菌株基因组中,从而得到含高拷贝外源基因的转化子[11]。过去认为在毕赤酵母中整合到染色体表达比游离载体表达稳定,但研究发现整合区域都是相邻近的位点,稳定性差,在一定条件下可能通过同源重组而丢失[12]。此外,在酵母基因组上整合外源基因会对细胞自身生理代谢造成不利影响,整合到基因组中高拷贝重组菌株生长速率和细胞活性都有降低的现象[13]。而游离型载体能够在细胞内独立于宿主细胞本身的复制周期而实现扩增,因而可显著增加外源基因拷贝数,同时游离载体表达方式对菌体基因组影响很小。目前用于毕赤酵母的质粒均为整合型质粒,尚未见到采用游离型表达质粒来进行异源蛋白的表达。
木聚糖酶分布广泛,主要来自自然界中一些真菌、细菌、无脊椎动物体内以及植物组织等[14]。人们研究比较多的是微生物生产木聚糖酶,已经报道的产木聚糖酶菌株有各种霉菌和链霉菌以及芽孢杆菌等[15-16]。木聚糖酶是糖苷水解酶 (EC 3.2.1.x),糖苷水解酶分成若干家族,木聚糖酶主要分布在第10家族 (F10) 和11家族 (G11) 两大家族[17-18]。一般来讲F10木聚糖酶分子质量一般大于30 kDa,结构复杂,含有多个结构域;而G11木聚糖酶多为单一结构域,相对分子质量一般小于30 kDa[19-21]。木聚糖酶能将木聚糖水解为低聚木糖以及木糖单糖[22],在造纸、面制品、低聚木糖制备、果蔬生产、饲料等行业中有很好的应用价值。目前木聚糖酶异源表达大多以毕赤酵母为宿主并在甲醇诱导下实现,如在本实验室前期研究当中,从链霉菌Streptomycessp. FA1中分离纯化出一种第10家族 (GH10) 的木聚糖酶 (XynA),通过构建毕赤酵母重组菌株在甲醇的诱导下实现较高水平分泌表达,摇瓶水平达到130 U/mL[23];张慧敏等将一种11家族极端耐热木聚糖酶的密码子优化基因Syxyn11克隆到毕赤酵母表达载体pPIC9K中,转化酵母后用甲醇诱导酶活可达到17.74 U/mL[24]。为了消除甲醇在重组木聚糖酶生产中的应用风险,本研究通过选用来源于酵母自身的自我复制序列 (PARS)改造 pGAP表达质粒,使之成为自主复制的游离型表达载体,不仅可以获得高拷贝数菌株,同时还可以稳定传代。进而比较单独利用游离载体、游离载体与基因整合联用等多种表达组合体来研究进一步提高木聚糖酶的表达水平。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
大肠杆菌Escherichia coliJM109由本实验室保存;载体pMD19T-Simple购于大连宝生物公司。毕赤酵母 KM71和表达质粒 pGAPZαA购自Invitrogen公司。
1.1.2 培养基
YPD液体培养基:酵母粉 5.0 g/L,胰蛋白胨10.0 g/L,葡萄糖10.0 g/L。YPD固体培养基:在YPD液体培养基的基础配方上,添加1.0%−2.0% (M/V) 的琼脂。BMGY培养基:酵母粉5.0 g/L,胰蛋白胨10.0 g/L,YNB 13.4 g/L,生物素 4×10–4g/L,甘油10.0 g/L。发酵种子培养基:酵母粉10.0 g/L,胰蛋白胨20.0 g/L,YNB 13.4 g/L,甘油30.0 g/L。BSM培养基:85%磷酸26.7 mL/L,CaSO40.93 g/L,K2SO418.2 g/L,MgSO4·7H2O 14.9 g/L,KOH 4.13 g/L,甘油40.0 g/L,微量元素盐溶液4.35 mL/L,组氨酸2.0 g/L。
1.1.3 试剂
rTaq酶、限制性内切酶、T4 DNA连接酶、Primer StarTMHS DNA聚合酶、DL-10000 DNA Marker均购于TaKaRa有限公司;Endo Hf内切酶购于NEB (北京) 有限公司;琼脂糖凝胶DNA回收试剂盒、PCR纯化试剂盒和质粒提取试剂盒均购自天根生化科技有限公司;中分子量标准蛋白、聚丙烯酰胺凝胶电泳 (SDS-PAGE) 试剂盒均购于碧云天生物技术有限公司 (上海);博来霉素(Zeocin) 购自 Invitrogen公司;分子级的胰蛋白胨和酵母粉购自英国Oxoid公司;所有质粒测序均由上海睿迪生物技术有限公司提供支持;无特殊说明,其他试剂均属于国产分析纯。
1.2 方法
1.2.1 表达载体的构建
自主复制序列 PARS来源于乳酸克鲁维酵母Kluyveromyces lactis[25]并由人工合成,同时合成的2对引物序列如表1所示。以PARS序列为模板用上游引物F1和下游引物R1,扩增并回收片段,将该片段与pGAPZαA质粒通过infusion酶进行融合连接,构建载体 pGAPZαA-PARS。设计上游引物 F2和下游引物R2,并分别引入EcoRⅠ和NotⅠ限制性酶切位点 (划线部分)。扩增xynA后,将载体pGAPZαA-PARS和目的基因xynA经EcoRⅠ、NotⅠ双酶切,通过T4 DNA聚合酶连接处理构建重组质粒 pGAPZαA-PARS-XynA,扩增质粒测序正确后用于转化毕赤酵母。载体pGAPZαA和目的基因xynA经EcoRⅠ、NotⅠ双酶切,通过T4 DNA聚合酶连接处理构建重组质粒pGAPZαA-xynA,扩增质粒测序正确后转化毕赤酵母。
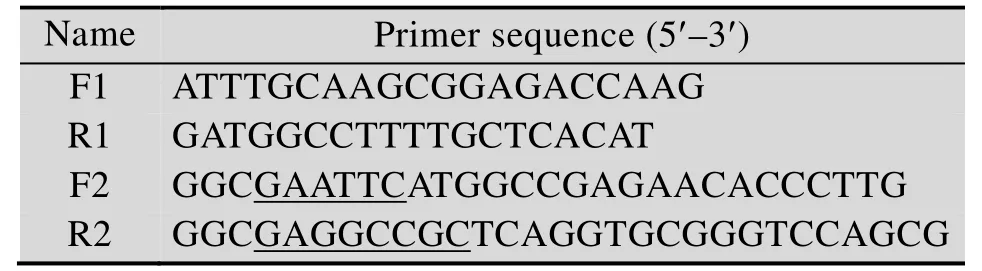
表1 引物序列Table 1 Primer sequence
1.2.2 质粒 pGAPZαA-PARS-xynA、pGAPZαA-xynA转化毕赤酵母KM71
将测序正确的重组游离质粒 pGAPZαAPARS-xynA直接电转化毕赤酵母KM71感受态细胞;整合型质粒pGAPZαA-xynA和空载pGAPZαA用AvrⅡ线性化,将线性化后的质粒分别电转化至毕赤酵母KM71感受态细胞,加入1 mL 1 mol/L预冷的山梨醇,吹打均匀,将其转入1.5 mL EP管中,30 ℃、200 r/min 摇床培养 2 h,然后吸取 200 µL涂布于YPD平板上,30 ℃恒温条件下培养至长出单菌落,利用菌落PCR鉴定阳性克隆,实验以转化空载体pGAPZαA的酵母菌作为负对照。
1.2.3 重组毕赤酵母转化子的摇瓶表达
将游离型质粒 pGAPZαA-PARS-xynA、整合型质粒pGAPZαA-xynA转化酵母后产生的转化子中各挑选10个转化子进行摇瓶诱导表达,比较各转化子表达产物的酶活情况,以筛选酶活较高的转化子。将转化子接种于10 mL YPD培养基中,于30 ℃、200 r/min恒温摇床培养24 h后转接2.5 mL于50 mL BMGY培养基中,200 r/min、30 ℃培养24 h后离心收集菌体,再转入100 mL YPD培养基中进行表达,表达4 d后测酶活。所用到的各种培养基配方参照 Invitrogen公司毕赤酵母操作手册。
1.2.4 酶活力的测定
将0.5 g的木聚糖 (榉木来源) 溶于100 mL 50 mmol/L的磷酸缓冲液 (pH 5.5),充分混匀。取1 mL底物,在50 ℃预热10 min,加入1 mL稀释一定倍数的酶液,反应10 min后加入3 mL 3,5-二硝基水杨酸溶液,煮沸10 min迅速冷却,加蒸馏水定容至20 mL,540 nm下测吸光度 (以灭活的酶液为催化剂同样操作作为空白对照)。
在上述条件下,将每分钟水解木聚糖生成1 μmol的木糖所需酶量定义为木聚糖酶的一个单位的酶活力 (U)。
1.2.5 发酵罐上罐发酵
从–80 ℃保藏甘油管中吸取200 μL接到100 mL种子摇瓶培养基中,30 ℃、200 r/min条件下培养24 h后,将100 mL种子接入3.6 L发酵罐中进行发酵。发酵初始培养基为BSM培养基,发酵罐发酵分为甘油生长阶段、甘油补料培养和不同碳源补料培养3个阶段。甘油生长阶段中通过搅拌和通风量控制DO在30%,温度控制在30 ℃,流加氨水控制发酵液在pH 5.0左右,培养大约20 h左右DO值迅速上升时,进入甘油补料培养阶段,此时流加50%的甘油 (含组氨酸 5 g/L) 补料,当酵母生长到OD600约为100时停止甘油补料,DO值再次迅速上升时,根据不同的碳源分别进行第三阶段补料流加培养,碳源分别有甘油、葡萄糖、蔗糖和混合碳源 (甘油︰蔗糖为 1︰2,1︰1,2︰1),各种碳源均配成 50%的浓度 (含组氨酸 5.0 g/L)进行流加。所用到的各种培养基配方参照 Invitrogen公司毕赤酵母操作手册。
1.2.6 Endo Hf处理外源蛋白
取20 μL发酵上清液,加入2 μL的10×糖蛋白变性缓冲液,100 ℃煮沸10 min。将煮好的样品冷却至室温,加入2 μL 10×G5缓冲液,3 μL Endo Hf内切酶,在37 ℃酶切1 h。将处理好的样品进行SDS-PAGE分析。
2 结果与分析
2.1 表 达 载 体pGAPZαA-PARS-xynA 、pGAPZαA-xynA的构建
将 PCR扩增后的 PARS片段通过 In-Fusion试剂盒整合进质粒pGAPZαA中,构建pGAPZαAPARS质粒,将重组质粒转化大肠杆菌JM109后扩增质粒,扩增质粒经NcoⅠ和NotⅠ酶切,得到大小约为900 bp和2 600 bp的片段,为正确质粒(图1A),质粒经上海睿迪生物技术有限公司测序,结果正确。将质粒pGAPZαA-PARS和pGAPZαA经双酶切后和同样双酶切的木聚糖酶基因xynA构建重组表达质粒 pGAPZαA-PARS-xynA和pGAPZαA-xynA,将构建好的重组质粒用EcoRⅠ、NotⅠ双酶切,条带大小分别约为3 600和1 300 bp(PGAPZαA-PARS-xynA)、3 100和1 300 bp (pGAPZαA-xynA) 为正确重组质粒 (图1B),质粒经上海睿迪生物技术有限公司测序,结果正确。
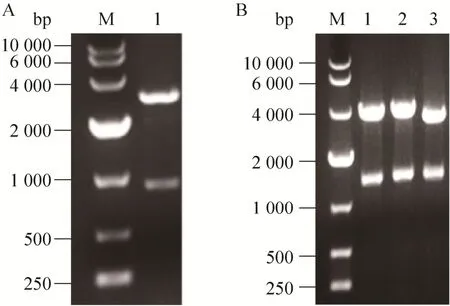
图1 重组质粒的酶切鉴定Fig. 1 Identification of recombinant plasmids with enzyme digestion. (A) M: DNA marker; 1:pGAPZαA-PARS digested with EcoRⅠand NotⅠ. (B)M: DNA marker; 1−2: pGAPZαA-PARS-xynA digested with EcoRⅠand NotⅠ; 3: pGAPZαA-xynA digested with EcoRⅠand NotⅠ.
2.2 摇瓶发酵
以 pGAPZαA-PARS-xynA、pGAPZαA-xynA分别代表其所转化感受态酵母细胞 KM71,每种重组毕赤酵母筛选了10个重组子,在YPD培养基中培养6 d后离心取上清液测木聚糖酶活力,如表2所示,所挑出的两种不同菌株转化子均能检测到酶活,说明两种质粒都成功转化到了毕赤酵母中并表达。重组菌 pGAPZαA-PARS-xynA木聚糖酶活力显然高于 pGAPZαA-xynA,前者酶活最高达到29.6 U/mL,后者最高为16.0 U/mL,前者提高了85%。分别取两株产量最高的重组菌用于后续发酵罐水平研究。
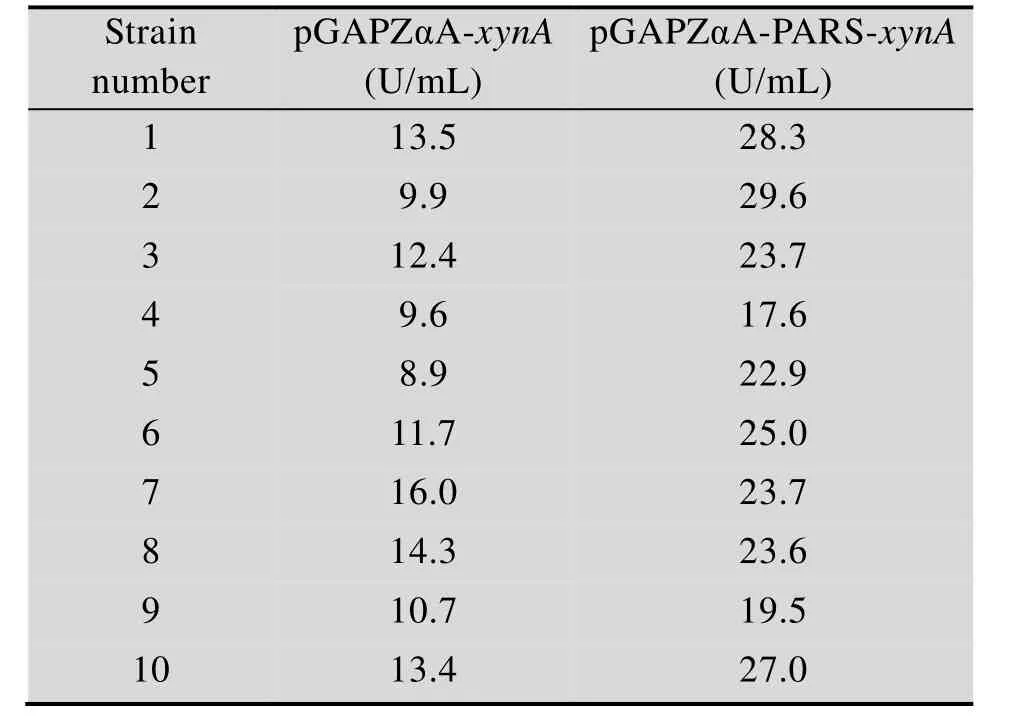
表2 不同表达类型的木聚糖酶活力Table 2 Activity of recombinant xylanase expressed by P. p astoris containing episomal or an integrated plasmid
2.3 发酵罐优化
2.3.1 甘油为碳源进行pGAPZαA-PARS-xynA、pGAPZαA-xynA发酵研究
发酵罐高密度培养和摇瓶培养差别巨大,为了进一步研究发酵罐水平下游离型菌株和整合型菌株的产酶水平,以甘油为碳源进行两种菌株的对比培养。图 2A显示游离载体菌株 pGAPZαAPARS-xynA生长都较整合型菌株 pGAPZαA-xynA稍高,到最后二者生物量接近。图2B说明pGAPZαAPARS-xynA分泌量要显著高于pGAPZαA-xynA,前者最高酶活达到 343 U/mL,相对于后者最高235 U/mL酶活提高45.9%。单位OD菌株分泌木聚糖酶能力比较,前者为0.71和0.53 IU/OD600,游离型菌株生产木聚糖酶的能力显著强于整合型菌株。图 2C显示发酵罐上清液蛋白质表达量出现一个奇怪的现象,即培养 60 h后 pGAPZαAPARS-xynA菌株上清液蛋白质含量显著少于pGAPZαA-xynA菌株,前者最高含量达到2.1 g/L,后者则达到2.7 g/L,说明上清液中可能有较多的杂蛋白分泌出来,或者木聚糖酶被酵母分泌的蛋白酶降解而降低了酶活。
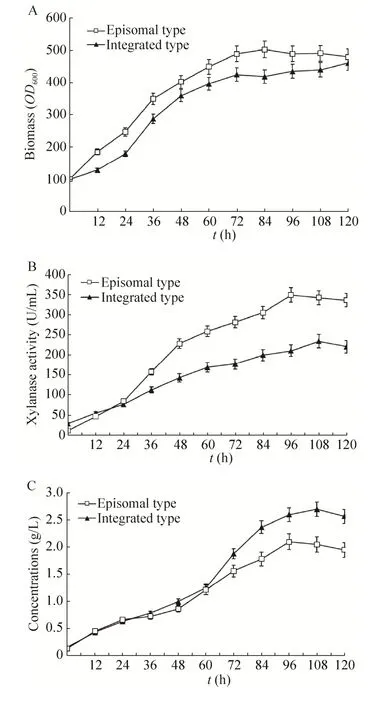
图2 游离型菌株和整合型菌株的上罐比较Fig. 2 Fermentation comparison of episomal and integrated strains. (A) Time course of biomass of strains with episomal or integrated plasmid. (B) The activity of xylanase produced by strains with episomal or integrated plasimid. (C) The expression level of protein in strains with episomal or integrated plasmid.
为了进一步探究pGAPZαA-xynA菌株发酵罐上清液中木聚糖酶酶活降低的原因,分别对两种菌株不同培养时间的上清液进行 SDS-PAGE分析。pGAPZαA-PARS-xynA菌株上清液 (图 3A) 中含一条清晰的XynA目的条带,相比之下pGAPZaA-xynA菌株上清液在目的条带位置有两条相邻很近的条带 (图 3B),说明 pGAPZαA-xynA菌株培养上清液中出现了除XynA之外的特异性杂带,推测有可能是毕赤酵母表达外源蛋白过程中糖基化造成的。糖基化通常使外源蛋白分子量比实际偏大,我们通过Endo Hf内切酶处理pGAPZαA-xynA整合型菌株发酵上清液 (图 3C) 进行去糖基化分析,结果显示存在糖基化。糖基化的出现,直接导致了pGAPZαA-xynA菌株上清液蛋白中XynA的比活降低。pGAPZαA-PARS-xynA菌株产酶比活达到16 333 U/g,相对pGAPZαA-xynA的87 037 U/g提高了81.2%。
2.3.2 不同碳源下游离型菌株的上罐发酵
发酵过程中培养基对微生物生长、目的产物生成起着至关重要的作用,培养基的优劣直接决定发酵的成败。GAP组成型启动子最大优势是不需要甲醇诱导,因而相对于 AOX启动子在食品行业具有天然的优势。含组成型启动子的重组菌其表达功能可以伴随着菌体生长而一直持续进行,因此在有碳源提供的条件下可一直连续培养表达。组成型启动子GAP可应用多种碳源进行生长表达。本研究采用常见的碳源甘油、葡萄糖,同时采用较为廉价的工业蔗糖为碳源,并且尝试采用甘油和蔗糖的混合碳源对游离型pGAP菌株进行培养,以降低重组木聚糖酶的制备成本。其中蔗糖和甘油混合流加已经做过1︰1,1︰2和2︰1三种不同碳源混合流加,因1︰2的比例获得表达水平最高,故本研究中采用1︰2比例混合碳源的数据进行分析。从图2及图4中可以看出,对以甘油、葡萄糖、蔗糖和混合碳源流加4种培养方式,酶活最高分别为350、304、205、281 U/mL,以甘油为碳源时木聚糖酶的表达量最高,以蔗糖为碳源时表达量最低,其中混合碳源和以葡萄糖为碳源的培养结果大致接近。以单位生物量产酶水平比较,分别为 0.71、0.65、0.74、0.66 IU/OD600,可见不同碳源培养时菌株产酶能力大体接近,菌株生长能力对产酶水平影响显著。
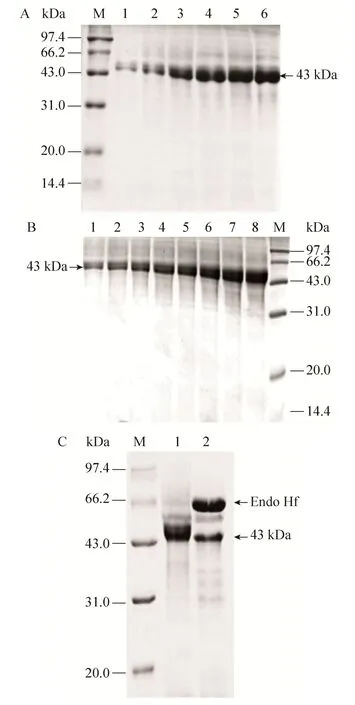
图3 pGAPZαA-PARS-xynA和pGAPZαA-xynA菌株发酵上清中XynA的SDS-PAGE分析Fig. 3 SDS-PAGE analysis of XynA in the fermentation supernatant of pGAPZαA-PARS-xynA and pGAPZαA-xynA. (A) Fermentation supernatant of pGAPZαAPARS-xynA. M: marker; 1: 48 h; 2: 60 h; 3: 72 h; 4: 84 h; 5:96 h; 6: 108 h. (B) Fermentation supernatant of pGAPZαA-xynA. M: marker; 1: 24 h; 2: 48 h; 3: 60 h; 4:72 h; 5: 84 h; 6: 96 h; 7: 108 h. (C) Deglycosylation of XynA in pGAPZαA-xynA fermentation supernatant. M:marker; 1: XynA in fermentation supernatant of pGAPZαA-xynA; 2: deglycosylation of XynA in pGAPZαA-xynA fermentation supernatant digested with Endo Hf.
3 讨论
在摇瓶发酵中,pGAPZαA-PARS-xynA菌株产酶水平比pGAPZαA-xynA高85%,发酵罐水平高 45.9%。另外,发酵罐培养过程中单位菌体量的产酶水平对比也是前者高出后者 33.9%,由此可见,游离型的载体表达木聚糖酶的能力显著高于整合型载体。由于 GAP启动子不需要甲醇诱导,因此构建游离的pGAP载体强化外源蛋白的表达将大大拓展毕赤酵母在食品工业中的应用。游离型载体产酶水平高于整合型表达,这可能是由于游离型的载体具有较高的拷贝数所导致。过去一般认为与游离状态相比载体整合到染色体中是很稳定的,但研究表明无论是体内法还是体外法载体都是整合在相邻近的位点,这种方式是不稳定的,在一定条件下可能通过同源重组而丢失[12],导致在增加拷贝数上存在限制。
在分泌蛋白修饰中,糖基化是一种重要修饰方式,影响蛋白的结构与功能。在pGAPZαA-xynA菌株中上清液出现了明显的糖基化XynA蛋白,导致XynA的酶活力降低。同一种酶在酵母中因为表达方式的不同而产生不同的糖基化是一个很奇怪的现象。这可能是外源基因整合进基因组表达和游离载体表达的异源蛋白质加工过程存在差异,从而产生了不同的糖基化修饰,具体机理还有待进一步研究。
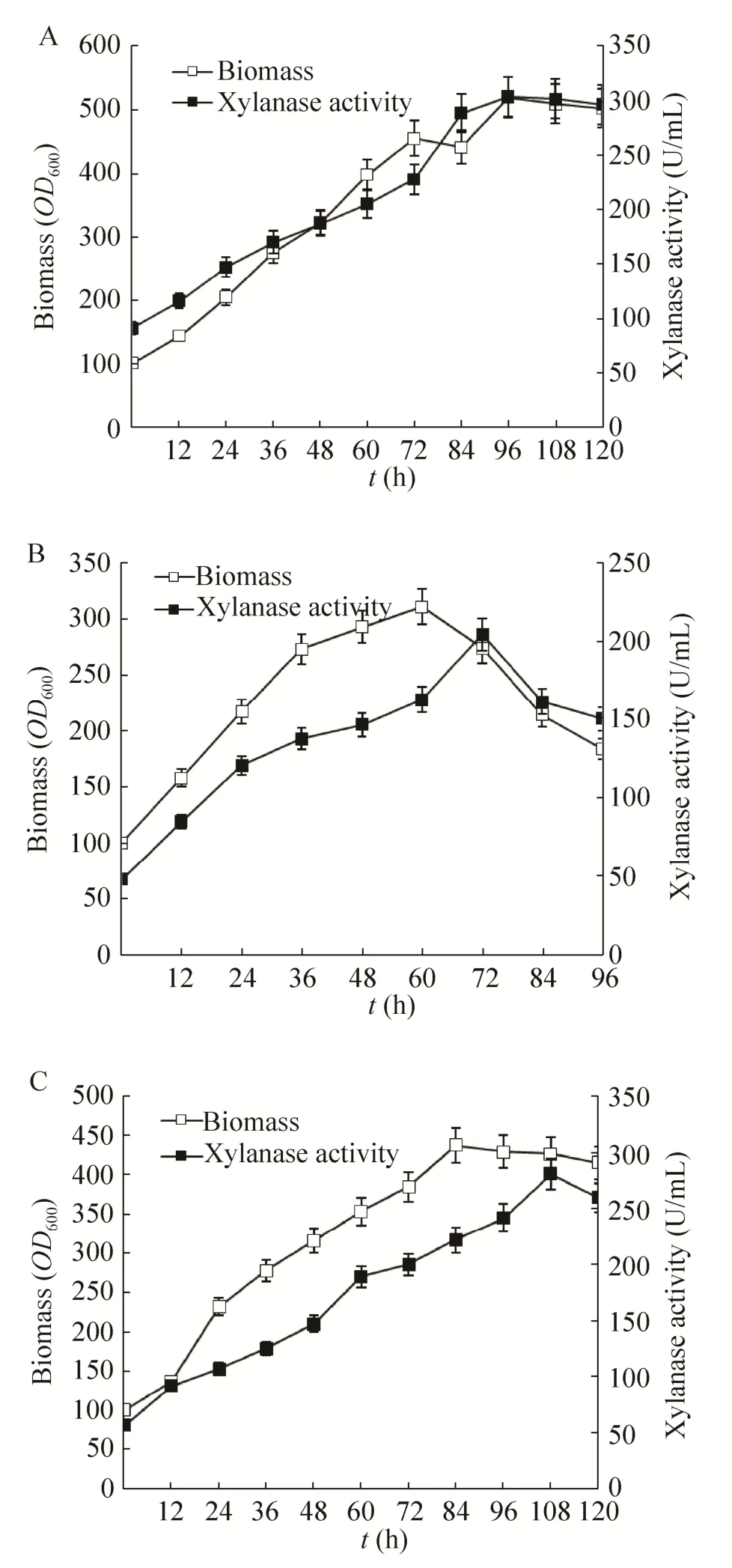
图4 不同碳源培养的游离型菌株的生物量和酶活Fig. 4 Biomass and enzyme activity of strains with episomal vectors cultured with different carbon sources.(A) Biomass and enzymatic activity of strains with episomal vectors cultured with glucose as carbon source.(B) Biomass and enzymatic activity of strains with episomal vectors cultured with sucrose as carbon source.(C) Biomass and enzymatic activity of strains with episomal vectors cultured with mixed carbon sources.
GAP是组成型启动子,因此能让毕赤酵母生长的碳源均能促使酵母产酶。本研究显示不同的碳源培养时单位生物量产酶的水平接近,因而菌株的生长能力对产酶水平有重要影响。一般认为毕赤酵母基因组中缺少蔗糖酶基因,因此无法利用蔗糖[26]。但从本研究看,毕赤酵母在纯蔗糖培养基中生长良好,但是相对于甘油和葡萄糖要缓慢得多,产酶水平也属最低。原因可能源于甘油进入细胞内通过磷酸化和脱氢两步后直接进入三羧酸循环途径从而被快速利用[27],但是蔗糖经过转运进入细胞内还需要经过蔗糖酶分解为葡萄糖和果糖后再加以利用,这种分解过程限制了蔗糖的快速利用。考虑到纯蔗糖不利于菌体生长,因此流加一定比例的甘油 (蔗糖︰甘油=1︰2) 以促进菌株生长,此时酶活接近采用纯葡萄糖为碳源时的产酶水平。根据工业级的甘油4 500元/t、葡萄糖2 600元/t、蔗糖2 300元/t的价格计算,以葡萄糖为碳源的生产成本最低。
[1]Çelik E, Çalık P. Production of recombinant proteins by yeast cells. Biotechnol Adv, 2012, 30(5):1108–1118.
[2]Rabert C, Weinacker D, Pessoa Jr A, et al.Recombinants proteins for industrial uses: utilization ofPichia pastorisexpression system. Braz J Microbiol, 2013, 44(2): 351–356.
[3]Chen DL, Tong X, Chen SW, et al. Heterologous expression and biochemical characterization of α-glucosidase fromAspergillus nigerbyPichia pastroris. J Agric Food Chem, 2010, 58(8):4819–4824.
[4]Zhu TC, Li Y. Recent development ofPichia pastorissystem: current status and future perspective. Chin J Biotech, 2015, 31(6): 929−938(in Chinese).朱泰承, 李寅. 毕赤酵母表达系统发展概况及趋势. 生物工程学报, 2015, 31(6): 929−938.
[5]Xie JL, Zhou QW, Du P, et al. Use of different carbon sources in cultivation of recombinantPichia pastorisfor angiostatin production. Enzym Microb Technol, 2005, 36(2/3): 210–216.
[6]Lu YC, Jiang L. The strategies for efficient expression of recombinant protein inPichia pastoris.Prog Microbiol Immunol, 2013, 41(1): 70–76 (in Chinese).陆永超. 毕赤酵母高效表达策略概述. 微生物学免疫学进展, 2013, 41(1): 70–76.
[7]Waterham HR, Digan ME, Koutz PJ, et al. Isolation of thePichia pastoris, glyceraldehyde-3-phosphate dehydrogenase gene and regulation and use of its promoter. Gene, 1997, 186(1): 37–44 .
[8]Jin XM, Ma YB. Advances inPichia pastorispromoters used for heterogeneous gene expression. J Microbiol, 2015(3): 71–74 (in Chinese).金晓媚, 马雁冰. 用于异源基因表达的毕赤酵母启动子研究进展. 微生物学杂志, 2015(3): 71–74.
[9]Clare JJ, Rayment FB, Ballantine SP, et al.High-level expression of tetanus toxin fragment C inPichia pastorisstrains containing multiple tandem integrations of the gene. Bio/Technology, 1991, 9(5):455–460.
[10]Marx H, Mecklenbräuker A, Gasser B, et al. Directed gene copy number amplification inPichia pastoris,by vector integration into the ribosomal DNA locus.FEMS Yeast Res, 2009, 9(8): 1260–1270.
[11]Lee TS, Krupa RA, Zhang FZ, et al. BglBrick vectors and datasheets: a synthetic biology platform for gene expression. J Biolog Eng, 2011, 5(1): 12.
[12]Zhu TC, Guo MJ, Sun C, et al. A systematical investigation on the genetic stability of multi-copyPichia pastorisstrains. Biotechnol Lett, 2009, 31(5):679–684.
[13]Zhu T, Guo M, Tang Z, et al. Efficient generation of multi-copy strains for optimizing secretory expression of porcine insulin precursor in yeastPichia pastoris. J Appl Microbiol, 2009, 107(3):954–963.
[14]Dekker RFH, Richards GN. Hemicellulases: their occurrence, purification, properties, and mode of action. Adv Carbohyd Chem Biochem, 1976, 32:277–352.
[15]Lu P. Construction, optimization and characterization of bifunctional β-glucanase-xyanase and β-glucanase-phytase fusions[D]. Hangzhou:Zhejiang University, 2008 (in Chinese).陆平. 双功能β-葡聚糖酶-木聚糖酶与β-葡聚糖酶-植酸酶融合酶的优化构建及其酶学特性分析[D].杭州: 浙江大学, 2008.
[16]Badhan AK, Chadha BS, Kaur J, et al. Production of multiple xylanolytic and cellulolytic enzymes by thermophilic fungusMyceliophthorasp. IMI 387099.Bio Technol, 2007, 98(3): 504–510.
[17]Collins T, Gerday C, Feller G. Xylanases, xylanase families and extremophilic xylanases. FEMS Microbiol Rev, 2005, 29(1): 3–23.
[18]Henrissat B, Bairoch A. New families in the classification of glycosyl hydrolases based on amino acid sequence similarities. Biochem J, 1993, 293(3):781–788.
[19]Zhang QL. The application of neutral xylanase in food[D]. Wuxi: Jiangnan University, 2005 (in Chinese).张勤良. 中性木聚糖酶在食品中的应用研究[D].无锡: 江南大学, 2005.
[20]Beg Q, Kapoor M, Mahajan L, et al. Microbial xylanases and their industrial applications: a review.Applied Microbiol Biotechnol, 2001, 56(3/4):326–338.
[21]Gilkes NR, Henrissat B, Kilburn DG, et al. Domains in microbial beta-1,4-glycanases: sequence conservation, function, and enzyme families.Microbiol Rev, 1991, 55(2): 303–315.
[22]Petit-Benvengnen MD, Saulnier L, Rouau X.Solubilization of arabinoxylans from isolated water-unextractable pentosans and wheat flour doughs by cell-wall-degrading enzymes. Cereal Chem, 1998, 75(4): 551–556.
[23]Xu Y, Wu J, Zheng KX, et al. A xylanase fromStreptomycessp. FA1: heterologous expression,characterization, and its application in Chinese steamed bread. J Indust Microbiol Biotechnol, 2016,43(5): 663–670.
[24]Zhang HM, Li JF, Wu MC, et al. Expression of a thermostable xylanase gene inPichia pastorisand its enzymatic characterization. J Food Sci Biotechnol,2013, 32(2): 124–128 (in Chinese).张慧敏, 李剑芳, 邬敏辰, 等. 耐热木聚糖酶基因在毕赤酵母中的表达及酶学性质. 食品与生物技术学报, 2013, 32(2): 124–128.
[25]Camattari A, Goh A, Lian YY, et al. Characterization of a panARS-based episomal vector in the methylotrophic yeastPichia pastoris, for recombinant protein production and synthetic biology applications. Microb Cell Facto, 2016, 15(1):139.
[26]Huang ZW, Yi XM, Zeng LQ, et al. Construction of an engineeringPichia pastorisstrain that utilizes sucrose. Sugar Canes, 2012(3): 53–55 (in Chinese).黄曾慰, 蚁细苗, 曾练强, 等. 蔗糖利用型毕赤酵母工程菌的构建. 甘蔗糖业, 2012(3): 53–55.
[27]Chen XZ, Wang ZX, Zhuge J. Progress in glycerol metabolism and its physiological function in yeast cells. China Biotechnol, 2010, 30(5): 140–148 (in Chinese).陈献忠, 王正祥, 诸葛健. 酵母细胞甘油代谢与生理功能研究进展. 中国生物工程杂志, 2010, 30(5):140–148.

