CRAE对百草枯中毒大鼠肺纤维化的保护作用机制
郭启芬,谢来柱,张 泓
随着百草枯(paraquat)在农业中广泛应用,百草枯中毒事件越来越多,而百草枯中毒的患者往往会继发性肺纤维化从而引起限制性肺通气障碍。现代医学认为,肺纤维化一种以肺间质炎症、纤维组织增生、胞外基质代谢异常的弥漫性肺间质疾病[1]。本病的平均生存期不高,且临床上缺乏有效的治疗手段。中医治疗肺部疾病已有数千年历史,有丰富的经验和理论基础。该课题组根据当地治疗“肺疾”偏方,结合传统中医理论及西医肺纤维化相关的基础研究,使用现代水提法制备出复方赤芍黄芪提取物(compound of Radix Paeoniae Rubra and Astragalus extract,CRAE),并观察其对百草枯引起的肺纤维化等方面的疗效。
1 材料与方法
1.1药物制备复方赤芍黄芪提取物是根据当地治疗“肺疾”偏方和单剂药物成分修正,以赤芍、黄芪、鳖甲以及其他辅料按照(2 ∶2 ∶1 ∶1)配伍,使用现代水提法工艺制备而成。其主要成分有芍药苷、芍药内脂苷、黄芪多糖、鳖甲多糖等。
1.2实验试剂转化生长因子(transforming growth factor-β,TGF-β1) ELISA试剂盒、Ⅰ型纤溶酶原激活抑制因子 (plasminogen activator inhibitor 1,PAI-1) ELISA试剂盒、金属基质蛋白酶9 (matrix metallopeptidase 9,MMP-9) ELISA试剂盒、基质金属蛋白酶抑制剂1 (tissue inhibitor of metallopeptidase 1,TIMP-1) ELISA试剂盒、羟脯氨酸(hydroxyproline,Hyp)试剂盒、透明质酸(hyaluronic acid,HA)试剂盒、Ⅲ 型胶原蛋白(collagen protein type Ⅲ ,PC-Ⅲ )试剂盒、层粘连蛋白(laminin,LN)试剂盒、丙二醛(malonaldehyde,MDA)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、肿瘤坏死因子α(tumor necrosis factor α,TNF-α) ELISA试剂盒、白介素17(interleukin 17,IL-17) ELISA试剂盒、白介素6(interleukin 6,IL-6)ELISA试剂盒、BCA法蛋白测定试剂盒均购自南京建成生物公司;TRIzol购自美国Invitrogen公司;P-Smad2、Smad2、P-Smad3、Smad3、Smad7、GAPDH、PAI-1一抗及二抗购自美国Sigma公司;qPCR试剂盒购自美国Thermo Fisher公司;PAI-1引物购自上海生工生物公司。
1.3实验动物及分组选用雄性SD大鼠90只,体重260 g左右,由安徽医科大学动物实验中心提供,许可证号2008003。将动物饲养于恒温无菌动物房中,随机分成6组,每组15只,分别为正常对照组、模型组、阳性对照组(泼尼松5.0 mg/kg)、CRAE 0.6 g/kg组、CRAE 1.2 g/kg组、CRAE 2.4 g/kg组。
1.4实验动物造模[2]将模型组、阳性对照组、CRAE 0.6 g/kg组、CRAE 1.2 g/kg组、CRAE 2.4 g/kg组大鼠称重后按照0.1 ml/100 g百草枯药液灌胃造模。造模结束24 h后,按照相应给药方式进行灌胃处理,每天1次。造模后各组大鼠均出现呼吸变浅、呼吸频率加快、呼吸困难等症状。实验进行至4周时,有大鼠开始死亡,结束灌胃并处死大鼠。摘取大鼠肺脏称重并计算肺脏脏器指数。肺脏脏器指数=肺脏重量/大鼠体重。腹主动脉取血,以1 000 r/min离心20 min分离血清后置于-20 ℃冷冻备用。取大鼠肺脏并使用组织均浆机均浆组织液,置于-80 ℃冷冻备用。
1.5大鼠血清HA、PC-Ⅲ、LN含量和肺组织中MMP-9、TIMP-1、Hyp、MDA、SOD、GSH-Px、TNF-α、IL-17、IL-6、TGF-β1、PAI-1含量测定取出冻存的大鼠血清和组织液,按照ELISA试剂盒说明书步骤检测大鼠血清中HA、PC-Ⅲ、LN含量和肺组织中MMP-9、TIMP-1、Hyp、MDA、SOD、GSH-Px、TNF-α、IL-17、IL-6、TGF-β1、PAI-1含量。
1.6Q-PCR法检测PAI-1mRNA的含量使用TRIzol试剂盒提取大鼠组织液中的总RNA。使用qPCR试剂盒检测各组PAI-1的mRNA含量。以GAPDH作为标准校准。使用的qPCR引物见表1。
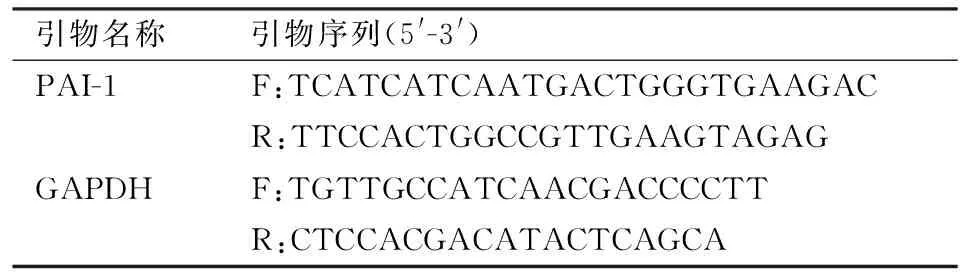
表1 PCR所用引物及其序列
1.7Westernblot法分析P-Smad2、Smad2、P-Smad3、Smad3、Smad7和PAI-1蛋白的含量将冻存的肺组织液与RIPA组织裂解液混合后,4 ℃冰上静置30 min,4 ℃、13 000 r/min离心30 min,离心结束后取上清液。使用BCA法测定各组蛋白浓度,按照Western blot法将蛋白变性、电泳、转膜后置于4 ℃一抗杂交袋过夜,TBST清洗后,室温孵育二抗2 h。使用ECL发光试剂盒进行曝光并分析统计。
2 结果
2.1CRAE对百草枯诱导的肺纤维化大鼠存活率、肺脏重量和肺脏脏器指数的影响与正常对照组相比,模型组大鼠的肺脏重量和肺脏脏器指数明显升高(P<0.05),存活率明显降低;与模型组相比,阳性对照组、CRAE 1.2 g/kg和CRAE 2.4 g/kg组可以明显降低肺纤维化大鼠的肺脏重量和肺脏脏器指数,升高大鼠的存活率,差异具有统计学意义(P<0.05),见表2。
2.2CRAE对百草枯诱导的肺纤维化大鼠血清中HA、PC-Ⅲ、LN含量的影响与正常对照组相比,模型组大鼠血清中HA、PC-Ⅲ、LN含量明显升高(P<0.05);与模型组相比,阳性对照组、CRAE 1.2 g/kg和CRAE 2.4 g/kg组可以明显降低肺纤维化大鼠血清中HA、PC-Ⅲ、LN的含量,差异具有统计学意义(P<0.05),见表2。
2.3CRAE对百草枯诱导的肺纤维化大鼠肺组织中MDA、SOD和GSH-Px含量的影响与正常对照组相比,肺纤维化大鼠肺组织中MDA的含量明显升高,SOD和GSH-Px的含量明显降低(P<0.05);与模型组相比,阳性对照组、CRAE 1.2 g/kg和CRAE 2.4 g/kg组大鼠肺组织中MDA含量明显降低,SOD和GSH-Px的含量明显升高,差异具有统计学意义(P<0.05),见表3。
表2 CRAE对百草枯诱导的肺纤维化大鼠存活率、肺脏重量、肺脏脏器指数和血清中HA、PC-Ⅲ、LN含量的影响
与正常对照组相比:*P<0.05;与模型组相比:#P<0.05
表3 CRAE对百草枯诱导肺纤维化模型大鼠肺组织中MDA、SOD、GSH-Px、MMP-9、TIMP-1和Hyp含量的影响
与正常对照组相比:*P<0.05;与模型组相比:#P<0.05
表4 CRAE对百草枯诱导肺纤维化模型大鼠肺组织TNF-α、IL-17、IL-6 、TGF-β1和PAI-1的影响
与正常对照组相比:*P<0.05;与模型组相比:#P<0.05
2.4CRAE对百草枯诱导的肺纤维化大鼠肺组织中MMP-9、TIMP-1和Hyp含量的影响与正常对照组相比,模型组大鼠肺组织中MMP-9的含量明显降低,TIMP-1和Hyp含量明显升高(P<0.05);与模型组相比,阳性对照组、CRAE 1.2 g/kg和CRAE 2.4 g/kg组大鼠肺组织中MMP-9的含量明显升高,而TIMP-1和Hyp的含量明显降低,差异具有统计学意义(P<0.05),见表3。
2.5CRAE对百草枯诱导的肺纤维化大鼠肺组织中TNF-α、IL-17和IL-6含量的影响与正常对照组相比,模型组大鼠肺组织中TNF-α、IL-17和IL-6的含量明显升高(P<0.05);与模型组相比,阳性对照组、CRAE 1.2 g/kg和CRAE 2.4 g/kg组TNF-α、IL-17和IL-6的含量明显降低,差异具有统计学意义(P<0.05),见表4。
2.6CRAE对百草枯诱导的肺纤维化大鼠肺组织中TGF-β1和PAI-1含量的影响与正常对照组相比,模型组大鼠肺组织中TGF-β1和PAI-1的含量明显升高(P<0.05);与模型组相比,阳性对照组、CRAE 1.2 g/kg和CRAE 2.4 g/kg组大鼠肺组织中TGF-β1和PAI-1的含量明显降低,差异具有统计学意义(P<0.05),见表4。
2.7CRAE对百草枯诱导的肺纤维化大鼠肺组织中P-Smad2、P-Smad3和Smad7蛋白水平的影响与正常对照组相比,模型组肺纤维化大鼠肺组织中P-Smad2和P-Smad3蛋白的表达水平显著升高,Smad7蛋白的表达水平降低(P<0.05);与模型组相比,CRAE 1.2 g/kg和CRAE 2.4 g/kg组能明显降低大鼠肺组织中P-Smad2和P-Smad3蛋白水平,升高Smad7蛋白水平,差异具有统计学意义(P<0.05)。见图1。
2.8CRAE对百草枯诱导的肺纤维化大鼠肺组织中PAI-1及mRNA水平的影响与正常对照组相比,模型组肺纤维化模型大鼠肺组织中PAI-1蛋白及mRNA水平显著升高(P<0.05);与模型组相比,CRAE 1.2 g/kg和CRAE 2.4 g/kg组肺纤维化大鼠肺组织中PAI-1蛋白及mRNA的水平明显降低,差异具有统计学意义(P<0.05)。见图2。
3 讨论
百草枯中毒后绝大部分集中在肺组织,引起肺泡损伤以及炎细胞浸润,最终导致肺泡内及间质纤维化,影响气体交换,死亡率高,且存活者中大部分存在肺纤维化。因此,有效干预及减轻肺损伤及继发肺纤维化可以减少百草枯中毒的病死率。现代医学关于肺纤维化研究显示,许多细胞因子,如TNF-α、IL-17、IL-6、PDGF、TGF-β,通过自分泌或旁分泌形式启动细胞内级联信号转导,调控相应基因表达,从而导致肺纤维化的发生。其中,TGF-β1在肺纤维化病理过程中起重要作用。有研究[3]表明,TGF-β1基因表达广泛表达于肺损伤至肺纤维化各个阶段,在趋化巨噬细胞和成纤维细胞,诱导相关炎症因子释放,促进成纤维细胞增生,增加胞外ECM沉积等方面均有重要的作用。在本研究中,CRAE 1.2 g/kg组和CRAE 2.4 g/kg组可以明显降低肺脏重量和肺脏脏器指数,降低TGF-β1在肺组织中的含量,提示CRAE 1.2 g/kg组和CRAE 2.4 g/kg组对肺纤维化有一定的疗效。
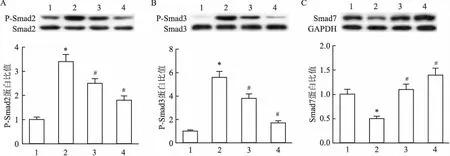
图1 CRAE对百草枯诱导的肺纤维化模型中大鼠肺组织中P-Smad2、P-Smad3和Smad7蛋白水平的影响
A:P-Smad2;B:P-Smad3;C:Smad7;1:正常对照组; 2:模型组; 3:CRAE 1.2 g/kg组; 4:CRAE 2.4 g/kg组;与正常对照组相比:*P<0.05;与模型组相比:#P<0.05

图2 CRAE对百草枯诱导的肺纤维化模型中大鼠肺组织中PAI-1蛋白和mRNA水平的影响
1:正常对照组; 2:模型组; 3:CRAE 1.2 g/kg组; 4:CRAE 1.4 g/kg组;与正常对照组相比:*P<0.05;与模型组相比:#P<0.05
百草枯中毒后,机体产生活性氧自由基和活性氮自由基可导致生物大分子发生脂质过氧化,从而引起细胞和组织损伤。MDA作为脂质过氧化产物之一,是判断细胞受损的重要标志物。SOD和GSH-Px可清除体内产生的自由基,减轻和阻断脂质过氧化物对机体的损害,保护机体免受各类自由基的损害[4]。在本次实验中,模型组大鼠的MDA显著升高,而SOD和GSH-Px含量显著下降,提示百草枯可引起大鼠产生自由基损害肺泡细胞,而CARE 1.2 g/kg组和CRAE 2.4 g/kg组可以明显降低肺组织中MDA含量,升高SOD和GSH-Px的水平,提示CARE可以保护肺脏对抗百草枯中毒引起氧化应激反应。在肺纤维化发生的过程中,细胞外ECM降解与重塑失衡。MMP-9可以降解肺ECM和基底膜,并能调节其他细胞因子及细胞,从而抑制肺纤维化的发生发展,而TIMP-1可特异性抑制MMP-9的降解作用。MMP-9和TIMP-1作为影响ECM代谢的主要酶类,在肺纤维化过程中对ECM平衡起着关键作用[5]。HA、PC-Ⅲ、LN、Hyp等可反应肺纤维化形成,胶原增生和肺脏纤维化程度,是肺纤维化活动性的指标[6]。在本次研究中,CARE 1.2 g/kg组和CRAE 2.4 g/kg组可以升高模型大鼠肺组织中MMP-9的含量,抑制TIMP-1的水平,提示CARE可以调控肺纤维化的胞外ECM失衡;进一步的, CARE 1.2 g/kg组和CRAE 2.4 g/kg组可以降低模型大鼠肺组织中的HA、PC-Ⅲ、LN、Hyp含量,提示CARE可以抑制胞外ECM的堆积,抑制大鼠的肺纤维化的生成。
在肺纤维化的发生过程中,大量的细胞因子如TNF-α、IL-17、IL-6等也发挥了重要的作用。TNF-α参与肺脏损伤,引起大量胶原合成和沉积,IL-17和IL-6是细胞炎性因子,介导肺脏炎症反应,导致肺纤维化[7]。在不同结构的TGF-β中,TGF-β1表达最久,作用最重要,其高低直接影响肺纤维化的程度。其信号主要是通过TGF-β跨膜受体(TGF-β receptor R,TGF-βR)及胞内Smad信号通路介导。当TGF-β1与TGF-βR结合后,可磷酸化胞内的Smad2和Smad3蛋白,继而与Smad4结合形成复合物(P-Smad2/3/4),转位入核调节相应靶基因的表达。Smad7可与TGF- TGF-βRⅡ结合,抑制Smad2/3磷酸化,从而抑制TGF-β/Smad通路[8-9]。PAI-1是TGF-β1重要的靶基因,作为纤溶酶原激活物抑制剂,能通过抑制纤溶酶的生成,增加细胞外基质的沉积[10]。在本次实验中, CARE 1.2 g/kg组和CRAE 2.4 g/kg组可以显著降低模型大鼠肺组织中P-Smad2和P-Smad3蛋白水平,升高Smad7的水平;而且CARE 1.2 g/kg组和CRAE 2.4 g/kg组还可以升高PAI-1蛋白和mRNA水平。以上结果提示CARE可以通过抑制TGF-β1/Smad通路中Smad2和Smad3的磷酸化水平,提高Smad7蛋白,降低PAI-1的表达,抑制肺纤维化的发生。
综上所述,CARE对百草枯引起的肺纤维化有一定的保护作用,其机制可能与抑制TGF-β1/Smad通路,上调Smad7表达,降低PAI-1表达等有关。

