澄清石灰水与二氧化碳气体反应的探究
伍强 赵贤祥 杜明桂
摘要: 设计将石灰水注入盛有二氧化碳气体的矿泉水瓶中,再剧烈振荡的实验探究方案。用发射光谱仪测定饱和澄清石灰水以及饱和碳酸氢钙溶液的总钙离子浓度,得出石灰水与二氧化碳反应生成浊液、胶体和溶液3种分散系所对应的饱和石灰水稀释倍数,这对实验教学有一定的指导意义。
关键词: 澄清石灰水; 二氧化碳; 碳酸钙; 碳酸氢钙; 实验探究
文章编号: 1005-6629(2018)4-0075-04 中图分类号: G633.8 文献标识码: B
饱和澄清石灰水至少稀释多少倍,再与CO2气体反应,反应液完全变澄清。有不少研究者做了实验探究,得出饱和石灰水稀释的倍数相差很大。
严宣申查阅了相关数据并做了实验探究。20℃时Ca(OH)2溶解度为0.165g(0.022mol·L-1),25℃和CO2分压为1.01×105Pa时CaCO3的溶解度为0.094g(0.0094mol·L-1)。CO2气体通入饱和澄清石灰水,溶液出现混浊,混浊度加大,而后混浊度减轻,但无论如何得不到澄清溶液[1]。用4~5倍水稀释饱和石灰水,再通入CO2后可得澄清溶液[2]。
许燕红等也查阅了相关数据并做了实验探究。18℃时Ca(OH)2的溶解度约为0.164g(0.022mol·L-1),18℃和CO2分压为9.95×104Pa时CaCO3的溶解度为1.086g·L-1(0.011mol·L-1)。在18℃实验时,饱和澄清石灰水与蒸馏水以30mL和20mL混合时,续通CO2气体8min以上混浊不能完全变澄清;以25mL和25mL混合时,续通CO2气体109.64s完全變澄清[3]。
为此,设计将石灰水注入盛有CO2气体的矿泉水瓶中,再剧烈振荡的实验探究方案,得出石灰水与CO2反应生成浊液、胶体和溶液3种分散系所对应的饱和石灰水稀释倍数。
1 饱和澄清石灰水的配制、取用和测定
饱和澄清石灰水的配制。取3000mL试剂瓶,加入30g分析纯Ca(OH)2,再加入蒸馏水,塞上橡皮塞不断摇动几分钟,静置一段时间再不断摇动几分钟,然后静置3天或更长时间。用激光笔照射石灰水无光路或极微弱光路(从垂直照射方向观察,下同)。
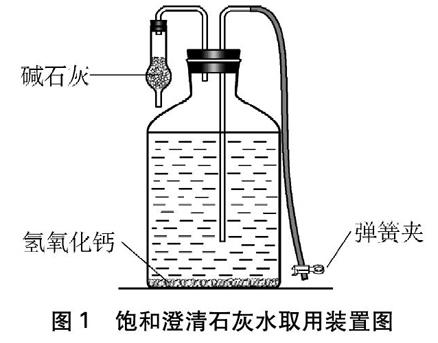
饱和澄清石灰水的取用。换上带有导管的橡皮塞,如图1所示,用洗耳球对准橡皮管口吸气,使澄清石灰水自动放出。
图1 饱和澄清石灰水取用装置图
饱和澄清石灰水总钙离子浓度的测定。取饱和澄清石灰水200mL,再加入1mL浓盐酸,测定总钙离子浓度。
实验时尽可能做到石灰水饱和、澄清、不与空气中CO2反应。本研究中总钙离子浓度均由美国Perkin Elmer公司制造(型号: OPTIMA8000)的电感耦合等离子体发射光谱仪来测定。
2 二氧化碳气体的制取和收集
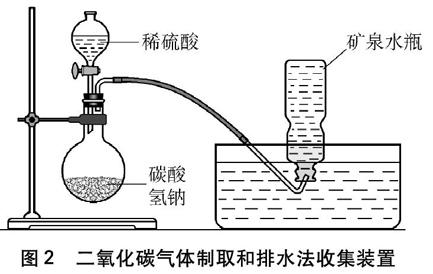
实验装置如图2所示,在烧瓶中加入适量的NaHCO3晶体,在分液漏斗中加入6mol·L-1H2SO4,用排水法将CO2气体收集到550mL矿泉水瓶中备用。大理石与稀盐酸反应制取的CO2气体中含有少量的HCl气体,因此本实验用NaHCO3晶体与稀H2SO4反应制取CO2气体,避免HCl气体的干扰。
图2 二氧化碳气体制取和排水法收集装置
3 生成饱和Ca(HCO3)2溶液时饱和石灰水稀释倍数
3.1 控制室内温度25℃的实验
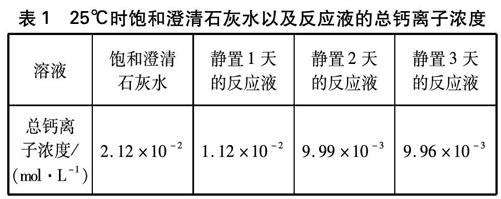
量取100mL饱和澄清石灰水,注入盛有CO2气体的矿泉水瓶中,旋紧瓶盖立即剧烈振荡,反应液先变混浊再变澄清(或微浊),用激光笔照射反应液有光路。静置几个小时(不可摇动),矿泉水瓶底黏附明显的白色沉淀物。以同样方法制备9个样品。静置1天,量取3个样品中反应液200mL再加入1mL浓盐酸,测定总钙离子浓度。分别静置2天、3天以同样方法测定反应液总钙离子浓度,结果见表1(注: 表中总钙离子浓度已不是原溶液总钙离子浓度,下同)。
表1 25℃时饱和澄清石灰水以及反应液的总钙离子浓度
静置2天与静置3天的反应液,其总钙离子浓度非常接近,且用激光笔照射反应液无光路,因此静置3天的反应液总钙离子浓度就是25℃、 CO2分压为1大气压时CaCO3的溶解度。要生成饱和Ca(HCO3)2溶液,饱和澄清石灰水稀释倍数: (2.12×10-2-9.96×10-3)÷(9.96×10-3)=1.13(倍)。
结论: 室内温度25℃时,饱和澄清石灰水以1∶1.13稀释(忽略溶液混合时体积的变化),反应生成饱和Ca(HCO3)2溶液。
3.2 控制室内温度20℃的实验
实验方法同上,测得各溶液总钙离子浓度见表2。
表2 20℃时饱和澄清石灰水以及反应液的总钙离子浓度
要生成饱和Ca(HCO3)2溶液,饱和澄清石灰水稀释倍数: (2.19×10-2-1.04×10-2)÷(1.04×10-2)=1.11(倍)。
结论: 室内温度20℃时,饱和澄清石灰水以1∶1.11稀释(忽略溶液混合时体积的变化),反应生成饱和Ca(HCO3)2溶液。
4 生成澄清CaCO3胶体时饱和石灰水稀释倍数
在室内温度为20℃至25℃时,取100mL饱和澄清石灰水再加20mL水(一般情况加10mL即可),注入盛有CO2气体的矿泉水瓶中,旋紧瓶盖立即剧烈振荡,反应液先变混浊再变澄清,静置几十天未见白色沉淀物,用激光笔照射反应液有光路。
结论: 室内温度20℃至25℃时,饱和澄清石灰水以1∶0.2~1∶1.1稀释,反应生成澄清的CaCO3胶体;大于1∶0.2稀释,反应可能生成CaCO3浊液;小于1∶1.1稀释,反应生成澄清的Ca(HCO3)2溶液。
5 碳酸钙的陈化现象
许多化合物都有陈化性质,只是陈化程度和陈化所需时间不尽相同而已。然而组成和结构的改变却是陈化的共同原因[4]。为探究CaCO3是否有明显的陈化现象,设计如下对比实验。
实验1 在室内温度为25℃时,取饱和澄清石灰水50mL再加60mL水,注入盛有CO2气体的550mL矿泉水瓶中,旋紧瓶盖立即剧烈上下振荡,连续5次,反应液由混浊变澄清。
实验2 实验方法与实验1大体相同,只是注入石灰水后先静置5min,然后剧烈上下振荡,连续50次,反应液仍然混浊。不时振荡,几个小时或几天后反应液也不变澄清。
结论: 澄清石灰水和CO2反应生成CaCO3,刚生成的CaCO3较易与CO2反应,生成的CaCO3静置几分钟后就难以再与CO2反应,CaCO3陈化现象明显。
气温越高,静置时间越长,陈化现象越明显。将石灰水置于广口瓶中,再通入CO2气体,生成的CaCO3与CO2没有充分接触,反应速率慢,CaCO3陳化现象明显,反应液难以变澄清。
6 实验探究的思考
有的研究者因忽略澄清石灰水与CO2气体反应生成胶体分散系以及CaCO3的陈化现象,仅凭理论计算求得25℃和CO2分压为1大气压时CaCO3的溶解度: 7.3×10-3mol·L-1[5]、 8.27×10-3mol·L-1[6]、 8.74×10-3mol·L-1[7]、 9.75×10-3mol·L-1[8],从而错误地认为澄清石灰水浓度大于CaCO3溶解度时(两者均以物质的量浓度表示),通入CO2气体反应液最终一定混浊;小于CaCO3溶解度时,反应液最终一定澄清。事实上,将浓度大于CaCO3溶解度的石灰水置于试管中,快速通入CO2气体有可能生成澄清的胶体;将浓度小于CaCO3溶解度的石灰水置于广口瓶中,缓慢通入CO2气体有可能生成浊液。严宣申老师用4~5倍水稀释饱和石灰水,再通入CO2后可得澄清溶液,并真实地记录了实验情况,这给了我们思考的空间。
在实验教学中可设计如下方案来演示实验: 室内温度20℃至25℃时,将饱和澄清石灰水以1∶0.2~1∶1.1稀释,注入盛有CO2气体的矿泉水瓶中再剧烈振荡。此方案使反应物充分接触,反应速率快,有效地防止CaCO3陈化,反应液呈现先变混浊再变澄清的实验现象。如果刻意得到饱和的Ca(HCO3)2溶液,则饱和澄清石灰水以1∶1.1稀释。制取浓度相对较大的澄清分散系,目的是演示Ca(HCO3)2热稳定性实验以及Ca(HCO3)2与NaOH溶液反应实验产生明显的实验现象。
参考文献:
[1][2][4]严宣申.化学实验的启示与科学思维的训练(第1版)[M].北京: 北京大学出版社, 1993: 15, 17, 36.
[3]许燕红等.二氧化碳使澄清石灰水先混浊后澄清的条件探究[J].化学教育, 2013,(8): 69.
[5]李友银.对二氧化碳通入饱和石灰水实验的再探究[J].中学化学教学参考, 2014,(8): 52.
[6]钟汝永.溶液中二氧化碳与碳酸钙反应的化学平衡常数推导[J].中学化学教学参考, 2015,(4): 56.
[7]钟汝永.澄清石灰水中通入过量二氧化碳未必能变清[J].教学仪器与实验, 2014,(11): 37.
[8]吴文中.澄清石灰水与二氧化碳的作用机理和实验探究[J].化学教学, 2017,(8): 53.

