一株耐高乙醇和低pH己酸产生菌Lysinibacillus fusiformispBE3-ep-SigB的构建
薛正楷,杨根庆,张宿义,倪 斌,5
(1.泸州职业技术学院 白酒学院,四川 泸州 646001;2.泸州市生物医学工程研究所,四川 泸州 646000;3.新乡医学院第三附属医院检验科,河南 新乡 453003;4.泸州老窖股份有限责任公司,四川 泸州 646002;5.泸州江潭窖酒业有限公司,四川 泸州 646005)
目前,中国白酒有12种香型,其中浓香型白酒以其芳香浓郁、绵柔甘洌、香味协调、入口甜、落口绵、尾净余长等特点,成为中国人青睐的白酒,其年产量占中国白酒总产量的70%以上。已有研究表明,浓香型白酒的风味物质有130余种,其中己酸乙酯是浓香型白酒的主体香物质,己酸乙酯含量的高低决定着浓香型白酒品质的高低[1-3]。
己酸是己酸乙酯的风味物质前体,其来源于浓香型白酒生产过程中的窖泥微生物,梭菌属(Clostridium)、芽孢杆菌属(Lysinibacillus)等属的专性厌氧微生物成为产己酸微生物的最重要类群,目前已发现的产己酸微生物包括Lysinibacillus fusiformis、Clostridium kluyveri、Lysinibacillus sphaericus、Clostridium sartagoneforme等菌株,这些菌株皆为专性厌氧微生物。
σ因子是一类启始细菌核糖核酸(ribonucleic acid,RNA)合成的蛋白质,其唯一功能是启始特定的RNA聚合酶结合到特定环境因素诱导下的特定基因的启动子,启动特定基因在特定时空条件下的转录,以利微生物抗环境胁迫的不利影响,被其选择表达控制的基因决定于基因的内在功能和环境信号的双重作用。σ70因子是一类管家基因SigA基因表达的分子质量70 kDa的蛋白质,控制细胞类大多数基因的转录合成;σB属于选择性σ因子,为革兰氏阳性菌特有的一类转录起始蛋白,其基因为SigB,在枯草芽孢杆菌(Bacillus subtilis)细胞内,σB调节大量一般应激操纵子的转录,从而促进转录的200多个基因参与热、酸、乙醇、盐和氧化应激性[4-7]。
近年,对转录因子进行易错聚合酶链式反应(erro-prone polymerasechainreaction,epPCR)突变筛选有义突变,成为微生物育种的重要方法。张赛等[8]运用定向进化-易错PCR方法获得了耐高温和低pH的突变酶,其酶活力比野生酶分别提高了6.5倍、21.0倍和12.6倍;王睿等[9]用同样的进化方法提高了华根霉Rhizopus chinensisCCTCC M201021的脂肪酶活力,其最佳突变株脂肪酶酶活与野生菌株相比分别提高2倍和4倍;汪先薇[10]利用易错PCR构建突变库时,获得大片段的基因簇突变库;王聪等[11]利用实时-荧光定量-聚合酶链反应(real time-fluorescence quantitive-polymerase chainreaction,RT-FQ-PCR)对耐高渗基因的表达变化研究发现,T酵母能够耐高渗是由于甘油的合成迅速同时外排通道被关闭,使得胞内甘油的含量升高,保证T酵母的正常生长;李璟等[12]采用易错PCR方法对枯草芽孢杆菌脂肪酶基因lipaseA进行定向进化,突变株4B2发酵上清液转化生物柴油的转酯效率较对照菌pET 32a-lipaseA有明显提高,前者为79.5%,后者为49.72%。
目前,己酸菌育种菌均采用窖泥分离并产酸鉴定,发酵条件优化后,直接用于生产[13-17],并对其抗胁迫能力的研究及基因工程育种,国内外少见报道。由于产己酸微生物在窖池中伴随糟醅的发酵过程,始终处于低pH、高乙醇浓度等高胁迫不良环境中,如何提高抗胁迫基因的表达,成为产己酸微生物生死悠关分子进化策略。为了提高产己酸菌的抗胁迫能力,因此,本研究尝试以Lysinibacillus fusiformis为出发菌,利用易错PCR筛选有义突变技术分别转染SigA和SigB基因,获得抗高乙醇和低pH胁迫的优良己酸产生工程菌,为己酸的选育提供理论依据和应用基础。
1 材料与方法
1.1 材料与试剂
1.1.1 质粒与菌株
穿梭质粒pBE3-MCS:由南昌大学生命科学院提供;菌株Lysinibacillusfusiformis:由本研究所分离并保存;pET32a(+)-SigA和pET32a(+)-SigB:由本研究所构建并保存。
1.1.2 培养基
LB培养基:胰蛋白胨10 g,酵母浸粉5 g,氯化钠10 g,蒸馏水1 000 mL,调pH 7.0±0.2,固体培养基加入15 g琼脂,121℃灭菌30 min。
改良麦氏培养基:葡萄糖1.0 g,KCl 1.8 g,酵母膏4 g,醋酸钠15 g,固体培养基加入琼脂15 g,蒸馏水1 000 mL,pH自然,121℃灭菌30 min,使用前加入20 mL无水乙醇。
乙酸钠培养基:葡萄糖1.0 g,KCl 1.8 g,酵母膏2.5 g,醋酸钠8.2 g,固体培养基加入琼脂15 g,蒸馏水1 000 mL,pH自然,121℃灭菌30 min,使用前加入10 mL无水乙醇。
1.1.3 试剂
限制性核酸内切酶XbaI、HindIII、KpnI:美国Thermos Fisher Scientific公司;T4脱氧核糖核酸(deoxyribonucleic acid,DNA)连接酶、DNALigationKitVer.1(CodeNo.6021):大连TaKaRa公司;小量质粒抽提试剂盒、普通琼脂糖凝胶回收试剂盒(DP209)、DNA纯化试剂盒、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)和DNA Marker:天根生化有限公司;易错PCR试剂盒:天恩泽生物技术有限公司;PCR引物:由捷瑞生物工程有限公司合成;卡那霉素(分析纯):湖北信康医药化工有限公司;氨苄青霉素(分析纯):杭州百思生物技术有限公司。
1.2 仪器与设备
BSD-YF3600全温培养摇床:上海博迅医疗生物仪器股份有限公司;TGL-16M台式高速冷冻离心机:金坛市良友仪器有限公司;WD-9413A型凝胶成像分析仪、DYY-8C电泳仪:北京市六一仪器厂;NanoDrop 2000微量紫外分光光度计:美国Bio-Rad公司;SmartSpecPlus核酸蛋白分析仪:美国伯乐公司;SC-B梯度PCR仪:杭州艾普仪器设备股份有限公司;GC-2014气相色谱仪:日本岛津公司;YQX-II厌氧培养箱:上海衡柏实验设备有限公司;Scientz-2C基因导入仪:宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 重组菌的构建筛选与引物的设计
Lysinibacillus fusiformis SigA/SigB原位超表达菌株构建按照如下流程进行。
为了从pET32a(+)-SigA和pET32a(+)-SigB重组质粒获得目的基因SigA和SigB基因,参考pET32a(+)质粒、SigA、SigB及酶切位点基因序列,采用Primerpremier5.0软件设计SigA和SigB基因的上下游引物,结果见表1。SigA和SigB基因的上下游引物分别带有XbaI、HindIII和KpnI酶切位点,设计的引物由上海捷瑞生物技术公司合成。

表1 扩增SigA/SigB基因的引物设计Table 1 Design of primer sequences for amplification of SigA/SigBgene
1.3.2 pET32(+)-SigA/SigB重组质粒的提取
取E.coliBL21(DE3)/pET32a(+)-SigA/SigB,单菌落接种至5 mL含100 μg/mL氨苄青霉素LB培养基中,37℃、200 r/min振荡培养12 h,采用天根公司质粒小提试剂盒DP103)提取质粒pET32a(+)-SigA/SigB,采用微量紫外分光光度计分别测定重组质粒浓度和波长分别为260 nm、280 nm处的吸光度值比值(A260nm/A280nm)。
1.3.3 易错PCR条件的优化
在PCR过程中Mg2+可以稳定非互补的碱基对,而Mn2+可以降低聚合酶对模板的特异性,因而调整两种离子的浓度,可以获得不同突变频率的多样性文库。本研究选择Mn2+浓度为0.3~0.8mmol/L,Mg2+浓度为3~7mmol/L作为梯度进行epPCR试验。采用数据处理系统(dataprocessingsystem,DPS)7.5对Mn2+浓度和Mg2+浓度进行2因素6水平U6(62)的均匀试验设计,其设计方案见表2。

表2 U6(62)均匀试验设计Table 2 U6(62)design of uniform experiments
以重组质粒pET-32a(+)-SigA/SigB为模板,按下列PCR体系和条件进行ep PCR。反应体系:10×Mix 5 μL,三磷酸腺嘌呤脱氧核苷酸(deoxyadenosine triphosphate,dATP)、三磷酸脱氧胸苷(deoxy-thymidine triphosphate,dTTP)、三磷酸脱氧鸟苷酸(deoxyguanosine triphosphate,dGTP)和三磷酸脱氧胞苷(deoxycytidine triphosphate,dCTP)各2.5 μL,模板1 μL,上下游引物各1 μL,Mn2+和Mg2+按表2进行添加,Taq酶2 μL,补双蒸水至50 μL。
反应条件:SigB基因:94℃预变性5 min;94℃变性1 min,45℃退火1 min,72℃延伸2 min,40个循环;72℃再延伸10 min。SigA基因:94℃预变性5 min;94℃变性1 min,58℃退火1 min,72℃延伸1.2 min,32个循环;72℃再延伸10 min。
利用1%琼脂糖电泳确认PCR产物,采用天根胶回收试剂盒回收特异性高条件下的目的基因片段,用已回收片段为模板按第一轮ep PCR方案进行第二轮ep PCR,选取特异性高的ep PCR条件进行第二轮ep PCR,回收二轮易错产物于-20℃备用。
1.3.4SigA/SigB基因ep PCR突变文库的构建
双酶切:取第二轮易错PCR纯化产物SigA、SigB基因和穿梭载体pBE3-MCS,分别采用XbaI/HindIII和KpnI/HindIII进行双酶切,酶切体系和条件见表3。酶切产物经1%琼脂糖凝胶电泳确定酶切效果。
纯化:取酶切效果良好产物,采用天根公司普通琼脂糖凝胶回收试剂盒(DP209)对SigA、SigB基因和穿梭载体pBE3-MCS的双酶切产物进行回收,对回收产物进行DNA浓度和纯度检测。

表3 易错PCRSigA/SigB基因和pBE3-MCS双酶切体系及条件Table 3 Double enzyme digestion system and conditions of error-prone PCRSigA/SigBgene and pBE3-MCS
连接:按照DNA Ligation Kit Ver.1(Code No.6021)说明书,各取8 μLSigA和SigB纯化酶切产物,分别加入2 μL pBE3-MCS片段配制成混合溶液,加入10 μL溶液I,充分混匀,16℃反应30 min后,分别加入1 μL溶液III混匀。
转化:各取10μL连接体系加入到200μLBL21(DE3)感受态细胞中进行转化,各取100μL转化细胞涂至含100μg/mL氨苄青霉素的LB平板上,37℃培养18 h,获得SigA和SigB基因易错PCR突变文库。
菌落PCR验证:各取含100 μg/mL氨苄青霉素的LB液体培养基3 mL注入E.coliBL21(DE3)/pBE3-ep-SigA/SigB平板中,洗下单菌落加入到10 mL试管,补充含100 μg/mL的LB液体培养基至5 mL,于37℃、200 r/min条件下振荡培养12 h后,进行菌液PCR鉴定。
双酶切验证:经菌液PCR验证后,挑取阳性克隆子的重组质粒进行双酶切验证。
1.3.5L.fusiformis-pBE3-ep-SigA/SigB工程菌的构建
提取阳性克隆子菌液质粒,经电转化导入L.fusiformis感受态细胞中。电转化参数为电压2 000 V,电容25 μF,电阻200 Ω,时间5.2 ms。取200 μL转化液涂至含卡那霉素(50μg/mL)和2%乙醇的乙酸钠培养基平板,34℃培养16h。
1.3.6 抗高乙醇和低pH己酸产生菌株L.fusiformis-pBE3-ep-SigA/SigB的筛选
己酸含量的检测:参考薛正楷等的方法[15]。
乙醇耐受性的测定:取2mL含2%乙醇的改良麦氏培养基加入到1.3.5的平板上,洗涤克隆子,取200 μL洗涤液加入到含2%、4%、6%、8%、10%、12%乙醇和50 μg/mL卡那霉素的10mL乙酸钠培养基中,90℃水浴5min,置于0.08MPa、34℃真空培养箱中静置培养1 d后,按50 μg/mL加入卡那霉素继续培养10 d,观察气泡出现时间并检测10 d发酵液中己酸含量。
pH耐受性的测定:按5%接种量接种至pH值为2.5、3.0、3.5、4.0、4.5和5.0的10 mL最大乙醇含量且能产气泡的改良麦氏培养基中,培养至产气泡,取pH值耐受性最高且产气改良麦氏培养基涂板,随机挑选10个单克隆子至10 mL含8%的乙醇和50 μg/mL的卡那霉素改良麦氏培养基中,培养10 d,检测己酸含量。
1.3.7 抗高乙醇和低pH己酸产生菌株L.fusiformis-pBE3-ep-SigB的鉴定
菌落PCR鉴定:采用下列PCR体系和条件对1.3.5项下单克隆菌液,进行菌液PCR鉴定,反应体系:2×Tsingke mastermix25μL,模板1μL,上下游引物各1μL,菌液0.3μL,补双蒸水到50 μL;反应条件同1.3.3。
测序结果分析:取PCR鉴定阳性菌液1 mL送上海生工生物工程有限公司进行基因测序,
将测序结果与美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)数据库进行比对分析。
2 结果与分析
2.1 SigA/SigB基因易错PCR条件的优化
按照均匀试验设计,对L.fusiformis SigA/SigB基因进行随机突变,结果见图1。

图1 SigA/SigB基因易错PCR结果Fig.1 Results of error-prone PCR ofSigA/SigBgene
由图1A可知,SigB基因第一轮PCR产物中,所有条件下的SigB基因均较清晰,本试验选用试验5号条件进行SigB基因第二轮PCR扩增,电泳检测结果见图1B。由图1B可知,SigB第二轮易错PCR扩增产物以试验5号条件为最好,因此,本试验采用试验5号条件进行第二轮SigB基因的易错PCR扩增。由图1C可知,在SigA基因的第一轮PCR产物中,试验5号产物浓度较高,且特异性较高,因此本试验采用试验5号条件进行第二轮PCR扩增,结果见图1D。由图1D可知,相对于其他易错PCR体系而言,试验4号为SigA基因较为适宜的第二轮PCR条件,因此,本试验采用试验4号进行SigA基因的第二轮PCR扩增。
2.2 SigA/SigB基因易错PCR突变库的构建与初步鉴定
以优化的易错PCR条件和第一轮易错PCR产物为模板,分别对SigA和SigB为模板进行第二轮PCR扩增,将第二轮扩增产物扩增产物进行胶回收纯化,将纯化产物和pBE3-MCS分别用XbaI/HindIII和KnpI/HindIII进行双酶切,并对酶切产物采用Takara连接试剂盒进行连接,连接产物转化感受态大肠杆菌BL21,按每板100 μL接种至含50 μg/mL卡那霉素平板中,34℃培养14 h,观察转化板菌落,获得SigA/SigB易错PCR突变库。
取1mL含50 μg/mL卡那霉素LB培养基,加入易错PCR突变库平板中,洗出易错PCR突变库平板克隆子,接种至3支5mL含50μg/mL卡那霉素LB培养基中,于34℃、180r/min条件下培养14 h,取3 μL进行菌液PCR鉴定。提取PCR鉴定正确的菌液质粒,进行双酶切鉴定,结果见图2。
由图2可知,提取的重组质粒PBE3-ep-SigA和PBE3-ep-SigB分别经XbaI-HindIII和KnPI-HindIII双酶切后,在1100bp左右(图2A)和900 bp多(图2B)有条带,分别与SigA和SigB基因大小相符合,说明工程菌E.coliBL21(DE3)/PBE3-ep-SigA/SigB构建成功。
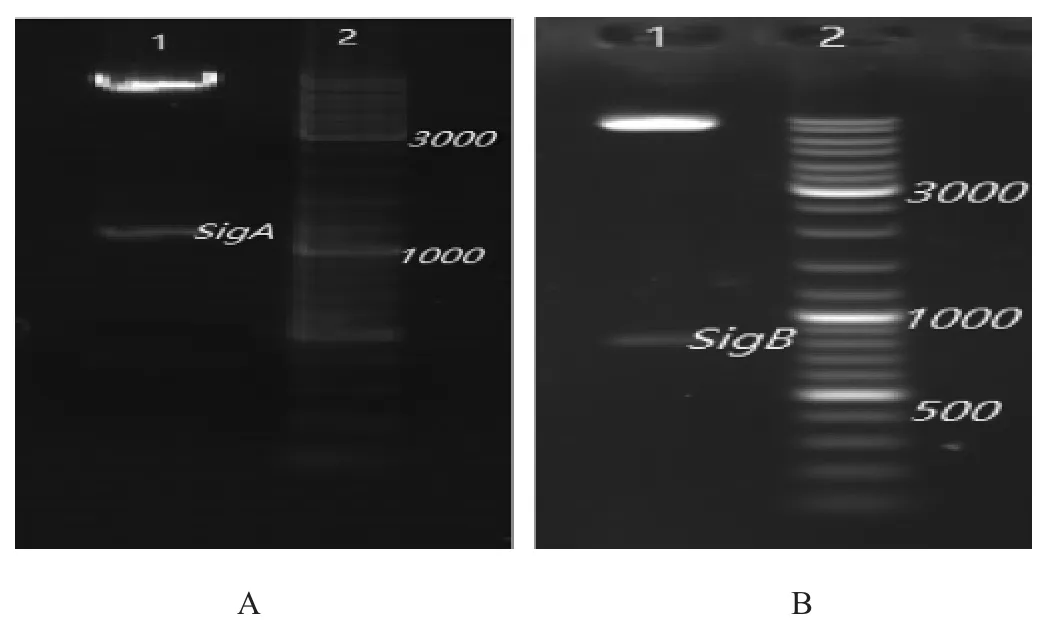
图2 重组质粒PBE3-ep-SigA和PBE3-ep-SigB双酶切结果Fig.2 Results of double enzyme digestion of recombinant plasmid PBE3-ep-SigAand PBE3-ep-SigB
2.3 抗高乙醇和低pH己酸产生菌株L.fusiformis-pBE3-ep-SigA/SigB的筛选
检 测 菌 株L.fusiformis、L.fusiformis-PBE3-SigA、L.fusiformis-PBE3-SigB、L.fusiformis-PBE3-ep-SigA和L.fusiformis-PBE3-ep-SigB发酵10 d后发酵液中的己酸含量,结果见表4。

表4 不同胁迫条件下的己酸产量比较Table 4 Comparison of caproic acid yield under different stress conditionsmg/100 mL
由表4可知,在抗乙醇胁迫条件下,出发菌L.fusiformis的抗乙醇最高浓度为4%,其己酸含量为264.35 mg/mL;L.fusiformis-PBE3-SigA和L.fusiformis-PBE3-SigB的抗乙醇浓度为6%左右,其己酸浓度分别为175.45 mg/mL和198.46 mg/mL;L.fusiformis-PBE3-ep-SigA和L.fusiformis-PBE3-ep-SigB的耐乙醇浓度为8%左右,其己酸浓度为137.45 mg/mL和277.68 mg/mL,因此,出发菌转入SigA和SigB基因获得的重组菌株及其易错PCR重组突变菌株均能提高其在胁迫条件的产己酸能力,且L.fusiformis-ep-SigB在高乙醇浓度条件下的产己酸能力高于L.fusiformis-PBE3-ep-SigA达102%;在抗pH值胁迫条件下,出发菌L.fusiformis和重组菌L.fusiformis-PBE3-SigA、L.fusiformis-PBE3-SigB的抗pH均为3.5,其己酸产量分别为23.54mg/100mL、86.36mg/100mL和96.43mg/100mL,但重组菌己酸产量高于出发菌,易错PCR重组菌L.fusiformis-PBE3-ep-SigA和L.fusiformis-PBE3-ep-SigB的抗pH值分别为3.0和2.5,其己酸产量分别为35.44 mg/100 mL和77.00 mg/100 mL,因此在pH胁迫条件下,易错PCR重组菌L.fusiformis-PBE3-ep-SigB产己酸量高于易错PCR重组菌L.fusiformis-PBE3-ep-SigA达263.7%,因此,本研究采用L.fusiformis-PBE3-ep-SigB菌株进行后续研究。
2.4 抗高乙醇和低pH己酸产生菌株L.fusiformis-ep-SigB的鉴定
从L.fusiformis-PBE3-ep-SigB突变库中,随机挑取6个单克隆进行菌落PCR鉴定,结果见图3。由图3可知,PCR产物电泳条带与目的基因大小相符,说明L.fusiformis-PBE3-ep-SigB单克隆菌株构建成功。

图3 L.fusiformis-PBE3-ep-SigB的PCR鉴定结果Fig.3 Results of PCR identification ofL.fusiformis-PBE3-ep-SigB
2.5 L.fusiformis-ep-SigB产己酸鉴定
经菌落PCR验证正确的菌株L.fusiformis-PBE3-ep-SigB在8%乙醇浓度,pH3.5条件下发酵10 d,采用气相色谱测定发酵液中的己酸含量,结果见表5。由表5可知,在高酸度和高乙醇浓度发酵条件下,L.fusiformisPBE3-ep-SigB产己酸能力显著高于L.fusiformis-PBE3-SigB和L.fusiformis(P<0.01),说明成功选育高抗性产己酸工程菌株。
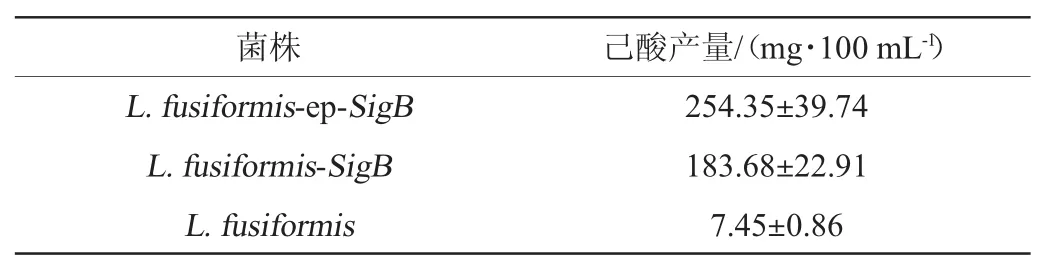
表5 高抗性产己酸菌株的己酸产量测定结果Table 5 Determination results of caproic acid yield for caproic acid-producing strain with high resistant
2.6 L.fusiformis-ep-SigB产己酸菌株的测序鉴定
取取己酸产量最高的菌酸菌菌液500 μL,送上海生工进行测序结果,将测序结果采用NCBI工具blast(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行比较,结果见图4。

图4 L.fusiformis-ep-SigB菌株突变株测序结果Fig.4 Sequencing results of mutant strain ofL.fusiformis-ep-SigB strain
由图4A可知,L.fusiformis-ep-SigB突变株的易错基因(SigBv)与出发基因(SigB)相比,有7个点突变位点,分别是95位(C→G)、232位(A→T)、324位(T→A)、505位(C→G)、545位(C→G)、602位(G→C)、723位(A→T);由图4B可知,其蛋白质序列有44位(T→R)、81位(N→Y)、100位(H→Q)、176位(H→D)、198位(T→R)、208位(R→P)、251位(Q→H)共7个氨基酸发生突变。
3 结论
σ因子SigA和SigB基因经优化的易错PCR条件进行两轮易错PCR突变,分别建立SigA和SigB的易错PCR突变库,通过epSigA/SigB基因与表达载体pBE3-MCS连接,构建L.fusiformis-PBE3-ep-SigA和L.fusiformis-PBE3-ep-SigB菌体库,将两种菌体库在pH值2.0~5.0和乙醇含量2%~12%条件下进行筛选。结果表明,L.fusiformis-PBE3-ep-SigB重组菌株最高耐乙醇含量为8%左右,最低耐pH值为2.5左右;当乙醇含量为8%、pH值为3.5时,L.fusiformis-PBE3-ep-SigB重组菌株的己酸产量到达(254.35±39.74)mg/100 mL,为出发菌L.fusiformis己酸产量(93.62±10.33)mg/100 mL的271.68%,表明L.fusiformis-PBE3-ep-SigB重组菌株是具有较强的抗高乙醇浓度和低pH值胁迫能力的优良己酸产生菌株。
1]FAN W,QIAN M C.Characterization of aroma compounds of Chinese"Wuliangye"and"Jiannanchun"liquorsbyaroma extract dilution analysis[J].J Agric Food Chem,2006,54(7):2695-704.
2]ZHAO C,YAN X,YANG S,et al.Screening ofBacillus,strains from Luzhou-flavor liquor makingfor high-yield ethyl hexanoate and low-yield propanol[J].LWT-Food Sci Technol,2017,77:60-66.
3]中华人民共和国卫生部,中国国家标准化管理委员会.GB/T 10781.1—2006浓香型白酒[S].北京:中国标准出版社,2006.
4]胡晓龙.浓香型白酒窖泥中梭菌群落多样性与窖泥质量关联性研究[D].无锡:江南大学,2015.
5]ABRAM F,STARR E,KARATZAS K,et al.Identification of components of the sigma B regulon inListeria monocytogenesthat contribute to acid and salt tolerance[J].Appl Environ Microbiol,2008,74(22):6848-6858.
6]LARISCH C,NAKUNST D,HÜSER A T,et al.The alternative sigma factorSigBofCorynebacterium glutamicummodulates global gene expression during transition from exponential growth to stationary phase[J].BMC Genom,2007,8(1):4-4.
[7]ZHANG Q,FENG Y,ZHOU Q,et al.Contribution of sigma b to environmental stress tolerance inListeria monocytogenes-a review[J].Acta Microbiol Sinica,2009,49(10):1282-1288.
[8]张 赛,邢克克,胡亚冬,等.基于易错PCR的黄曲霉毒素解毒酶体外分子定向进化[J].生物工程学报,2011,27(7):1100-1108.
[9]王 睿,喻晓蔚,沙 冲,等.定向进化-易错PCR方法提高华根霉Rhizopus chinensisCCTCC M201021脂肪酶的活力[J].生物工程学报,2009,25(12):1892-1899.
[10]汪先薇.一种利用整合酶位点特异性重组构建随机突变库的方法[J].基因组学与应用生物学,2017(6):2440-2446.
[11]王 聪,王 檬,赫景钰,等.酱油酿造风味菌株T酵母耐盐机理的初步研究[J].中国酿造,2015,34(2):26-30.
[12]李 璟,童 晋,罗明银,等.枯草芽孢杆菌脂肪酶基因lipaseA突变文库构建及其生物柴油转酯研究[J].浙江农业学报,2016,28(5):864-869.
[13]HU X L,DU H,XU Y.Identification and quantification of the caproic acid-producing bacteriumClostridium kluyveriin the fermentation of pit mud used for Chinese strong-aroma type liquor production[J].Int J Food Microbiol,2015,214:116-122.
[14]彭 兵,祝 熙,李忠奎,等.窖泥高产己酸菌分离鉴定及培养条件优化的研究[J].中国酿造,2016,35(5):43-46.
[15]薛正楷,薛 原.一株窖泥己酸菌株的多相鉴定及产酸研究[J].酿酒科技,2016(6):65-71.
[16]赵 辉,敞 颜,王 葳,等.浓香型白酒窖泥中高产己酸兼性厌氧细菌的分离鉴定[J].食品科学,2012,33(5):177-182.
[17]刘 雪,杨爱华,曹建全,等.己酸菌的分离筛选及发酵条件优化[J].酿酒,2016,43(6):37-40.

