快速溶剂萃取-高效液相色谱法联用测定坚果中α维生素E的含量
(北京吉天仪器有限公司,北京 100015)
1 引言
维生素E(VE),又被称作生育酚,1922年首次由生物学家 Evans 等人在研究老鼠繁殖时发现[1]。因其具有天然抗氧化能力而广泛应用。维生素E是一种脂溶性抗氧化剂,因能够阻断自由基链式反应,从而抑制油脂的氧化[2],被称为是最有效的抗氧化剂。维生素E包含α、β 、γ、δ 4种生育酚,广泛存在于动植物脂肪、大多数植物油和叶绿植物中,其中α-生育酚的生理活性和抗氧化能力最强[3]。
传统的提取技术包括索氏提取,超声萃取,超临界萃取等技术,但这些技术存在有机溶剂使用量多,萃取时间较长,萃取效率低等不足[4]。郑熠斌[5]等人利用皂化法,使用乙醚-石油醚(V∶V=1∶1)作为提取溶剂,对食品中的维生素E进行提取,该提取方法比较繁琐,自动化程度低;陈燕舞[6]等人利用皂化法使用无水乙醚提取油样中的维生素E,使用溶剂多,操作步骤复杂。
快速溶剂萃取是一种新的萃取技术,在高温高压下,样品与液态溶剂接触,从而能够快速和高效萃取多种样品基质中的分析物。与传统的提取方法(如浸渍、索氏提取法)相比,快速溶剂萃取具有萃取高效、快速的优点,平均萃取时间少于15min。此外,快速溶剂萃取技术广泛应用于分析沉积物、污泥等多个领域中的农药残留、多环芳烃、多氯联苯等污染物[7-9],已被美国国家环保局(EPA)选为推荐的样品前处理标准方法[10]。
本实验以杏仁为例,采用快速溶剂萃取前处理技术,通过高效液相色谱对萃取的α维生素E(αVE)含量进行测定,并对萃取方法进行优化得出最佳萃取条件,以优化后的条件对生花生,山核桃,杏仁以及葵花籽四种坚果样品进行前处理以及含量的测定。
2 实验部分
2.1 仪器和试剂
APLE-3500快速溶剂萃取仪,配11mL萃取池(北京吉天仪器有限公司);LC-10A高效液相色谱仪(日本岛津公司);分析天平(赛多利斯科学仪器(北京)有限公司,十万分之一);TM-2000超级恒温混匀仪(北京吉天仪器有限公司)。
无水乙醇、正己烷、甲醇均为色谱纯,使用前超声脱气;α-VE标准物(北京中标物科技有限公司)。
杏仁、葵花籽、生花生、山核桃样品市购,取可食部分进行样品处理。
2.2 标准曲线配制和色谱图
精确称取α-VE标准品100.0mg,用无水乙醇溶解后,转移到100mL容量瓶中,定容至刻度,得到标准储备液,浓度为1.00mg/mL,于-20℃冰箱中储存。准确吸取标准储备液5.00mL于同一50mL容量瓶中,用甲醇定容至刻度,得到标准中间液,浓度为100μg/mL。准确吸取标准中间液0.20mL、0.50mL、1.00mL、2.00mL、4.00mL、6.00mL于10mL容量瓶中,用甲醇定容至刻度,配置浓度分别为2.00μg/mL、5.00μg/mL、10.00μg/mL、20.00μg/mL、40.00μg/mL、60.00μg/mL的α-VE标准溶液。
2.3 样品制备
准确称取粉碎好的坚果样品(生花生、山核桃、杏仁、葵花籽)2.00g,硅藻土和杏仁质量比为1∶1混匀倒入预装纤维素膜的11mL萃取池中,萃取溶剂为正己烷,温度110℃,萃取时间300s,循环两次,萃取结束后将收集瓶中的萃取液全部转移到容量瓶中并定容至10mL,涡旋振荡均匀澄清后,取1mL过0.45μm滤膜,待HPLC分析。
2.4 色谱条件
液相色谱采用二元高压梯度洗脱方式。色谱柱选用了Athena C18柱,4.6×250mm,粒径5μm;流速:0.8mL/min;波长:294nm;进样量:20μL。梯度洗脱程序如表1所示。

表1 梯度洗脱程序
2.5 重复性试验
精确吸取20 μL一定浓度的α-VE标准溶液,在2.4色谱条件下进行6次重复实验,在该条件下保留时间的相对标准偏差为0.10%,峰面积的相对标准偏差为0.22%,表明仪器的精密度良好。
2.6 线性范围和检出限
按照2.4的色谱条件,对配制的不同浓度标准系列溶液进行分析,从低浓度到高浓度进样,在线性范围2~100μg/mL的条件下,得出标准曲线为Y=11037.30645X+4764.28303,相关系数r=0.9999,标准曲线如图1所示,α-VE的质量浓度与其峰面积线性关系良好。α-VE标样(40μg /mL)的高效液相色谱图见图2。以3倍信噪比确定最低检出限,检出限为0.04μg/mL。

图1 α-VE标准溶液的线性曲线
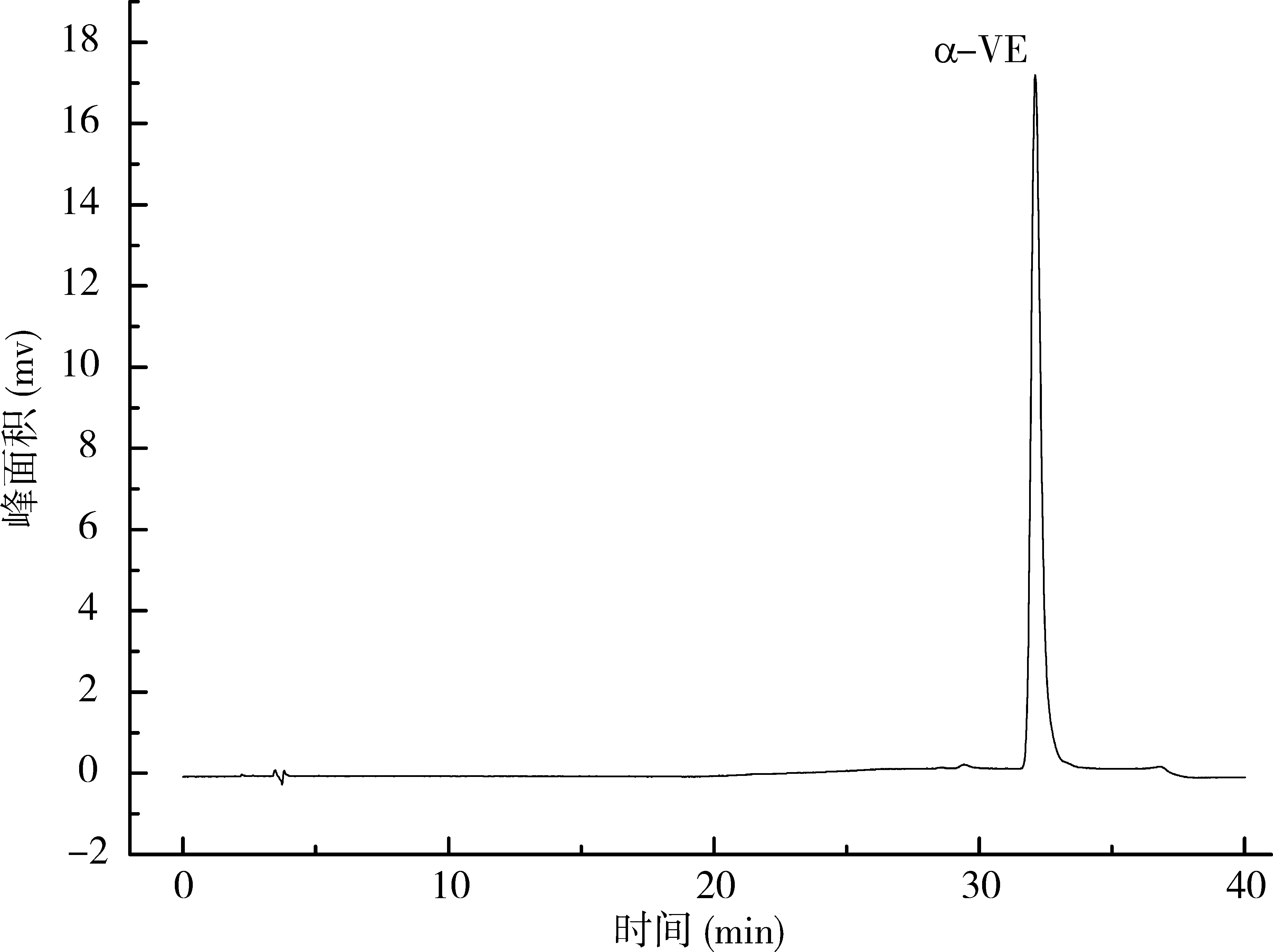
图2 α-VE标准溶液色谱图(40 μg/mL)
2.7 方法回收率实验
选取杏仁作为基质样品,根据2.3样品制备和萃取条件,并加入一定量的α-VE标准溶液,考察α-VE的加标回收情况。实验结果表明加标回收率均符合日常分析检测的要求,α-VE的加标回收率详见表2。

表2 加标回收率实验
2.8 样品测定
根据2.3萃取条件和2.4色谱条件,分别测定市购的4种坚果中α-VE含量,结果如表3。从表中可以得出,坚果中含有丰富的α-VE。4种坚果的液相色谱图如图3所示,峰分离良好。

表3 不同坚果α-VE的测定

图3 不同坚果中α-VE的液相色谱图
3 结果与讨论
3.1 色谱条件的选择
参考苏琨[11]等人的工作,本实验选用Athena C18柱(4.6×250mm,5μm)作为色谱分离柱。通过查阅资料发现,甲醇和水作为流动相对于分离α-VE是相对合适的溶剂,在甲醇∶水(96∶4)的条件下,分离得到的α-VE得到的峰形尖锐良好,以及在样品中干扰物能够得到较好的分离,流速设为0.8mL/min时,α-VE出峰时间合适,干扰少,在294nm 处有最大吸收峰,根据以上色谱条件进样,标准溶液以及实际样品的色谱图如图2和图3所示。
3.2 提取溶剂的选择
实验以杏仁为对象,对样品萃取溶剂进行了考察,通过查阅资料发现,常用正己烷、甲醇、无水乙醇溶剂对α-VE进行萃取[11]。分别称取2.00g杏仁样品与等量硅藻土混匀,并将其填入萃取池内,在设置温度为110℃,静态循环1次,萃取时间300s的条件下,分别用上述不同溶剂进行萃取,计算收集液α-VE的提取量。实验结果如图4所示,当提取溶剂为正己烷和甲醇时,对杏仁中α-VE提取量相差不多。在甲醇、无水乙醇以及正己烷这3种溶剂中,正己烷沸点最低,在后续氮吹浓缩过程中挥发速度最快,容易去除,所以本实验选择正己烷作为萃取溶剂。

图4 萃取溶剂对α-VE提取量的影响
3.3 萃取温度的优化
萃取温度是快速溶剂萃取的重要参数。高温有利于萃取效率的提高,温度增加,溶剂粘度降低,溶剂对基质的浸润能力增强,溶剂对分析物质的溶解能力增大。而且高温能够加速分析物向基质表面的扩散速度,萃取效率从而得到提高。
分别称取2.00g杏仁样品与等量硅藻土混匀,置于11mL萃取池当中,以100%正己烷为萃取溶剂,对90,110,130,150℃4种不同萃取温度进行了考察,萃取参数如下:静态萃取时间300s,循环次数1次。然后按2.4色谱条件对杏仁中的α-VE进行分析测定。如图5结果表明,当温度低于110℃时,α-VE的提取量随温度的升高而增加,温度为110℃时,α-VE的提取量最高,达到3.74μg/g;当温度高于110℃时,提取量随温度升高而降低。造成此现象的原因可能是由于温度过高,热溶剂的蒸发导致提取量降低。综合考虑,实验确定110℃为最佳萃取温度。

图5 不同萃取温度对α-VE提取量的影响
3.4 萃取时间的优化
萃取时间的长短与样品中待提取成分在溶剂中扩散程度有关,增加萃取时间有利于待萃取物质从样品基质扩散到提取溶剂中。本实验以100%正己烷为提取溶剂,提取温度为110℃,对60、100 、300 、480s 不同萃取时间进行了考察,然后按2.4色谱条件进行α-VE的含量进行测定。实验结果如图6所示,随着萃取时间的增加,杏仁中α-VE的提取量先出现增加的趋势,萃取时间达到300s时,α-VE的提取量最大,当时间为480s时,同300s比较,提取量基本不变。可以得出,当静态萃取时间为300s 时,α-VE的提取量达到最大值,故本实验选择300s 作为静态萃取的最佳时间。
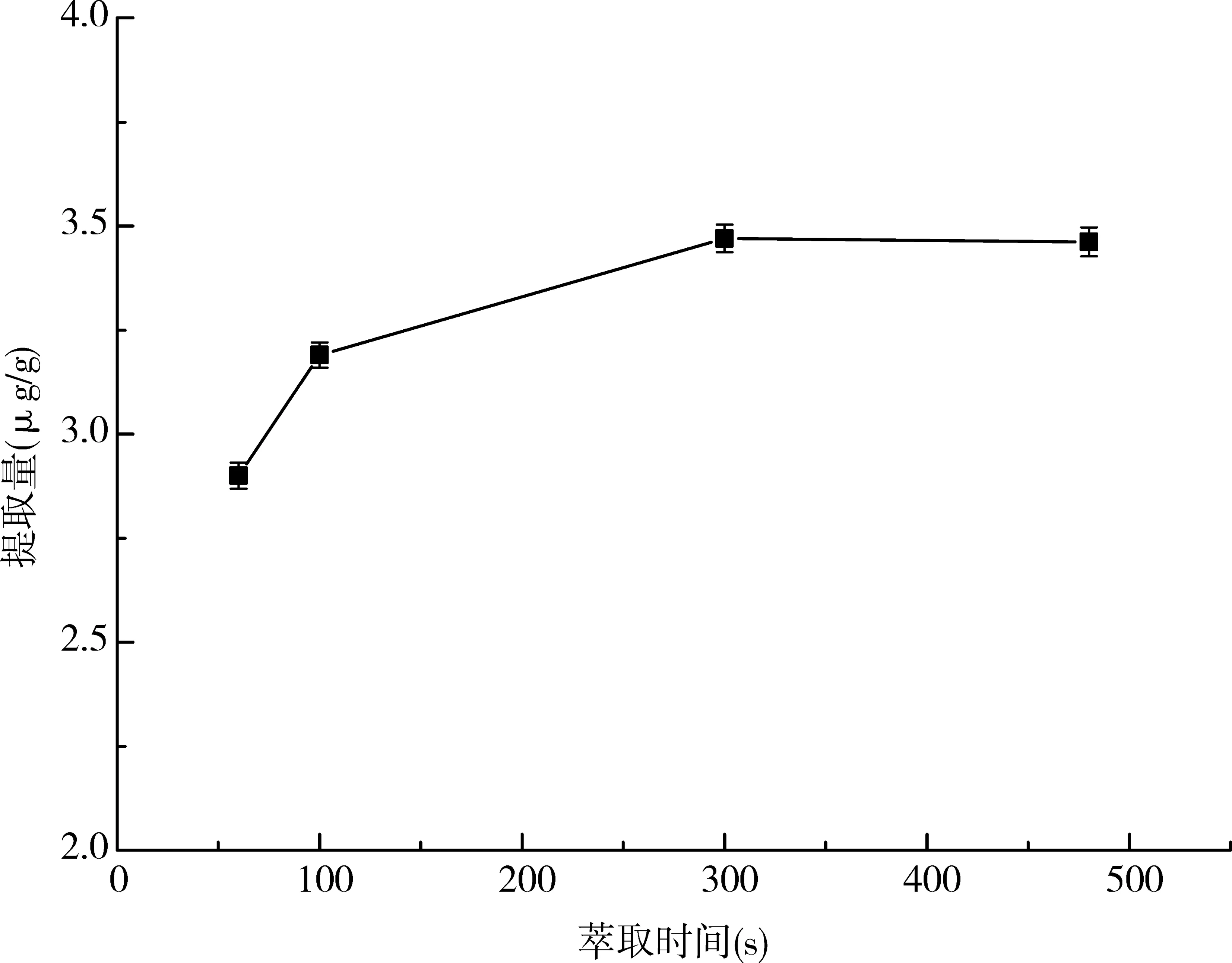
图6 不同萃取时间对α-VE提取量的影响
3.5 萃取循环次数的优化
分别取均匀试样2.00g与等量硅藻土混匀,置于萃取池内,正己烷为萃取溶剂,在温度110℃,静态萃取时间300s的条件下,分别萃取1、2、3次,计算萃取液中α-VE提取量,实验结果如图7所示,静态循环2次即可达到较好的提取量,继续增加循环次数提取量没有显著增加,所以实验确定最佳萃取次数为2次。

图7 循环次数对α-VE提取量的影响
4 结论
采用快速溶剂萃取技术萃取坚果(生花生,山核桃,杏仁以及葵花籽)中的α-VE,并以杏仁为例对萃取工艺条件进行优化。快速溶剂萃取技术自动化程度高,操作简单方便,通过优化后的方法与传统方法比较萃取所需溶剂少,萃取时间短,对α-VE的提取效率高。实验通过高效液相法对提取的α-VE进行检测,峰形良好,加标回收率为90.1~97.2%之间。本研究使用的快速溶剂萃取技术快速高效,为提取研究食品中的维生素E提供新的方法。
[1] Evans H M.The Pioneer History of Vitamin E *.Vitamins & Hormones,1962,20(6):379-387.
[2] MarsinSanagi M,See H H.Wan Aini Wan Ibrahim,Ahmedy Abu Naim.Determination of carotene,tocopherols and tocotrienols in residue oil from palm pressed fiber using pressurized liquid extraction-normal phase liquid chromatography.Analytica Chimica Acta,2005,538:71-76.
[3] 刘成梅,冯妹元,刘伟,等.天然维生素E及其抗氧化机理。食品研究与开发,2005,26(6):205-208.
[4] 牟世芬,刘勇建.加速溶剂萃取的原理及应用[J].环境化学,2001,1(3):18-20.
[5] 郑熠斌,黄百芬,任一平.正相高效液相色谱法测定食物中8种维生素E异构体及维生素A[J].色谱,2016,34(7):692-696.
[6] 陈燕舞,吴佳文.高效液相色谱法测定植物油中维生素E的样品前处理方法比较[J].理化检验:化学分册,2016,52(8):928-931.
[7] De l C A,Eljarrat E,Barceló D.Determination of 39 polybrominateddiphenyl ether congeners in sediment samples using fast selective pressurized liquid extraction and purification[J].Journal of Chromatography A,2003,1021(1):165-173.
[8] Berset J D,Ejem M,Holzer R,et al.Comparison of different drying,extraction and detection techniques for the determination of priority polycyclic aromatic hydrocarbons in background contaminated soil samples[J].AnalyticaChimicaActa,1999,383(3):263-275.
[9] Flotron V,Houessou J,Bosio A,et al.Rapid determination of polycyclic aromatic hydrocarbons in sewage sludges using microwave-assisted solvent extraction.Comparison with other extraction methods[J].Journal of Chromatography A,2003,999(1):175-184.
[10] Test Methods for Evaluating Solid Waste,Method 3545.USEPASW-846,Update III,3rd ed.,U.S.GPO,Washington,DC,1995.
[11] 苏琨,石松利,郑东华,等.HPLC测定蒙古扁桃种仁中α-维生素E的含量[J].中国实验方剂学杂志,2013,19(12):70-72.

