不同玉米(Zea mays L.)品种根细胞壁多糖对Pb胁迫的响应
沈奕昕,李元, ,祖艳群, ,湛方栋, ,陈建军, *
1. 云南农业大学资源与环境学院,云南 昆明 650201;2. 云南省农业环境污染控制与生态修复工程实验室,云南 昆明 650201
随着经济的发展,重金属污染愈发严重。据报道,2014年中国土壤重金属超标率为16.1%,而农田土壤点位超标率最高为19.4%(环境保护部等,2014)。中国每年因重金属污染而减产的粮食超过1000×104t,同时有1200×104t左右的粮食受到重金属污染,经济损失超过 200亿元(左建华等,2013)。
阻止和排放作用以及区域化作用是植物应对重金属胁迫的重要途径之一(Taylor,1991;Kochian,1995;Kochian et al.,2004),早有报道指出,植株会将重金属固定在根部而减少地上部分的重金属含量,从而减轻重金属对植物的伤害(Antosiewicz,1992),同时植株会将进入根部的重金属固定在其根部细胞壁中,阻止其进入原生质体从而减轻重金属对植株的伤害(Lux et al.,2011;Vodnik et al.,1999)。细胞壁是累积重金属的重要的亚细胞结构(Konno et al.,2010;Malecka et al.,2008),并且可以容纳大量重金属离子(Kopittke et al.,2008;Kopittke et al.,2007;Krzeslowska et al.,2009;Krzeslowska et al.,2010)。玉米(Zea mays L.)根细胞壁中Zn可达总量的42.8%,而Cu的占比甚至可以达到64.3%(周建民等,2005),而玉米根细胞壁中的Pb占比也可达到52.4%(秦丽,2017),可见植物根细胞壁在固定重金属的过程中的重要性。
另外,植物体内的重金属存在形式和活性高低也在一定程度上决定了重金属毒性的大小,反映了植物对重金属的抗性。研究表明,同种植物不同品种植株体内的重金属化学提取态占比也有所不同,Cd的低累积品种水稻(Oryza sativa L.)中的水提取态和乙醇提取态等高活性Cd含量占比低于高累积品种,而低累积品种水稻中低活性的 NaCl提取态 Cd含量高于高累积品种(于辉等,2008)。此外,包括玉米在内的各种作物重金属低累积品种筛选工作早已开展,但对内在机理的研究相对较少。本研究以玉米的籽粒Pb低累积品种和籽粒Pb高累积品种,通过水培试验,研究在 Pb胁迫下,两个品种玉米根部 Pb化学形态和亚细胞分布的差异,及其根细胞壁 Pb累积与多糖响应的差异,为将来玉米 Pb的低累积品种的培育与筛选工作提供理论基础。
1 材料与方法
1.1 植物材料
供试材料为玉米“会单4号”和“路单8号”。本课题组前期研究发现,在受Pb污染地块(Pb全量为902 mg·kg-1)的田间试验中,两个玉米品种表现出不同的Pb累积性,“路单8号”的籽粒Pb的质量分数可达 1.89 mg·kg-1,“会单 4号”的籽粒Pb质量分数为0.501 mg·kg-1(表1)。
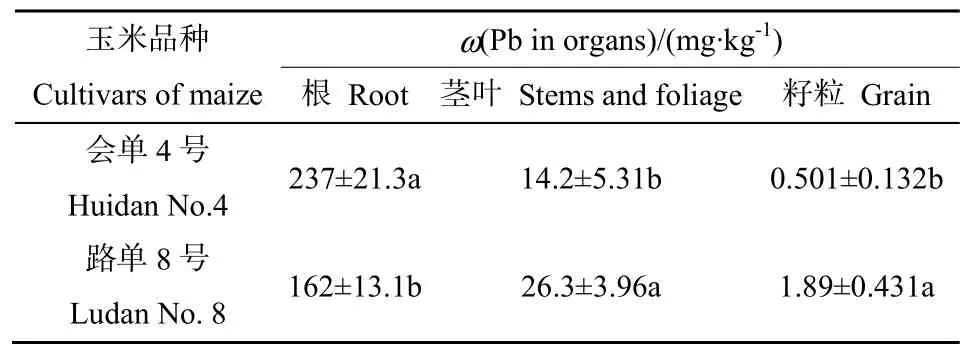
表1 2个品种玉米中的铅含量Table 1 Pb concentration in 2 cultivars of maize
1.2 试验设计
1.2.1 植物材料的培养和准备
玉米的培养及 Pb胁迫试验:取经消毒处理、颗粒饱满均匀的玉米种子,于培养箱中 28 ℃条件下催芽。挑选生长强壮的玉米苗转移到营养液中培养 7 d,再选取长势较好并相似的玉米植株,分别移入营养液中,用同一型号的水桶培养,于3月置于大棚中培养(25°14′N,102°75′E),共分 3 组,分别为无铅(对照组)、100 mg·L-1Pb胁迫组、300 mg·L-1Pb胁迫组,每组共设置9个平行。营养液每隔1周更换1次,胁迫14 d后,取出后先用去离子水将植株根冲洗干净,然后以 25 mL10 mmol·L-1EDTA溶液浸泡5 min,以去除根表吸附的Pb,然后再用去离子水将根冲洗干净备用。营养液:945 mg·L-1Ca(NO3)2·4H2O,506 mg·L-1KNO3,80 mg·L-1NH4NO3,1.36 mg·L-1KH2PO4,390 mg·L-1MgCl2,13.9 mg·L-1FeSO4·7H2O,18.7 mg·L-1Na2EDTA,8.3 μg·L-1KI,62 μg·L-1H3BO3,223 μg·L-1MnSO4,86 μg·L-1ZnSO4,2.5 μg·L-1Na2MoO4,0.25 μg·L-1CuSO4,0.25 μg·L-1CoCl2。
1.2.2 根组织内Pb化学结合形态的提取分离
采用化学试剂逐步提取法(刘婷婷,2014)。5种提取剂(体积分数为 80%的乙醇,去离子水,1 mol·L-1NaCl溶液,体积分数为2%的醋酸,0.6 mol·L-1盐酸)分别提取无机类、氨基酸类等可溶性铅,水溶性有机酸铅类,与蛋白质结合或吸着态的铅及果胶酸铅等,以及难溶于水的磷酸类铅、草酸铅。
1.2.3 亚细胞结构的分离
采用分级离心法(Lozano-Rodriguez et al.,1997)分离亚细胞结构。 准确称取鲜根0.500 g加入预冷的 20 mL 提取液(0.25 mmol·L-1蔗糖+50 mmol·L-1Tris-HC1 缓冲液(pH7.5)+10 mmol·L-1的二硫赤藓糖醇),研磨匀浆,通过孔径100 μm的尼龙网筛,残渣即为细胞壁组分(F1);上清液在12000 r·min-1下离心 30 min,沉淀即为细胞器(F2),上清液为包括质体和液泡在内的胞液(F3);全部操作在4 ℃条件下进行。
1.2.4 玉米根细胞壁的提取
采用粉碎细胞,抽提细胞内物质的方法(武贝,2009)取新鲜根系加入液氮在研钵中研磨至粉末,转移到50 mL离心管中,加入体积分数为75%的冰乙醇浸没混匀,冰浴20 min后以12000 r·min-1离心10 min,去上清液后加入冰丙酮提取,冰浴20 min后再离心20 min,去上清液后加入1∶1的甲醇-∶氯仿提取,冰浴20 min后离心20 min,去除上清液,最后加入甲醇提取,冰浴20 min后离心20 min,去上清液后冷冻干燥。干燥完全后的固体残余便是粗提细胞壁。提取完成后,干燥的细胞壁放入4 ℃冰箱中密封保存。以上操作试剂用量均为每克根鲜质量加10 mL溶液。
1.2.5 玉米根细胞壁多糖组分的分离
参考Zhong et al.(1993)的方法进行细胞壁多糖组分分离:称取0.100 g细胞壁样品,在95 ℃下,加15 mL 0.5%草酸铵,提取3次,每次15 min,上清液即为果胶物质。提取果胶后的沉淀分别用4%KOH和24%KOH(含0.02% NaBH4)提取,共提取3次,每次12 h,10000 r·min-1离心15 min,4%和24%KOH提取物分别为半纤维素1类和半纤维素2类。半纤维素1类和半纤维素2类在冰浴条件下用冰乙酸中和,碱性不溶物质即为纤维素类。
1.3 样品指标的测定
Pb含量的测定:均采用 HNO3-HClO4法消解-石墨炉/火焰原子吸收分光光度法测定亚细胞组分、化学提取态组分、细胞壁各多糖组分中 Pb含量。细胞壁各多糖的总糖含量测定:以葡萄糖为标准采用苯酚硫酸比色法测定。
1.4 数据分析
采用Excel做表、SPSS数据分析、Origin 9.1作图。
2 结果与分析
2.1 Pb在玉米根中的亚细胞分布
表2显示,在Pb胁迫下,“会单4号”根部细胞壁中Pb占比为51.5%~55.8%,细胞器中的Pb占比为 26.1%~42.6%,可溶态 Pb占比为5.86%%~18.1%;在Pb胁迫下,“路单8号”根部细胞壁中Pb占比为48.9%~52.2%,细胞器中的Pb占比为 38.1%~45.3%,可溶态 Pb占比为5.80%%~9.64%。由此可见,玉米植株根细胞壁对Pb有较强的累积能力,通过细胞壁对Pb的沉淀作用,减轻 Pb对玉米植株的毒害,这是玉米植株增强自身对Pb抗性的重要手段之一。与低浓度Pb胁迫相比,高浓度Pb胁迫下“会单4号”和“路单8号”的细胞壁、可溶态 Pb占比升高,而细胞器中Pb的占比降低。在同浓度Pb胁迫下,“会单4号”根中细胞壁及可溶态 Pb质量分数均显著高于“路单8号”。这表明,作为低累积品种的“会单4号”,其根细胞壁吸附累积Pb的能力强于高累积品种“路单8号”。
2.2 玉米根细胞中Pb的化学形态
由图1可知,无论是在低浓度Pb还是高浓度Pb胁迫下,“会单 4号”根中,Pb主要以 NaCl提取态和 HAc提取态存在,分别达到32.3%~34.8%、43.7%~56.0%;其后依次为 HCl提取态、去离子水提取态、残渣态和乙醇提取态,其中活性较强的去离子水提取态和乙醇提取态只占据 2.73%~5.04%。而“路单 8号”根中,Pb也以NaCl提取态和 HAc提取态为主,分别达到47.1%~48.1%、44.0%~48.6%;其后依次为去离子水提取态、HCl提取态、残渣态和乙醇提取态,其中活性较强的去离子水提取态和乙醇提取态只占据了2.97%~4.39%。由此可见,Pb被植株吸收后,玉米会通过蛋白质、果胶酸、磷酸、草酸等与 Pb相结合,将高活性 Pb转化为较低活性的形态,由此来降低Pb的毒害,增强自身对Pb的抗性,这在两个品种玉米上都有体现。
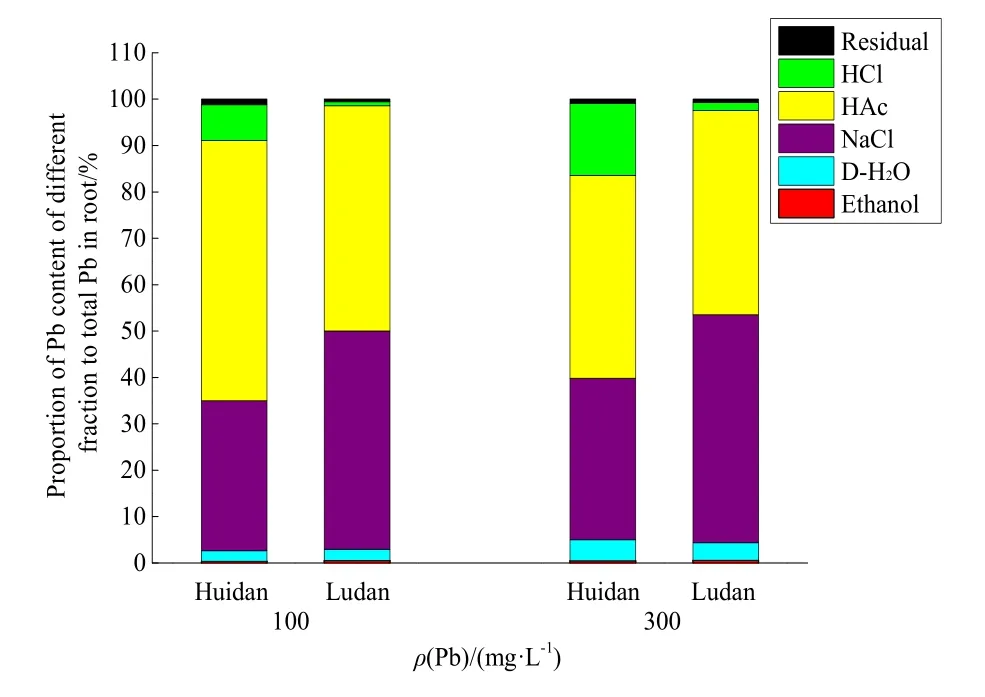
图1 铅胁迫下,玉米根部各个化学形态铅的占比Fig. 1 Proportion of different chemical fractions of Pb in the roots of mazie under Pb stress
2.3 玉米根细胞壁各多糖组分总糖的质量分数
由图2可知,随着Pb胁迫浓度的升高,“会单4号”和“路单8号”根细胞壁果胶总糖含量明显上升,半纤维素2总糖含量变化不显著;相比对照组,在低浓度Pb处理下,“会单4号”的半纤维素1总糖无显著变化,“路单8号”出现显著降低,在高浓度Pb处理下,“会单4号”和“路单8号”的半纤维素总糖含量都出现显著降低。同一处理下“会单4号”的果胶总糖含量显著高于“路单8号”,“路单8号”的半纤维素1和半纤维素2总糖含量略高于“会单4号”。其中,相较于对照组,低浓度Pb胁迫下“会单4号”和“路单8号”的果胶总糖含量分别上升了23.5%、27.5%;高浓度Pb胁迫下,两者分别上升了71.0%、67.0%。这表明,玉米植株根部对 Pb胁迫作出了响应,而根细胞壁果胶含量的升高是应对Pb胁迫的手段之一。
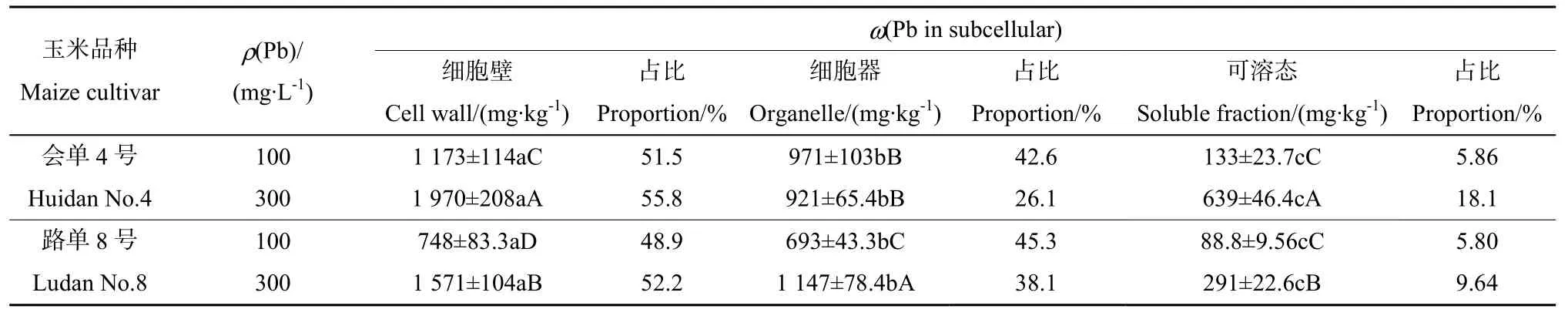
表2 铅胁迫下,铅在玉米根细胞的亚细胞组分中的分布Table 2 Subcellular distribution of Pb in the roots of maizes under Pb stress
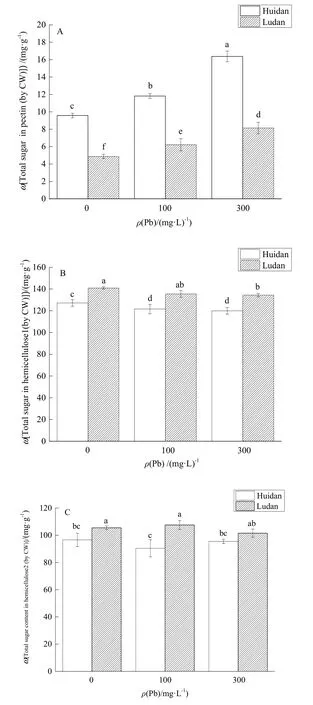
图2 玉米根细胞壁各多糖组分总糖的质量分数Fig. 2 Total sugar concentration of polysaccharide compositions in cell wall of maize roots
2.4 玉米根细胞壁各多糖组分中Pb的质量分数
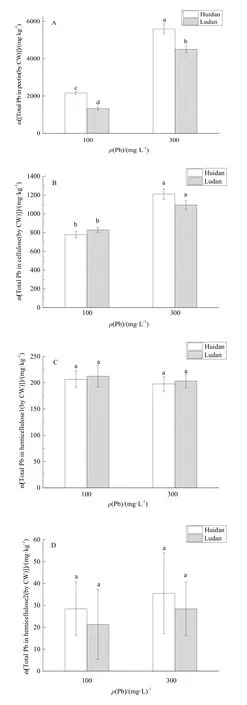
图3 铅胁迫下,玉米根细胞壁各多糖组分中铅含量Fig. 3 Total Pb concentration of polysaccharide compositions in root cell wall of maize under Pb stress
对照组(无Pb环境)玉米未检出Pb,故未在图3中展现相关数据。图3显示,无论是在高浓度Pb胁迫还是低浓度Pb胁迫下,两个品种玉米根细胞壁多糖组分均以果胶中的 Pb含量最高,其次是纤维素。低浓度Pb胁迫下,“会单4号”和“路单8号”果胶中Pb含量分别占总量的68.1%、55.6%,纤维素中Pb含量分别占24.5%、34.6%;高浓度Pb胁迫下,两者果胶中Pb含量分别占79.5%、77.3%,纤维素中Pb含量分别占17.2%、18.9%。无论是“会单4号”还是“路单8号”,在高浓度Pb胁迫下,果胶和纤维素中的Pb含量都显著高于低浓度Pb胁迫下的,而半纤维素中 Pb含量差异不显著。结果表明,玉米根细胞壁的果胶、半纤维素 1、半纤维素2、纤维素在细胞壁吸附累积Pb的过程中都有一定的贡献,以果胶的贡献最大。而在相同浓度 Pb胁迫下,“会单4号”的果胶中的Pb含量显著高于“路单8号”,而其他3个组分Pb含量量差异不显著。综上,低累积玉米“会单4号”和高累积玉米“路单8号”的根细胞壁吸附Pb的能力差异主要体现在果胶上。
3 讨论
细胞壁是铅进入植物细胞的第一道屏障,也是累积重金属离子的重要亚细胞结构(Wójcik et al.,2005;Islam et al.,2007)。玉米根细胞壁可以吸附31.1%~40.5%总Cu(司江英等,2008),本试验结果与之类似,从表2可知,在Pb胁迫下,玉米根细胞壁吸附的 Pb的量可以达到总量的48.9%~55.8%。一般而言,进入植物根细胞的重金属,一部分会被植株固定在根部而滞留,另一部分会通过共生质体途径进入导管组织中,随着蒸腾作用被运送到植株的地上部分,然后分布于植株的茎、叶、果实、种子中,而根细胞壁对重金属的沉淀作用一方面可以降低部分进入植物体内重金属的活性(杨锦忠,2000),另一方面可以减少其进入原生质体以及向地上部分转移的量,从而减轻重金属的毒害作用(Jiang et al.,2008;Lux et al.,2011)。因此,玉米根细胞壁在玉米植株应对 Pb胁迫时扮演了重要角色。另外,“会单4号”根部细胞壁对Pb的吸附能力强于“路单8号”,因此,“会单4号”的这道保护原生质体的屏障(细胞壁)的阻滞能力更强。相比“路单8号”,根细胞壁对Pb更强的阻滞能力一定程度上能降低“会单4号”根部向地上部分运送的Pb的量,使其籽粒中的Pb含量维持在较低的水平,
研究认为,不同种类的植物以及同种植物不同品种其体内的重金属化学提取态占比有所不同(于辉等,2008;徐劼等,2011)。程海宽等(2015)研究发现,不同玉米品种体内Pb的化学形态占比不同,但均以盐酸提取态和醋酸提取态为主,其中品种“圣瑞568”根部乙醇提取态和去离子水提取态的 Pb只占 8.1%~10.9%。本研究也有类似的结果,图 1显示,两个品种玉米根部Pb均以NaCl提取态和HAc为主,去离子水提取态和乙醇提取态Pb含量只占据总量的2.73%~5.04%。低活性态Pb主要以难溶性的蛋白结合态、果胶酸盐、磷酸盐结合态和草酸盐等形式存在,其迁移能力和毒性都比乙醇和水提取态 Pb弱得多(陆仲烟等,2013;杨素勤等,2015)。由此表明,在Pb胁迫下,“会单4号”和“路单8号”均可控制其体内的Pb,使其从毒性较大、活性较高的可溶态Pb向低毒、低活性的形态转化,以此增加自身对Pb的抗性。另外,两个品种的玉米根部中NaCl提取态的Pb含量较高,由此表明,“会单4号”和“路单8号”根部有大量的Pb与蛋白和果胶酸结合,果胶极可能在玉米根部固定Pb的过程中起了重要作用。
植物初生细胞壁中多糖占比可达90%(Gibeaut et al.,1993),细胞壁多糖组分主要为纤维素、半纤维以及果胶。有研究发现,植物会通过增加细胞壁中多糖含量的方式来应对重金属的胁迫(陈佳,2008;Hossain et al.,2005;Andrade et al.,2010;刘家友等,2009)。图2与图3显示,在Pb胁迫下,玉米根细胞壁中果胶含量都显著升高,而果胶中的Pb含量也随之升高,但半纤维素1和半纤维素2的总糖有略微下降,并且半纤维素1和2中的Pb含量也未出现明显升高。这表明根细胞壁果胶含量的上升是玉米植株应对 Pb胁迫的策略之一。果胶富含负电基团,这些基团能结合包括Pb2+在内的多种重金属离子(Davis et al.,2003;Kartel et al.,1999),根细胞壁果胶含量的升高可以增加细胞壁上Pb的结合位点,增强细胞壁对Pb的沉积作用,减弱Pb的毒性,增强玉米对Pb的抗性。这与Yang et al.(2008)发现水稻吸附 Al的能力与果胶水平相关的结果是类似的。另有研究也有类似的结果,茶树(Camellia sinensis L.)根细胞壁中果胶可以吸附 34%的 Pb(王梦,2014),在 Al浓度低于 32 μmol·L-1时,果胶酸盐可吸附溶液中 70%~84%的Al(Matsumoto,2000),可见果胶在根细胞壁吸附固定 Pb过程中具有重要作用。在玉米品种间差异方面,从图2和图3可知,在同一处理下,“会单4号”的果胶总糖含量明显高于“路单8号”,而在同一浓度Pb胁迫下,“会单4号”的果胶中Pb含量显著高于“路单8号”,其他多糖的Pb含量并未出现明显的品种差异,不难发现“会单4号”与“路单8号”根细胞壁吸附Pb的量的差异主要体现在果胶上,玉米根细胞壁结合 Pb的能力可能与果胶水平相关。
总之,果胶作为玉米根细胞壁重要组分之一,在玉米植株降低Pb活性——细胞壁对Pb的沉淀作用中扮演了重要的角色,而 Pb的高低累积玉米品种间,细胞壁吸附累积 Pb的能力差异也主要体现在果胶上,至于果胶为何能发挥如此重要的作用,需要进一步的实验和探讨。
4 结论
玉米通过增加根细胞壁果胶的方式来应对Pb的胁迫。Pb的低累积品种“会单4号”根细胞壁吸附累积Pb的能力强于高累积品种“路单8号”,而这种差异主要体现在果胶对Pb的吸附量上。另外,玉米细胞壁结合Pb的能力很可能与果胶水平相关。
ANTOSIEWICZ D M.1992. Adaptation of plants to an environment polluted with heavy metal [J]. Acta Societatis Botanicorum Poloniae,61(2): 281-299.
ANDRADE L R, LEAL R N, NOSEDA M, et al. 2010. Brown algae overproduce cell wall polysaccharides as a protection mechanism against the heavy metal toxicity [J]. Marine pollution bulletin, 60(9):1482-1488.
DAVIS T A, VOLESKY B, MUCCI A. 2003. A review of the biochemistry of heavy metal biosorption by brown algae [J]. Water Research,37(18): 4311-4330.
GIBEAUT D M, CARPITA N C. 1993. Glucan synthesis in membranes from Zea mays and Glycine max: interaction of ER and Golgi membranes [J]. Plant Physiology, 102(1): 51-51.
HOSSAIN Z, KOYAMA H, HARA T. 2005. Sugar compositions and molecular mass distributions of hemicellulosic polysaccharides in wheat plant under aluminium stress at higher level of calcium supply[J]. Asian Journal of Plant Science, 4(1): 11-16.
ISLAM E, YANG X E, LI T Q, et al. 2007. Effect of Pb toxicity on root morphology, physiology and ultrastructure in two ecotypes of Elsholtzia argyi [J]. Journal of Hazardous Materials, 147(3): 806-816.
JIANG X Y, WANG C H. 2008. Zinc distribution and zinc-binding forms in Phragmites australis under zinc pollution [J]. Journal of Plant Physiology, 165(7): 697-704.
KARTEL M T, KUPCHIK L A, VEISOV B K. 1999. Evaluation of pectin binding of heavy metal ions in aqueous solution [J]. Chemosphere,38(11): 2591-2596.
KOCHIAN L V. 1995. Cellular mechanisms of aluminum toxicity and resistance in plants [J]. Annual review of plant physiology and plant molecular biology (USA), 46: 237-260.
KOCHIAN L V, HOEKENGA A O, PINEROS M A. 2004. How do crop plants tolerate acid soils? Mechanisms of aluminum tolerance and phosphorous efficiency [J]. Annual Reveiw of Plant Biology, 55:459-494.
KONNO H, NAKASHIMA S, KATOH K. 2010. Metal-tolerant moss Scopelophila cataractae accumulates copper in cell wall pectin of the protonema [J]. Journal of Plant Physiology, 167(5): 358-364.
KOPITTKE P M, ASHER C J, BLAMEY F P C, et al. 2008. Localization and chemical speciation of Pb in roots of signal grass (Brachiaria decumbens) and Rhodes grass (Chloris gayana) [J]. Environmental Science andTechnology, 42(12): 4595-4599.
KOPITTKE P M, ASHER C J, KOPITTKE R A, et al. 2007. Toxic effects of Pb2+on growth of cowpea (Vigna unguiculata) [J]. Environmental Pollution, 150(2): 280-287.
KRZESLOWSKA M, LENARTOWSKA M, SAMARDAKIEWICZ S, et al. 2010. Lead deposited in the cell wall of Funaria hygrometrica protonemata is not stable-A remobilization can occur [J].Environmental Pollution, 158(1): 325-338.
KRZESLOWSKA M, LENARTOWSKA M, MELLEROWICZ E J, et al.2009. Pectinous cell wall thickenings formation-A response of moss protonemata cells to lead [J]. Environmental and Experimental Botany,65(1): 119-131.
LOZANO-RODRIGUEZ E, HEMANDEZ L E, BONAY P. et al. 1997.Distribution of cadmium in shoot and root tissues of maize and pea plant [J]. Physiological disturbances.Journal of Experimental Botany,48(1): 123-128.
LUX A, MARTINKA M, VACULÍK M, et al. 2011. Root responsesto cadmium in the rhizosphere: A review [J]. Journal of Experimental Botany, 62(1): 21-37.
MALECKA A, PIECHALAK A, MORKUNAS I, et al. 2008.Accumulation of lead in root cells of Pisum sativum [J]. Acta Physiologiae Plantarum, 30(5): 629-637.
MATSUMOTO H. 2000. Cell biology of aluminum toxicity and tolerance in higher plants [J]. International Review of Cytology, 200: 1-46.
TAYLOR G J. 1991. Current views of the aluminum stress response: the physiological basis of tolerance [C]//Randall D D, Blevins D G, Miles C D. Current Topics in Plant Biochemistry and Physiology, Vol 10.University of Missouri, Columbia (USA): 57-93.
VODNIK D, GABERSCIK A, GOGALA N. 1999. Lead phytotoxcity in Norway spruce (picea abies L.Karst): The effect of Pb and zeatin-riboside on root respiratory potential [J]. Phyton-Annales Rei Botanicae, 39(3): 155-159.
WÓJCIK M, VANGRONSVELD J, D HAEN J, et al. 2005. Cadmium tolerance in Thlaspi caerulescens-Ⅱ. Localization of cadmium in Thlaspi caerulescens [J]. Environmental and Experimental Botany,53(2): 163-171.
YANG J L, LI Y Y, ZHANG Y J, et al. 2008. Cell wall polysaccharides are specifically Involved in the exclusion of aluminum from the rice root(Oryza sativa) apex [J]. Plant Physiology, 146(2): 602-611.
ZHONG H, LAUCHLI A. 1993. Changes of cell wall composition and polymer size in primary roots of cotton seedlings under high salinity[J]. Journal of Experimental Botany, 44(4): 773-778.
陈佳. 2008. 硼、铝对豌豆根边缘 细胞及根细胞壁果胶多糖特性的影响[D]. 成都: 四川农业大学.
程海宽, 张彪, 景鑫鑫, 等. 2015. 玉米对铅胁迫的响应及体内铅化学形态研究[J]. 环境科学, 36(4): 1468-1473.
刘家友, 喻敏, 刘丽屏, 等. 2009. 铝胁迫下豌豆根边缘细胞和根细胞壁多糖组分含量的变化[J]. 中国农业科学,42(6): 1963-1971.
刘婷婷. 2014. 细胞壁在海州香薷铜耐性中的作用及解毒机理研究[D].杭州: 浙江大学.
环境保护部, 国土资源部. 2014. 全国土壤污染状况调查公报 (2014年4月17日)[J]. 环境教育, 20(6): 8-10.
秦丽. 2017. 间作系统中续断菊与作物Cd、Pb累积特征和根系分泌低分子有机酸机理[D]. 昆明: 云南农业大学.
王梦. 2014. 铅胁迫下茶树根细胞壁多糖的响应机制初探[D]. 杭州: 浙江大学.
武贝. 2009. 海州香薷Cu耐性与积累机制研究[D]. 杭州: 浙江大学.
徐劼, 于明革, 陈英旭, 等. 2011. 铅在茶树体内的分布及化学形态特征[J]. 应用生态学报, 22(4): 891-896.
陆仲烟, 刘仲齐, 宋正国, 等. 2013. 大麦中镉的亚细胞分布和化学形态及PCs合成的基因型差异[J]. 农业环境科学学报, 32(11): 2125-2131.
司江英, 赵海涛, 汪晓丽, 等. 2008. 不同铜水平下玉米细胞内铜的分布和化学形态的研究[J]. 农业环境科学学报, 27(2): 452-456.
杨锦忠. 2000. 玉米的重金属胁迫及其抗性[J]. 玉米科学, 8(3): 62-66.
杨素勤, 程海宽, 景鑫鑫, 等. 2015. 不同铅吸收特性小麦 Pb的亚细胞分布和化学提取态[J]. 中国农业科学, 48(14): 2848-2856.
于辉, 杨中艺, 杨知建, 等. 2008. 不同类型镉积累水稻细胞镉化学形态及亚细胞和分子分布[J]. 应用生态学报, 19(10): 2221-2226.
周建民, 党志, 陶雪琴, 等. 2005. NTA对玉米体内Cu、Zn的积累及亚细胞分布的影响[J]. 环境科学, 26(6): 128-132.
左建华, 张敏纯. 2013. 重金属污染致害的私法应对[J]. 环境保护,41(6): 45-47.

