叶酸受体介导的用于肿瘤显像的放射性分子探针的研究进展
庞 燕,王海军,冯维贵,王玉斌
(甘肃省人民医院,甘肃 兰州 730000)
叶酸受体是一种糖基化磷脂酰肌醇连接的膜糖蛋白,分子量为38~40 kD,包括α、β和γ/γ′3种亚型。叶酸受体基因表达有很强的组织和肿瘤特异性,在正常组织中低表达,而在一些肿瘤组织中高表达,α亚型在正常组织中低表达,在上皮细胞系肿瘤,例如卵巢癌、肾癌、睾丸癌、脑癌、结肠癌中高表达;β亚型仅在胎盘、粒单核细胞系中成熟的中性粒细胞、被激活的单核或巨噬及超过半数以上的髓系白血病细胞中高表达,在其他组织中几乎不表达;γ/γ′亚型被认为是特异性表达在造血组织中,但也只是低表达[1,2]。
1 叶酸受体肿瘤显像剂的研究进展
目前已报道的用于标记叶酸受体放射性药物的核素有66/67/68Ga,111In,99mTc及18F 等。
1.1 66/67/68Ga标记的显像剂
1.1.1 66/67/68Ga-DF-folate C J Mathias等报道,67Ga和66/68Ga与DF-folate(DF,去铁胺)偶联后可以作为叶酸受体肿瘤显像剂进行显像,DF-folate结构如图1所示。67Ga-DF-folate在荷KB细胞(人体口腔上皮癌细胞)肿瘤小鼠体内,肿瘤中摄取较高[(5.2±1.5)%ID/g,4 h p.i],瘤/血比和瘤/肉比分别为409±195和124±47。同时,文献报道66Ga和68Ga亦可以用来标记DF-folate,其中 66Ga-DF-folate在荷KB细胞肿瘤小鼠的MicroPET显像中,肿瘤和肾脏的显像清晰,具有很高的灵敏性[3,4]。

图1 DF-folate的结构
1.1.2 67Ga-DOTA-Bz-EDA-folate 2011年,Cristina Muller等标记得到67Ga-DOTA-Bz-EDA-folate(结构如图2所示)。体外细胞结合实验中,此标记物对叶酸受体表现出较强的亲和力。在荷KB细胞肿瘤小鼠模型中,67Ga-DOTA-Bz-EDA-folate在肿瘤中摄取较高[(6.08±0.89)%ID/g,4 h p.i],并且滞留时间较长[(5.54±0.36)%ID/g,24 h p.i]。除了唾液腺和肾脏中特异性摄取较高外,非靶器官摄取很低,4 h瘤/血比为56.28±9.04。由于肾脏特异性摄取较高,会影响显像效果并对肾脏产生毒副作用,笔者提前注射培美曲塞,达到了降低肾脏摄取的目的,4 h瘤/血比由84.53±14.10降到19.09±1.63,同时肿瘤中摄取变化不大,由(6.08±0.89)%ID/g变为(6.15±0.77)%ID/g。荷瘤小鼠SPECT显像结果与生物分布结果一致,标记物能清晰显示肿瘤位置,提前注射培美曲塞后肿瘤显像依然清晰,但是肾脏摄取量大大降低[5]。

图2 DOTA-Bz-EDA-folate的结构
1.2 111In标记的显像剂
1.2.1111In-DTPA-folate111In-DTPA-folate是第一个进入并完成Ⅱ期临床试验的叶酸受体肿瘤显像剂。DTPA-folate结构如图3所示。2003年,Siegel BA等对111In-DTPA-folate作为诊断卵巢癌的一种显像剂就其安全性、生物分布和可能性进行研究。结果发现,33例卵巢癌患者中,111In-DTPA-folate对恶性卵巢实体瘤诊断的灵敏度达100%。这种显像剂能很好地区分良、恶性肿瘤,但在诊断再发性卵巢癌和子宫内膜恶性实体瘤时,效果不太理想。111In为利用加速器生产的放射性核素,且半衰期较长(T1/2=67.3 h),这使得在对其进行商业推广时遇到了很大障碍[6]。
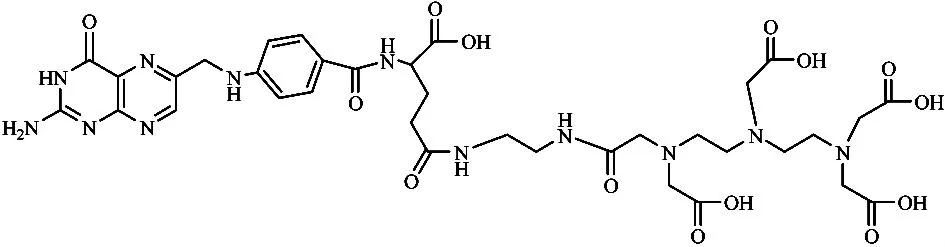
图3 DTPA-folate的结构
1.2.2111In-DTPA-NOON-Pteroyl 2005 年,Chun Yen Ke等利用氨基乙醚链取代叶酸分子中的谷氨酸残基形成的蝶酸NOON桥与111In-DTPA相连得到111In-DTPA-NOON-Pteroyl。Pteroyl-NOON-DTPA结构如图4所示。111In-DTPA-NOONPteroyl在荷KB细胞肿瘤小鼠体内生物分布情况与111In-DTPA-folate相似,证明去掉叶酸分子中的谷氨酸部分并不会影响叶酸受体的亲和性[7]。

图4 Pteroyl-NOON-DTPA的结构
1.3 99mTc标记的显像剂
1.3.199mTc-DTPA-folate Carla J Mathias等制备得到99mTc-DTPA-folate。在荷KB细胞肿瘤小鼠模型中,99mTc-DTPA-folate除了在血液中浓度较高外,其他生物分布与111In-DTPA-folate相仿。但是,由于标记物的放射化学纯度以及稳定性与配体DTPA-folate用量有关,当配体量与111In-DTPA-folate中配体量相当时,其放射化学纯度和稳定性不太理想[8]。
1.3.299mTc-EC20 EC20是含有叶酸结构类似物的肽(如图5所示)。在BALB/c小鼠模型(接种M109肿瘤)中,99mTc-EC20在肿瘤中摄取很高[(17.2±1.02)%ID/g,4 h p.i],在血液等非靶组织中的清除速度很快,并以原药形式从尿液中排出。其肿瘤摄取以及瘤/血本底比值可以与111In-DTPA-folate相比。目前,99mTc-EC20已用于卵巢癌、宫颈癌和肾癌等的Ⅰ期临床试验,Ⅱ期临床试验也正在进行[9,10]。

图5 99mTc-EC20的结构
1.3.399mTc-HYNIC-folate双功能连接剂HYNIC(肼基烟酰胺)与叶酸分子偶联形成HYNIC-folate(如图6所示)。在共配体tricine/TPPTS的作用下,用99mTc进行标记可得到配合物99mTc-HYNIC-folate。在荷叶酸受体阳性肿瘤24 JK-FBP的小鼠模型中,药物在肿瘤中摄取很高[(17.84±11.43)%ID/g,4 h p.i],4 h时瘤/血比和瘤/肉比分别为 55±19.2和 28.2±14.8,比111In-DTPA folate和67Ga-DF-folate在KB细胞肿瘤小鼠模型中的瘤/血本底比值低,主要因为24JK-FBP中叶酸受体密度较小所致。但是由于其叶酸受体含量和人体肿瘤中叶酸受体含量近似,所以这种肿瘤模型对研究人体肿瘤更有意义[11]。
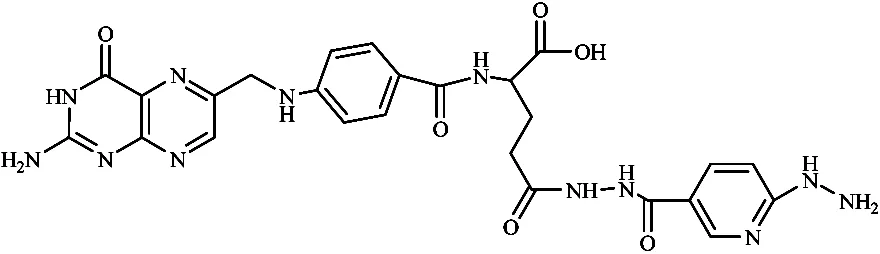
图6 99mTc-HYNIC-folate的结构
1.3.499mTc-(CO)3-DTPA-folate中间体[99mTc(CO)3(H2O)3]+与DTPA-folate反应可生成99mTc(CO)3-DTPA-folate。在荷KB细胞肿瘤小鼠模型中,肿瘤摄取较高4 h时为(3.3±0.2)%ID/g,靶与非靶比值低于111In-DTPA-folate和99mTc-DTPA-folate,与其他叶酸的螯合物相比,没有发现明显的优越性。但是,为99mTc标记叶酸提供了新的思路[12]。
1.3.599mTc-histidine-folate Cristina Muller等利用链接化学(Click Chemi stry)的方法合成了99mTc-histidine-folate(如图7所示)。在荷KB细胞肿瘤小鼠模型中发现,标记物在肿瘤中摄取较高[(4.29±0.67)%ID/g,4 h p.i],且滞留时间较长[(3.51±0.37)%ID/g,24 h p.i],除肾脏外非靶器官摄取很低。4 h荷瘤小鼠SPECT显像,取得较好的显像结果[13]。

图7 99mTc-histidine-folate的结构
1.3.699mTc(X)(tricine/TPPTS) 陆洁等对叶酸分子进行结构修饰后与双功能连接剂HYNIC相连,在tricine/TPPTS存在情况下,进行99mTc标记,得到一系列配合物,如99mTc(HYNIC-NHHNFA)(tricine/TPPTS)和99mTc(HYNIC-lys-pteroyl)(tricine/TPPTS)。HYNIC-NHHN-FA与HYNIC-lys-pteroyl结构如图8、9所示。体外细胞结合实验显示,两种配合物与叶酸受体有较好的亲和力。在荷KB细胞肿瘤小鼠模型中,两种配合物在肿瘤中摄取很高,99mTc(HYNIC-NHHN-FA)(tricine/TPPTS)注射后 4 h 最高为 (9.79±1.6)%ID/g,99mTc-(HYNIC-lys-pteroyl)(tricine/TPPT S),2 h最高为(9.60±1.46)%ID/g。两者除了肾脏特异性摄取较高外,腹部其他脏器摄取很低并且清除很快,有很高的靶与非靶比值。99mTc(HYNIC-lys-pteroy)l(tricine/TPPTS) 在荷瘤小鼠SPECT显像中,能够清晰显示肿瘤位置[14,15]。

图8 HYNIC-NHHN-FA的结构

图9 HYNIC-lys-pteroyl的结构
1.4 18F标记的显像剂
1.4.118F-FBA-folate 2006年,Andrea Bettio等标记得到18F-FBA-folate(α)和18F-FBA-folate(γ),结构如图 10、11 所示。两种化合物的IC50(半抑制率)分别为(71±8)nmol/L和(62±6)nmol/L,与叶酸(IC50为41 nmol/L)相比,两种标记物对叶酸受体的亲和力相近。在荷KB细胞肿瘤小鼠模型中,注射后125 min18F-α/γ-FBA-folate 在肿瘤中的摄取为(6.56±1.80)%ID/g,肾脏、胆汁、尿液和粪便中有很高的摄取,肾脏为(40.65±12.81)%ID/g,胆汁为(265.80±164.13)%ID/g,尿液为(130.71±92.52)%ID/g,粪便为(29.54±19.98)%ID/g。在荷瘤小鼠 PET 显像中,肿瘤显像清晰,但是由于腹部摄取过高影响进一步推广[16]。
1.4.218F-click-folate 2008年,Tobias L Ross等将Click化学合成方法应用于18F标记过程,得到18F-click-folate,结构如图12所示。整个标记过程大约需要90 min,放化产率最高可达35%。体外细胞结合实验测得标记物Ki(抑制常数)为(9.76±3.13)nM,高于叶酸的(0.61±0.19)nM。在荷KB细胞肿瘤小鼠模型中,肿瘤摄取较低[(3.13±0.83)%ID/g,45 min p.i],主要是由于此标记物脂溶性很强,主要通过肝胆代谢,胆汁、粪便和尿液摄取很高,45 min 时分别为 (667.36±530.09)%ID/g,(56.00±27.64)%ID/g和(49.92±15.58)%ID/g。与18F-FBA-folate的相同点是,在荷瘤小鼠体内PET显像中,此偶联物可以在叶酸受体高表达的肿瘤部分显示出特异性摄取,但是同样由于腹部摄取过高影响显像效果[17]。
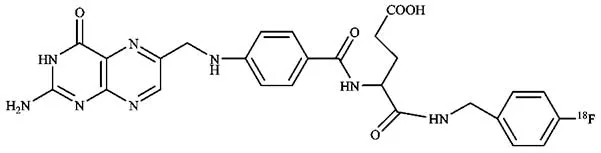
图10 18F-FBA-folate(α)的结构

图11 18F-FBA-folate(γ)的结构

图12 18F-click-folate的结构
1.4.318F-FFA 继18F-FBA-folate和18F-click-folate后,Tobias L Ross团队又将18F标记到叶酸分子上,得到18F-FFA(如图13所示),整个标记过程大约需要80 min,衰变矫正后最高产率为4%。体外结合实验测得该标记物Ki为(1.8±0.1)nM,与叶酸分子的Ki[(0.6±0.2)nM]接近。在荷KB细胞肿瘤小鼠模型中,肿瘤摄取较高[(9.37±1.76)%ID/g,75 min p.i]。由于亲水性增强,18F-FFA较18F-FBA-folate和18F-click-folate在胆汁、小肠、粪便等腹部非靶器官中的摄取大大降低,主要通过肾脏(尿)代谢。在PET显像中,18F-FFA能清楚显示肿瘤和肾脏的位置。为了降低肾脏摄取,笔者提前注射培美曲塞,75 min后从(35.73±0.25)%ID/g 降至(14.05±1.02)%ID/g,同时肿瘤的摄取变化不大,由(11.50±0.28)%ID/g降至(8.65±3.05)%ID/g[18]。
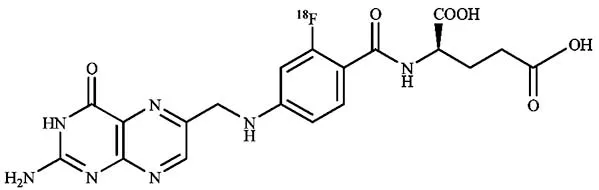
图13 18F-FFA的结构
1.4.418F-Deoxy-Glucose-folate 2012年,Cindy R Fischer等将葡萄糖实体引入标记物分子中(如图14所示),这样的设计大大提高了标记物的水溶性(logD7.4=-4.2±0.1),但是标记过程较为复杂,耗时大约3 h,校正后产率最高可达25%,放射化学纯度大于95%。体外细胞结合实验中,此标记物对叶酸受体显示出很好的亲和力。在荷KB细胞肿瘤小鼠模型中,18F-Deoxy-Glucose-folate表现出很高的肿瘤摄取[(10.03±1.12)%ID/g,60 min p.i],并且滞留时间较长[(9.05±2.12)%ID/g,90 min p.i]。非靶器官摄取很低,90 min瘤/肝比、瘤/肾比和瘤/肉比分别为 1.28±0.22、0.34±0.07 和 36.09±15.37。与99mTc-EC20 相比,18F-Deoxy-Glucose-folate有相似的生物分布。与其他文献报道肝脏、粪便、胆汁等腹部非靶器官中的非特异摄取,在荷瘤小鼠PET显像中取得了很好的显像结果[19]。
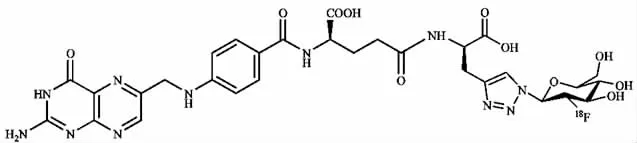
图14 18F-Deoxy-Glucose-folate的结构
1.4.5 2-[18F]-fluoropyridine-4-carbohydrazide-folate I Al Jammaz等标记得到2-[18F]-fluoropyridine-4-carbohydrazide-folate(如图15所示),整个标记过程大约45 min,放化产率大于80%,放射化学纯度大于97%。在体外细胞结合实验中,此标记物显示出对叶酸受体较强的亲和力,解离常数Kd为(15.51±1.80)nM。在荷KB细胞肿瘤小鼠模型中,肿瘤摄取虽然不是很高[(5.74±0.16)%ID/g,60 min p.i],但是除了肾脏特异性摄取较高外,非靶器官摄取很低(均小于1.00%ID/g),在荷瘤小鼠micro PET显像中取得了很好的显像结果[20,21]。

图15 2-[18F]-fluoropyridine-4-carbohydrazide-folate的结构
2 结语
近年来,受体介导的靶向分子探针成为放射性药物研发的重点。与其他靶向转运系统相比,叶酸受体具有亲和力强、分子量小、价格低廉、易于结构修饰、化学和生物稳定性好、无免疫原性等优点,叶酸及其类似物偶联的叶酸受体药物成为靶向药物研究的热点。目前,大多数叶酸受体介导的放射性药物的研究仅限于实验阶段,而寻找更好的标记方法、更优的连接剂,提高药物体内靶向性是今后需要解决的问题。
[1]张亚东,陆洁.99mTc标记的叶酸肿瘤显像剂[J].化学进展,2010,22(4):603-609.
[2]林风云,朱照静.叶酸受体介导的靶向给药研究进展[J].国外医学(药学分册),2006,33(5):178-191.
[3]Wang S,Lee R J,C J Mathias,et al.Synthesis,purification,and tumor cell uptake of67Ga-deferox amine-folate,a potential ra-diopharmaceutical for tumour imaging[J].Bioconjugate chemistry,1996(7):56-62.
[4]C J Mathias,Lewis M R,Reichert D E,et a1.Preparation of66Ga and68Ga-lablled Ga(Ⅲ)-defero xamine-folate as potential fol ate-receptortargeted PET radiopharmaceuticals[J].Nuclear Medicine and Biology,2003(30):725-731.
[5]Cristina Muller,Iontcho R Vlahov,Hari Krishna R Santhapuram,et al.Tumor targeting using67Ga-DOTA-Bz-folate-invest tingations of methods to improve the tissue distribution of radiofolates[J].Nuclear Medicine and Biology,2011(38):715-723.
[6]Siegel B A,Dehdashti F,Mutch D G,et al.Evaluation of 111In-DTPA-folate as a receptor-targeted diagnostic agent for ovari an cancer:initial clinical results[J].Journal of Nuclear Medicine,2003(44):700-707.
[7]Chun Yen Ke,Carla J Mathias.Targeting the Tumor-Associated Folate Receptor with an111In-DTPA Conjugate of pteroic Acid[J].Journal of the American Chemical Society,2005,20(127):7422-7426.
[8]Carla J Mathias,D Hubers,Philip S Low,et al.Synthesis of[99mTc]-DTPA-folate and its evaluation as a folate-receptor-ta rgeted radiopharmaceutical[J].Bioconjugate Chemistry,2000(11):253-257.
[9]C P Leamon,M A Parker,I R Vlahov,et al.Synthesis and bi ological evaluation of EC20:a new folate-derived,99mTc based radiopharmaceutical[J].Bioconjuge Chemistry,2002(13):1200-1210.
[10]Joseph A Reddy,Phd Le-cun Xu.Preclinical Evacluation of99mTc-EC20 for imaging Floate receptor-positive Tumour[J].Jou rnal of Nuclear Medicine,2004(45):857-866.
[11]W Guo,G H Hinkle,R J Lee.99mTc-HYNIC-folate:a novel rece ptorbased targeted radiopharm aceutical for tumor imaging[J].Journal of Nuclear Medicine,1999(40):1563-1569.
[12]D P Trump,C J Mathias,Z Yang,et al.Green.Synthesis and eva luation of99mTc(CO)3-DTPA-Folate as a folate-receptor targ eted radiopharmaceutical[J].Nuclear Medicine and Biology,2002(29):569-573.
[13]Thomas L Mindt,Cristina Muller.“Click-to-Chelate”:In Vitro and In Vivo Comparison of a99mTc(CO)3-Labeled N(τ)-Histidine Folate Derivative with Its Isostructural,Clicked 1,2,3-Triazole Analogue[J].Bioconjugate Chemistry,2008(19):1689-1695.
[14]Jie Lu,Yan Pang,Fang Xie,et al.Synthesis and in vitrin vivo evaluation of99mTc-labeled folate conjugates for folate recep tor imaging[J].Nuclear Medicine and Biology,2011(38):557-565.
[15]Hong juan Guo,Fang Xie,Meilin Zhu,et al.The synthesis of pteroyllys conjugates and its application as Technetium-99m labeled radiotracer for folate receptor-positive tumor targeting[J].Bioorganic Medicinal Chemistry Letters,2011(21):2025-2029.
[16]Andrea Bettio,Michael Honer,Cristina Muller,et a1.Synthesis and Preclinical Evaluation of a Folic Acid Derivative Labeled with18F for PET Imaging of Folate Receptor Positive Tumors[J].Journal of Nuclear Medicine,2006,47(6):1153-1160.
[17]Tobias L Ross,Michael Honer,Phoebe Y H Lam,et a1.Fluori ne-18 Click Radiosynthesis and Preclinical Evaluati on of a New18F-Labeled Folic Acid Derivative[J].Bioconjugate Chemis try,2008,19(12):2462-2470.
[18]Tobias L Ross,Michael Honer,Cristina Muller,et al.A New18F-Labeled Folic Acid Derivati ve with Improved Properties for the PET Imaging of Folate Receptor Positive Tumors[J].The journal of nuclear medicine,2010,51(11):1756-1762.
[19]Cindy R Fischer,Cristina Muller,Jossefine Reber,et al.[18F]Flu oro-Deoxy-Glucose Folate:A Novel PET Radiotracer with Improved in vivo Properties for Folate Receptor Targetin g[J].Bioconjugate Chemistry,2012(23):805-813.
[20]I Al Jammaz,B Al Otaibi,S Okarvi,et al.Novel synthesis of[18F]-fluorobenzene andpyridinecarbohydrazide-folates as potential PET radiopharmaceuticals[J].Journal of Labelled Compounds and Radiopharmaceuticals,2006(49):125-137.
[21]I Al Jammaz,B Al Otaibi,S Amer,et al.Rapid synthesis and in vitro and in vivo evaluation of folic acid derivatives labeled with fluorine-18 for PET imaging of folate receptor-positive tumors[J].Nuclear Medicine and Biology,2011(38):1019-1028.

