两株链霉菌对小麦幼苗生长及诱导抗性的影响
刘玉涛,张 凯,马军妮,来航线,薛泉宏(西北农林科技大学 资源环境学院 陕西杨凌 712100)
小麦是重要的粮食作物之一,约34%~40%的世界人口以小麦为主粮。中国是小麦生产大国,种植面积和总产量分别占全国粮食作物的25%和22%[1]。利用育种及优化栽培措施提高小麦单产已取得重要进展,2015年中国小麦单产达到5.4 t·hm-2[2],但与世界最高单产8.2 t·hm-2[3]仍有较大差距。采用新的生物技术提高小麦产量是值得探索的新途径。研究表明,有益微生物能促进作物生长,提高植物诱导抗性[4-6]。如木霉可促进植物种子萌发、幼苗及根系生长发育,并能诱导植物产生系统抗性[7];多黏芽孢杆菌LM-3产生的菌体蛋白能促进水稻生长,提高诱导抗性[8],枯草芽孢杆菌B29能够诱导黄瓜多种抗性指标提高[9];放线菌中的链霉菌对甜瓜[10]、番茄[11]、棉花[12]、丹参[13]和辣椒[14]均有促生作用,另外有链霉菌促进了甜瓜和番茄诱导抗性的产生[10-11]。但尚无研究报道链霉菌是否促进小麦生长及产生诱导抗性。本研究采用皿内和盆栽试验探讨2株链霉菌的混合制剂对小麦的促生作用及对5种抗性指标的影响,旨在为链霉菌剂用于小麦促生增产研究提供科学依据。
1 材料与方法
1.1 材 料
供试品种:‘小偃22号’。
髙氏1号液体培养基:高氏1号培养基去琼脂[15]。
砂培营养液:霍格兰氏营养液[16]。
供试链霉菌:娄彻氏链霉菌(Streptomycesroche,D74)和密旋链霉菌(Streptomycespartum,Act12),由西北农林科技大学资源环境学院微生物资源研究室分离筛选。供试菌剂:粉状,为娄彻氏链霉菌D74和密旋链霉菌Act12菌粉按质量比1∶1混合而成的复合制剂,其中,D74和Act12菌粉的有效活菌数分别为3.5×1010cfu·g-1和2.3×108cfu·g-1。
链霉菌发酵液:将D74、 Act12接入髙氏1号液体培养基,28 ℃摇床100 r·min-1培养7 d,快速滤纸过滤后将2株菌的无细胞发酵滤液按1∶1体积比混匀。
盆栽土壤:土娄土,大田耕层土壤去除石子和草根后过1 cm筛,按1.5 g·kg-1添加复合肥[m(N)∶m(P2O5)∶m(K2O)=15∶15∶15],充分混匀。
砂培用砂:普通建筑用黄砂过3 mm筛。
1.2 方 法
1.2.1 小麦发芽率及种子活力测定 菌粉浸提液浸种:将粉状链霉菌剂与自来水按1∶4体积比混合,摇匀,浸泡2 h,4 000 r·min-1离心10 min,取上清液(5倍稀释液),再分别稀释至10、102、103倍;将选好的60粒小麦种子分别置上述稀释液中浸泡12 h,用清水浸泡对照组,浸泡结束后置培养皿内滤纸上,加少量无菌水润湿滤纸,26 ℃培养,每个稀释度重复6皿,每皿10粒,其中3皿用于发芽率测定,每12 h计数1次,共培养7 d;3皿用于种子活力测定,同步培养,待胚芽露出,用TTC法测种子活力[17],重复3皿。
包衣处理:以6 g·L-1羧甲基纤维素钠溶液为胶结剂,按200 mL·kg-1种子用量加至小麦种子中充分搅拌,使种子表面均匀布满胶结剂;将菌粉加至小麦种子中,搅拌均匀,使菌粉均匀包裹在小麦种子表面,阴凉处风干后置培养皿内滤纸上,按菌粉浸提液发芽率测定方法测定包衣种子发芽率。
1.2.2 盆栽试验方案及实施 链霉菌发酵液浸种处理(S),设5个稀释梯度(倍):0(原液,CK)、5、10、102、103、104。小麦种子包衣处理(C),设6个包衣量(mg/粒):0(CK)、5、10、20、30、35;浸种+包衣复合处理(S+C),设5个梯度(发酵液稀释倍数+菌粉包衣量mg/粒):5+5、10+10、102+20 、103+30、104+35。以上方案采用砂培与土培2种盆栽方式实施。砂培用于检测无土壤微生物、土壤有机质及土壤胶体吸附等生物与理化性质影响时链霉菌的作用。
发酵液浸种:将选好的小麦种子分别置于不同稀释度的链霉菌发酵液中浸泡12 h,对照组用清水浸泡,阴干后播种。浸种+包衣复合处理:先浸种,再用“1.2.1”方法包衣。盆栽试验用盆尺寸为口径×高度=15 cm×12 cm,装土量及装砂量均为每盆1 kg,每盆播8粒小麦种子,每个处理重复3盆。每天统计1次出苗数,共统计7 d。
1.2.3 生物学性状测定 盆栽试验于2015年9月至2016年1月在西北农林科技大学科研温室中进行。小麦播种后,按正常的水肥条件进行管理,待小麦长到拔节期,于2015-12-29采样,将盆内土壤倒出,轻轻抖落附着于根上的土壤,用自来水冲洗干净,吸水纸吸干后称植株总鲜质量、茎叶鲜质量、根系鲜质量,测定叶片(自上而下第2片叶)长度、宽度,估算叶面积。每盆采集5株。
1.2.4 生理生化指标测定 以“1.2.3”生物学性状测定采集的植株为材料,将每盆所采5株小麦叶片剪碎混匀,称取1.000 g 3份,研磨、10 000 r·min-1离心获取上清液,按照高俊凤[18]的方法测定叶片过氧化物酶(POD)、苯丙氨酸解酶(PAL)、多酚氧化酶(PPO)活性及 MDA质量摩尔浓度;所余根系采用TTC法测定根系活力[17]。测值均用供试样品单位鲜质量表示。采用该方法可使生化与生物学性状测定材料均为相同植株,从而结果有更好的可比性。
1.2.5 数据处理 发芽指数GI=∑(Gt/Dt)
ΔCK=(处理-对照)/对照×100%
式中:Gt和Dt分别表示第t天的发芽数及对应的发芽时间,ΔCK为菌剂处理效应。
数据处理分析采用Excel 2010、DPS 9.50和SPSS 20.0,数据差异显著性检验采用Duncan和LSD。
2 结果与分析
2.1 链霉菌对小麦的促生作用
2.1.1 发芽率与种子活力 发芽率:从表1可知,用适量菌粉进行种子包衣可显著提高小麦发芽率。包衣量过大,发芽率及种子活力降低。如包衣量为每粒10、20 mg时,小麦发芽率较对照分别提高41.9%、31.3%(P<0.05),发芽指数均提高40.0%(P<0.05);包衣量每粒30 mg时,发芽率降低31.3%(P<0.05),发芽指数降低40.0%(P<0.05)。菌粉浸提液浸种处理降低发芽率,其中,提取液稀释5倍时,发芽率降低30.6%(P<0.05);浸提液稀释倍数增大,对发芽的抑制作用减小;对发芽指数无显著性影响。
种子活力:从表1可知,用供试菌粉浸提液液浸种可显著提高小麦种子活力。其中10倍和102倍稀释液浸种分别使种子活力较对照增加31.8%和21.7%(P<0.05)。

表1 链霉菌粉种子包衣及菌粉浸提液浸种处理小麦发芽率、发芽指数及种子活力(N=3)
注:测值数据为“平均值±标准差”;同一处理方式下同列数据后不同小写字母表示数据差异达显著水平(P<0.05);下同。
Note:Data are “mean±standard deviation”.For each treatment,different lowercase letters in the same column indicate significant difference(P<0.05);the same below.
2.1.2 对小麦生物学性状的影响 从表2可知,适量种子包衣能显著促进小麦茎叶及根系生长,增加砂培小麦苗期叶片面积。包衣量为每粒10、30及35 mg时,叶面积较对照分别增加146.2%、174.2%及129.5% (P<0.05);包衣量为每粒5~30 mg时,植株总鲜质量较对照增加85.2%~144.1%(P<0.05),根系鲜质量增加200%~300%(P<0.05);包衣处理对株高及出苗率无显著影响。砂培可反映无土壤胶体对菌剂中生物活性物质吸附及土壤微生物等多种复杂因素影响时供试链霉菌的作用,可以更准确的反映菌剂及其菌剂浸提液对小麦生长的影响。砂培试验表明,供试链霉菌对小麦确有促生作用。
从表2可知,在适宜稀释倍数时,发酵液浸种能显著增加小麦株高、叶面积、植株总鲜质量及根系鲜质量,提高小麦出苗率。其中,稀释10倍时,小麦株高、叶面积较对照分别增加29.2%、27.6%(P<0.05),稀释100倍时,植株总鲜质量及根系鲜质量较对照分别提高26.8%及25.0%(P<0.05)。当稀释倍数为102~104时,小麦出苗率较对照提高44.0%~103.8%(P<0.05)。

表2 链霉菌粉种子包衣及发酵液浸种处理砂培小麦生物学性性状(N=5)
从表2可知,菌粉包衣和发酵液浸种复合处理小麦种子时,在适宜包衣量及浸种剂量下,对小麦出苗率、植株总鲜质量及根系鲜质量均有显著的促进作用。如10+10处理较对照出苗率增加89.1% (P<0.05),10+10和102+20处理的总鲜质量分别增加了64.9%和37.8%(P<0.05),10+10和103+30处理的根系鲜质量较对照分别增加45.5%和36.4%(P<0.05)。
比较表2中3种种子处理方式可知,菌粉种子包衣处理对小麦根系、株高、叶面积和生物量的促进作用明显,浸种处理更有利于提高出苗率,在适宜的包衣量及浸种剂量下,浸种+加包衣复合处理对出苗率及茎叶与根系生长均有较好效果。
从表3土培试验可知,菌粉包衣和发酵滤液浸种对小麦出苗率、株高、叶面积、植株总鲜质量和根系鲜质量均无显著影响。仅在包衣量为每粒20 mg时,小麦叶片面积较对照增加25.3%(P<0.05)。适宜包衣量与发酵滤液稀释度时,种子包衣+发酵滤液浸种可显著提高根系鲜质量,如处理102+20的株高较对照增加21.3%(P<0.05),5+5及10+10处理,根系鲜质量分别较对照增加100.0%及66.7%(P<0.05),104+35处理的株高和叶面积较对照分别增加14.8%和48.1%(P<0.05)。
比较表2与表3结果可知,在土培条件下,菌粉种子包衣效果较砂培差,可能与土壤胶体对种子表面附着菌粉中放线菌代谢活性物质的吸附固定无效化有关,与土壤微生物对种子表面接种链霉菌的作用有关。土培试验可以反映在土壤胶体对菌粉中生物活性物质发生吸附及土壤中各种复杂因子存在条件下菌粉及其发酵液对小麦生长的影响,试验条件更接近田间,其结果可以更准确的反映菌粉及其浸提液在近似田间条件下对小麦种子处理的结果。试验结果表明,土壤条件会降低链霉菌的促生作用。
2.1.3 对小麦根系活力的影响 从表4可知,适宜用量菌粉包衣和适宜浓度无细胞发酵滤液浸种均可提高小麦根系活力。其中,砂培试验中,包衣量每粒5 mg处理根系活力提高62.7%(P<0.05),102稀释液使根系活力提高44.8%(P<0.05)。土培试验中,菌粉包衣对根系活力有一定抑制作用,但均未达到显著水平;104倍稀释液使根系活力提高19.6%(P<0.05)。浸种加包衣复合处理对小麦根系活力影响不显著。
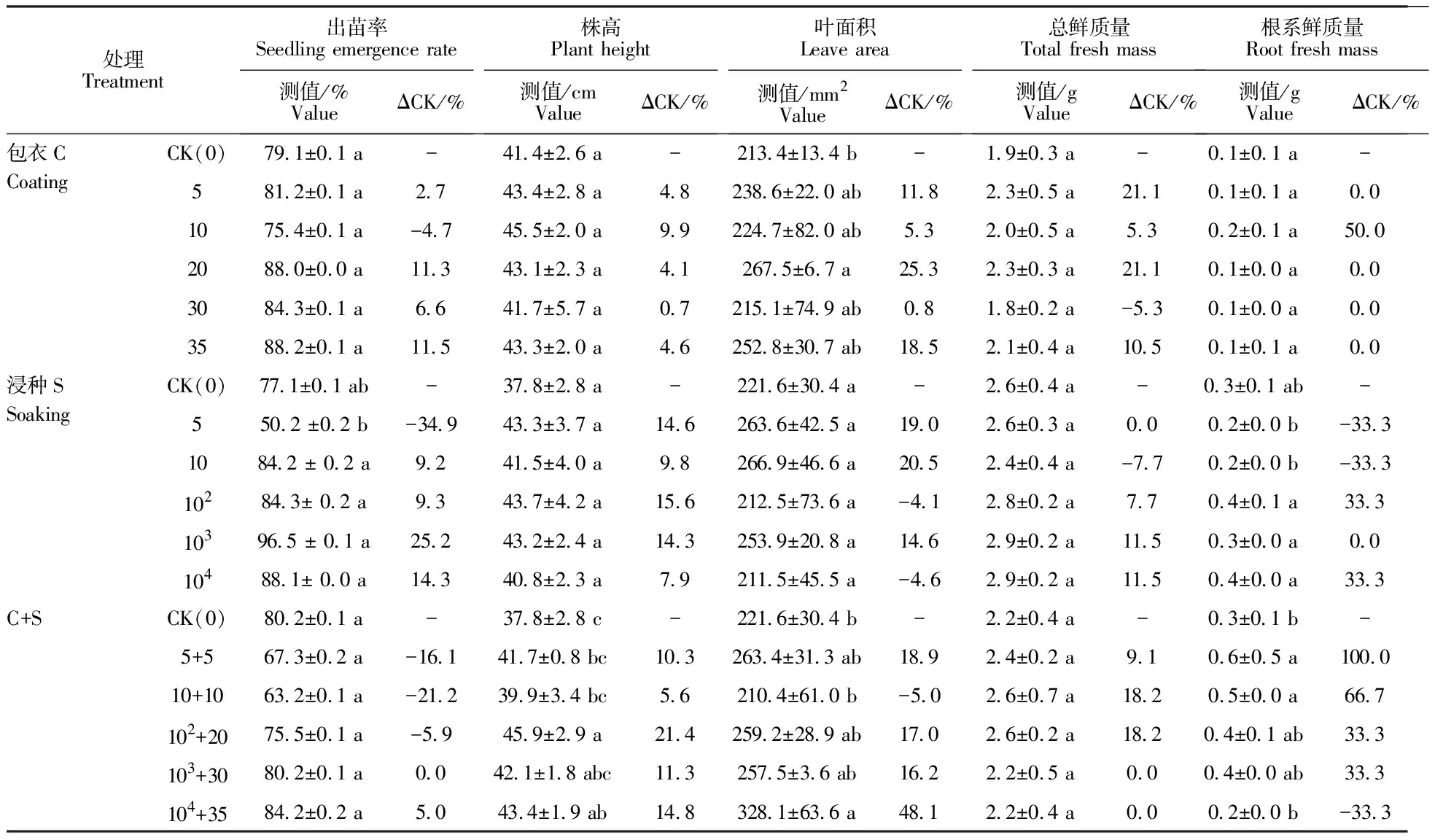
表3 链霉菌粉种子包衣及发酵液浸种处理土培小麦生物学性状(N=5)

表4 链霉菌粉种子包衣及发酵液浸种处理砂培和土培小麦根系活力
2.2 链霉菌对小麦诱导抗性及抗逆性的影响
诱导抗性通常用诱导酶POD、PPO及PAL活性表示。
POD酶活性:由表5可知,菌粉种子包衣及发酵滤液浸种对小麦叶片POD酶活性有显著影响。土培试验中,除包衣量每粒20 mg处理外,其余菌粉种子包衣处理POD酶活性较对照提高46.7%~70.0% (P<0.05);发酵滤液浸种及浸种+包衣复合处理对POD酶活性的影响均不显著。砂培试验中,菌粉种子包衣对小麦叶片POD酶活性均有抑制作用(包衣量每粒10 mg除外),其中,包衣量每粒30 mg处理POD酶活性较对照降低38.9%(P<0.05),稀释103、104倍无细胞发酵滤液浸种处理POD酶活性较对照分别降低28.1%、52.2%(P<0.05)。
PPO酶活性:由表5可知,菌粉包衣处理对小麦叶片PPO酶活性的影响因包衣量而异。土培试验中,低量包衣对小麦叶片PPO酶活性有提高作用,高量包衣则有抑制作用。如包衣量每粒5 mg处理使小麦叶片PPO酶活性较对照提高52.5%(P<0.05),包衣量每粒35 mg时,小麦叶片PPO酶活性较对照降低24.6%(P<0.05)。砂培试验中,种子包衣对PPO酶活性有抑制作用,包衣量每粒5 mg处理使小麦叶片PPO酶活性较对照降低25.3%(P<0.05)。无细胞发酵滤液浸种及浸种加包衣复合处理对PPO酶活性均无显著影响。
PAL 酶活性:由表5砂培及土培试验结果可知,菌粉种子包衣对小麦叶片PAL酶活性无显著影响。但在土培试验中,浸种+包衣复合处理可显著提高小麦叶片PAL酶活性,其中,5+5、10+10和20+102分别使PAL酶活性提高24.2%、20.2%和24.2%(P<0.05)。高剂量发酵滤液浸种抑制小麦叶片PAL酶活性,低剂量发酵滤液对PAL酶活性无显著性影响。如5倍稀释液使小麦叶片PAL酶活性降低34.3%(P<0.05)。
小麦叶片MDA质量摩尔浓度:由表5可知,适宜浓度的无细胞发酵滤液浸种可显著降低小麦叶片MDA质量摩尔浓度,102~104倍无细胞发酵滤液浸种,可使砂培小麦叶片MDA质量摩尔浓度降低34.0%~40.2%(P<0.05)。菌粉种子包衣及浸种+浸种加包衣复合处理对小麦叶片MDA质量摩尔浓度均无显著影响。

表5 链霉菌粉种子包衣及发酵液浸种处理砂培和土培小麦诱导抗性
3 讨 论
根际细菌具有促生作用[19]。峥嵘[20]发现采用5406链霉菌处理后小麦幼苗株高、根长、根体积及根系活力均有不同程度提高,茎叶干质量及叶绿素含量也有增加。陈秦等[11]研究发现密旋链霉菌可促进番茄根系生长,增加生物量。赵娟等[10]研究表明,链霉菌接种能促进甜瓜胚根胚轴生长,但是链霉菌对小麦有无促生作用尚不清楚。
本研究发现,用密旋链霉菌与娄彻氏链霉菌组成的复合菌剂进行小麦种子包衣及浸种处理在适宜浓度下均能提高小麦发芽率、发芽指数;在菌剂包衣量过大或浸提液、发酵液剂量过高时抑制种子萌发,在适宜剂量才能达到显著促进作用,说明菌剂中存在供试链霉菌次级代谢形成的促生活性成分。比较砂培试验中3种处理方式可知,包衣对小麦根系、株高、叶面积和生物量的促进作用更大,浸种更有利于出苗率增加。土培试验中,菌剂种子包衣及浸种处理的促生作用差于砂培,可能与土壤胶体对种子表面附着菌粉中活性物质的吸附固定无效化及土壤微生物对菌剂中接种链霉菌的影响有关。种子包衣和浸种处理的作用存在差异,可能是因为种子包衣时,菌粉中既含有链霉菌活性代谢产物也含有活菌,而无细胞发酵液中只含有活性代谢产物,其详细原因需尚待深入研究。
根系活力可反映根系代谢活动的强弱和根系吸收功能。根系发育直接影响地上部茎叶生长和作物产量[21-22]。本研究发现,适量供试链霉菌剂种子包衣和浸种处理均能提高小麦的根系活力,进而影响根系对土壤养分及水分的吸收能力。
诱导植物产生抗病性是植物病害生物防治的主要机制之一。植物诱导抗性是通过诱导防御酶活性提高实现的,防御酶活性与抗病性呈正相关[23-28]。防御酶系主要包括苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)、多酚氧化酶(PPO)。PAL 催化苯丙氨酸脱氨基后产生肉桂酸,最终转化为木质素并沉积在细胞壁周围 ,将病原菌限制在一定的细胞范围内,阻止其进一步扩散危害[29];POD和PPO同属氧化酶类,能催化植物体内酚类物质形成醌进而抑制病原菌生长,并抑制病原菌果胶分解酶和纤维素分解酶活性[30];MDA 作为膜脂过氧化作用的最终产物,是膜脂过氧化程度的重要标志,与细胞膜的损害程度直接相关[31]。
本研究发现,土培条件下,适宜用量菌粉包衣及包衣+发酵液浸种处理可显著提高小麦叶片POD、PPO及PAL活性,对MDA无显著影响,表明供试链霉菌能提高小麦的诱导抗性。至于对小麦的抗病性有无显著增强效果,尚待进一步研究。另外,砂培条件下,菌粉包衣及发酵液浸种处理可显著降低小麦叶片POD、PPO活性,可能与砂培条件下无土壤胶体吸附固定,菌剂中有效生物活性物质浓度过高,导致小麦叶片诱导酶活性降低,其详细原因尚不清楚。在砂培条件下,对小麦叶片诱导酶活性的抑制作用增强及土培条件下促生作用减弱,可能与土壤胶体对菌剂中促生活性物质的吸附固定失活、有效活性物质浓度降低及砂培中无胶体吸附固定失活,导致活性物质浓度过高,达到抑制浓度有关。
4 结 论
供试链霉菌对小麦具有较强的促生作用,并能提高小麦的诱导抗性。用密旋链霉菌和娄彻氏链霉菌复合菌粉进行小麦种子包衣及菌粉浸提液浸种,在适宜包衣量或浸种剂量时,能够促进小麦发芽,提高出苗率,促进叶片和根系生长及生物量增加,并提高小麦叶片POD、PPO及PAL诱导酶活性,降低小麦叶片细胞质膜膜脂过氧化程度。但包衣量过大或浸种剂量过高时,对小麦生长及诱导酶活性均有显著抑制作用。应对适宜的包衣量、浸种剂量及作用机理进行系统研究。
参考文献Reference:
[1] 贾筱智.中国小麦主产区小麦生产技术效率与技术进步率的测算与分析[D].陕西杨凌:西北农林科技大学,2013:1-10.
JIA X ZH.Calculation and analysis of technical efficiency and technical progress rate of wheat production in main wheat production areas in China[D].Yangling Shaanxi:Northwest A & F University,2013:1-10.
[2] 中华人民共和国国家统计局.中国统计年鉴[EB/OL]:中国统计出版社,2015[2017-4-10].http://www.stats.gov.cn/tjsj/ndsj/2015/indexch.htm.
National Bureau of Statistics of the People’s Republic of China.China Statistical Yearbook [EB/OL]:China Statistics Press,2015[2017-4-10].http://www.stats.gov.cn/tjsj/ndsj/2015/indexch.htm.
[3] 张 晶.基于GIS栅格尺度的我国冬小麦生产潜力研究[J].生态经济,2008(10):37-40.
ZHANG J.Study on potential productivity of winter wheat in China based on GIS grid scale[J].EcologicalEconomy,2008(10):37-40.
[4] 贺字典,高玉峰.生防菌在植物病害防治中的研究进展(综述)[J].河北职业技术师范学院学报,2002,17(2):57-59.
HE Z D,GAO Y F.Research progress of biocontrol in plant disease control(review) [J].JournalofHebeiPolytechnicNormalUniversity,2002,17(2):57-59.
[5] 郑 莉,梁建根,施跃峰.生防菌ZJH-10对黄瓜灰霉病诱导抗性的研究[J].中国农学通报,2009,25(3):197-201.
ZHENG L,LIANG J G,SHI Y F.Study on the induced resistance of ZJH-10 to cucumber gray mold[J].ChineseAgriculturalScienceBulletin,2009,25(3):197-201.
[6] 许英俊,薛泉宏,邢胜利,等.放线菌制剂对对草莓的促生作用及对 PPO 活性的影响[J].西北农业学报,2007,16(6):146-153.
XU Y J,XUE Q H,XING SH L,etal.Effects of actinomycete on the growth of strawberry and its effect on PPO activity[J].ActaAgriculturaeBoreali-occidentalisSinica,2007,16(6):146-153.
[7] 赵 蕾,滕安娜.木霉对植物的促生及诱导抗性研究进展[J].植物保护,2010,36(3):43-46.
ZHAO L,TENG A N.Advances in research on the promotion and resistance ofTrichodermato plants[J].PlantProtection,2010,36(3):43-46.
[8] 宋永燕,李 平,李姝晋,等.生防细菌 LM-3 对水稻的促生性和诱导抗性研究[J].西南农业学报,2006,19(3):439-441.
SONG Y Y,LI P,LI SH J,etal.Study on the promoting and inducing resistance of biocontrol bacterium LM-3 to rice[J].JournalofSouthwestAgriculturalUniversity,2006,19(3):439-441.
[9] 张先成,张云湖,赵晓宇,等.枯草芽孢杆菌 B29菌株对黄瓜植株的诱导抗性[J].武夷科学,2009(25):25-28.
ZHANG X CH,ZHANG Y H,ZHAO X Y,etal.Induced resistance of bacillus subtilis B29 to cucumber plants[J].WuyiScience,2009(25):25-28.
[10] 赵 娟,杜军志,薛泉宏,等.3株放线菌对甜瓜幼苗的促生与抗性诱导作用[J].西北农林科技大学学报(自然科学版),2010,38(2):110-115.
ZHAO J,DU J ZH,XUE Q H,etal.Effects of actinomycetes on the growth and resistance of muskmelon seedlings[J].JournalofNorthwestA&FUniversity(NaturalScienceEdition),2010,38(2):110-115.
[11] 陈 秦,薛泉宏,申光辉,等.放线菌制剂对番茄 PPO 活性及生物量的影响[J].西北农林科技大学学报(自然科学版),2010,38(3):185-187.
CHEN Q,XUE Q H,SHEN G H,etal.Effects of actinomyces on PPO activity and biomass [J].JournalofNorthwestA&FUniversity(NaturalScienceEdition),2010,38(3):185-187.
[12] 陈 秦,薛泉宏,申光辉,等.放线菌对棉花幼苗生长及抗旱能力的影响[J].西北农业学报,2010,19(8):84-89.
CHEN Q,XUE Q H,SHEN G H,etal.Effect of actinomycetes on the growth and drought resistance of cotton seedling [J].ActaAgriculturaeBoreali-occidentalisSinica,2010,19(8):84-89.
[13] 段佳丽,薛泉宏,舒志明,等.放线菌 Act12 与腐植酸钾配施对丹参生长及其根域微生态的影响[J],生态学报,2015,35(6):1807-1819.
DUAN J L,XUE Q H,SHU ZH M,etal.Effect of actinomycetes Act12 combined with potassium humate on the growth and root zone microecology of salvia miltiorrhiza[J].JournalofEcology,2015,35(6):1807-1819.
[14] 郭志英,薛泉宏,张晓鹿,等.生防菌苗床接种对辣椒根域微生态及产量的影响[J],西北农林科技大学学报(自然科学版),2008,36(4):160-165.
GUO ZH Y,XUE Q H,ZHANG X L,etal.Effect of biocontrol vaccine seedbed on microecology and yield of hot pepper root zone[J].JournalofNorthwestA&FUniversity(NaturalScienceEdition),2008,36(4):160-165.
[15] 程丽娟,薛泉宏,来航线.微生物学实验技术[M].北京:科学出版社,2012.
CHENG L J,XUE Q H,LAI H X.Microbiology Laboratory Technology[M].Beijing: Science Press,2012.
[16] 刘 丹,毕晓露,郭 腾,等.广东万年青在北方地区温室环境下水培营养液配方筛选[J].新疆农业科学,2015,52(4):667-674.
LIU D,BI X L,GUO T,etal.Screening of Guangdong Wannianqing hydroponic nutrient solution in greenhouse in North China[J].XinjiangAgriculturalSciences,2015,52(4):667-674.
[17] 郑 坚,陈秋夏,金 川,等.不同TTC法测定枫香等阔叶树容器苗根系活力探讨[J].浙江农业科学,2008(1): 40-41.
ZHENG J,CHEN Q X,JIN CH,etal.Study on the root system activity of container seedlings of broadleaf trees by different TTC methods [J].JournalofZhejiangAgriculturalSciences,2008(1): 40-41.
[18] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2000:203-204.
GAO J F.Experimental Instruction of Plant Physiology[M].Beijing: Higher Education Press,2000:203-204.
[19] 胡春江,薛德林,马成新,等.植物根际促生菌(PGPR)的研究与应用前景[J].应用生态学报,2004,15(10):1963-1966.
HU CH J,XUE D L,MA CH X,etal.Research and application prospect of plant rhizosphere bacteria(PGPR) [J].JournalofAppliedEcology,2004,15(10):1963-1966.
[20] 峥 嵘.5406放线菌对小麦幼苗的影响[J].内蒙古农业大学学报(自然科学版),2006,6(2):150-152.
ZHENG R.Effect of 5406 actinomycetes on the growth of wheat seedlings[J].JournalofInnerMongoliaAgriculturalUniversity(NaturalScienceEdition),2006,6(2):150-152.
[21] 熊明彪,罗生茂,田应兵,等.小麦生长期土壤养分与根系活力变化及其相关性研究[J].土壤肥料,2005(3):8-11.
XIONG M B,LUO SH M,TIAN Y B,etal.Study on the change of soil nutrient and root activity in wheat growing period and its correlation[J].SoilandFertilizer,2005(3):8-11.
[22] 胡 敏,贺德先,蒋 向,等.不同研究方式和方法对小麦根系活力及根质量测量准确度的影响[J].华北农学报,2012,27(b12):127-130.
HU M,HE D X,JIANG X,etal.Effects of different research methods and methods on wheat root activity and root quality measurement accuracy[J].ActaAgriculturaeBoreali-sinica,2012,27(b12):127-130.
[23] 王万能,全学军,崇 刚.植物诱导抗性的机理和应用研究进展[J].湖北农业科学,2010,49(1):205-206.
WANG W N,QUAN X J,CHONG G.Advances in mechanism and application of plant induced resistance[J].HubeiAgriculturalSciences,2010,49(1):205-206.
[24] LIU L,KLOEPPER J W,TUZUN S.Induction systemic in cucumber against fusarium wilt by growth-planting rhizobactria[J].BiologicalControl,1995,85(6):695-697.
[25] GEERT D M,JEOSPH B,YIGAL E,etal.Induced resistance inTrichodermaharzianumT39 biocontrol of botrytis cinerrea [J].UropeanofPlantPathology,1998,106(3):179-286.
[26] MEERA M S,SHIVANNA M B,KAGEYAMA K,etal.Plant growth promoting fungi from zoysiagrass rhizosphere as potentioal inducers of systemic in cucumber[J].Resistence,1994,84(12):1399-1405.
[27] ZHU Q,DABI T,BEECHE A,etal.Cloning and properties of a rice gene encoding phenylane ammonia-lyase[J].PlantMolecularBiology,1995,29:535-550.
[28] TIAN S P,HARMAN G.Defense response induced by seed treatment with Trichoderma harizianum in maize MO17[J].JournalofPlantPathology,2008,38(6):626-634.
[29] 杜立新,冯书亮,王容燕.拮抗BS-208 菌株对番茄灰霉病诱导抗性的初步研究[J].华北农学报,2005,20(6):84-87.
DU L X,FENG SH L,WANG R Y.Preliminary study on antagonistic resistance of BS-208 strain to tomato gray mold resistance[J].ActaAgriculturaeBoreali-Sinica,2005,20(6):84-87.
[30] GUTTERIGE J M C,etal.Superoxide dependent formation of hydroxyl radicals and lipid peroxidation in the presence of iron salts[J].BiochemicalJournal,1982(206):605-609.
[31] 林 艳,郭伟珍,徐振华,等.大叶女贞抗寒性及冬季叶片丙二醛和可溶性糖含量的变化[J].中国农学通报,2012,28(25):68-72.
LIN Y,GUO W ZH,XU ZH H,etal.Changes of cold tolerance andMalondialdehydeand soluble sugar content in winter leaves[J].ChineseAgriculturalScienceBulletin,2012,28(25):68-72.

