Ⅰ群禽腺病毒Hexon蛋白的原核表达及间接ELISA检测方法的建立与应用
张 曼,韩 飞,高 睿,何亚鹏(杨凌职业技术学院 动物工程分院,陕西杨凌 712100)
禽腺病毒(Fowl adenovirus,FAV)是一种无囊膜的双链DNA病毒,可分为Ⅰ、Ⅱ、Ⅲ 3群,Ⅰ群禽腺病毒(Fowl adenovirus group Ⅰ,FAV Ⅰ)具有共同的群抗原[1-2]。该群病毒代表株为鸡胚致死孤儿病毒(Chicken embro lethal orphan virus,CELOV)[3]。近年来,由FAV Ⅰ引起的包涵体肝炎、心包积液综合征和砂囊糜烂的感染呈上升趋势[2,4-6]。特别是2015年6月以来,中国多个省份的鸡群爆发安卡拉病(Angrara disease),病原为Ⅰ群FAV中C种FAV-4型,该病主要特征为突然倒地,出现呼吸道症状,甩鼻、呼吸加快,排黄色稀粪,有神经症状,两腿划空,剖检可见心包积液、肝脏肿大[5-6]。该病主要发生于3周龄的肉鸡,发病后1周左右为死亡高峰期,死亡率可达20%~80%,短时间内就给禽类养殖造成重大损失[7]。此外,腺病毒既可经卵垂直传递,污染鸡胚,也可经排泄物水平传播,给防控带来巨大的困难[1]。对FAV Ⅰ传统的实验室诊断方法如分离与鉴定、中和试验、琼脂糖凝胶免疫扩散试验等方法费时耗力,结果不够精确,PCR、LAMP等对试剂和设备要求较高且不便对大量样品进行检测[7-9],酶联免疫吸附试验(Enzyme linked immunosorbent assay,ELISA)作为经典的、应用最广的血清学诊断方法,具有操作简便、特异性强、敏感性高和成本低廉等优点,可以为Ⅰ群禽腺病毒疫苗免疫效果检测和未免疫鸡群的疾病诊断提供方法[10]。
六邻体蛋白Hexon是FAVⅠ的主要结构蛋白,位于FAVⅠ的外壳,Hexon蛋白含有主要的属和亚属特异性抗原决定簇和次要的种特异性抗原决定簇,可以作为诊断抗原[3]。本研究分析FAVⅠHexon基因编码蛋白的抗原指数和表面分布可能性,选择Hexon蛋白前段抗原性强且具有群特异性的339个氨基酸进行原核表达,制备具有良好反应原性的抗原,对其进行大量诱导表达,将纯化复性后的重组Hexon蛋白作为包被抗原,经过条件优化,建立检测FAVⅠ血清抗体的间接ELISA方法,以期为Ⅰ群禽腺病毒疫苗免疫效果检测和未免疫鸡群的疾病诊断提供方法。
1 材料与方法
1.1 菌种、质粒、实验动物、血清
FAVⅠ CELO毒株(CVCC AV208)购自中国兽药监察所;pEASY-T1 Cloning Kit、感受态细胞Trans5α为北京全式金生物技术有限公司产品;pET-28a(+)质粒为Novagen公司产品;原核表达BL21(DE3)菌株为康为世纪生物公司产品;SPF鸡(Specific pathogen free chicken)购自杨凌绿方生物科技有限公司;FAV Ⅰ、鸡新城疫病毒、禽流感病毒、沙门菌、金黄色葡萄球菌、多杀性巴氏杆菌和大肠埃希菌阳性血清由杨凌职业技术学院动物工程分院畜禽传染病实验室采集,采用ELISA方法或免疫胶体金试纸条鉴定并保存;279份鸡血清样品采自陕西省4个地区的规模化养鸡场。
1.2 主要试剂
2×EsTaqMasterMix、DM2000 plus DNA marker、广谱蛋白Marker购于北京康为世纪生物科技有限公司;细菌基因组提取试剂盒购于天根生化科技(北京)有限公司;内切酶购于Fermentas公司;T4DNA连接酶购于大连宝生物公司;预染蛋白Marker Blue PlusⅡ Protein Marker、ProteinIso Ni-NTA Resin购于北京全式金生物技术有限公司;辣根过氧化物酶标记的兔抗鸡IgG(Rabbit Anti-chicken IgG/HRP antibody)购于北京博奥森生物技术有限公司;酶标板购自BEAVER公司;TMB储存液(2 mg/mL)由杨凌职业技术学院动物工程分院畜禽传染病实验室配制,现配现用;其他试剂均为进口或国产分析纯。
1.3 Hexon基因的扩增和表达载体构建
根据GenBank 中收录的FAV Ⅰ(CELO Phelps株,GenBank登录号U46933.1)Hexon基因序列,利用Primer 5.0软件,设计引物,上游引物HexonF-BamHⅠ:5′-CGCGGATCCATGAC- TGCGCTTA-CTCCCGA-3′(下划线为BamHⅠ酶切位点),HexonR-XhoⅠ:5′-CCGCTCGAG- CGCCAGCATGTACTGGTAAC-3′(下划线为XhoⅠ酶切位点),位置为18 289~19 305 bp,扩增长度为1 017 bp,引物由Invitrogen公司合成。
以FAVⅠ的DNA为模板,进行PCR扩增。切胶回收目的条带,连接pEASY-T1Cloning载体,获得T1-Hexon阳性质粒,送华大基因(北京)测序。双酶切T1-Hexon和pET-28a(+)质粒,回收酶切产物,将目的基因Hexon连接到pET-28a(+)载体中,PCR选取阳性克隆,然后双酶切鉴定,并进行质粒测序,序列正确的质粒命名为pET-Hexon。
1.4 Hexon蛋白的原核表达
pET-Hexon转化BL21(DE3)感受态细胞,对诱导剂浓度(IPTG 终浓度 0~1.0 mmol/L)和诱导时间进行优化,收集并处理样品,然后进行SDS-PAGE分析。
1.5 Hexon蛋白的纯化、复性
诱导培养1 L重组菌,收集菌体,裂解收集包涵体蛋白,按ProteinIso Ni-NTA Resin说明书操作纯化目的蛋白Hexon。
配制透析液进行蛋白复性,透析液A、B、C均含有20 mmol/L Tris-HCl,其他组分为:透析液A(分别加入6、4、2和1 mol/L的尿素,调pH为8.0)、透析液B(0.6 mmol/L L-精氨酸,φ=10%的甘油,2 mmol/L EDTA,0.5 mol/L,调pH为8.0)和透析液C(25 mmol/L NaCl,0.2 mol/L尿素)。将纯化后的Hexon重组蛋白转入透析袋中,依照尿素浓度从高到低的顺序放入透析液A中,然后依次放入透析液B、透析液C中,在4 ℃环境中磁力搅拌透析复性,每个透析液中放置10 h。测定复性后的Hexon重组蛋白的质量浓度,分装保存于-20 ℃。
1.6 重组蛋白的Western blot 分析
对纯化后的Hexon蛋白进行SDS-PAGE,转膜封闭后,用1∶500倍稀释的一抗(鸡FAV Ⅰ阳性血清)于4 ℃孵育过夜后,用1∶10 000倍稀释的二抗(HRP标记的兔抗鸡 IgG 抗体)孵育2 h后,ECL反应液孵育,暗室中压片曝光。
1.7 间接ELISA检测方法的建立与初步应用
1.7.1 间接ELISA方法 用0.1 mol/L碳酸盐缓冲液(pH 9.6)将纯化后的抗原稀释至所需质量浓度,以每孔100 μL的包被量加入96孔ELISA板中,用保鲜膜封孔顶,置4 ℃过夜;次日,用PBST洗液(pH 7.4)洗涤3次(每次5 min)、拍干;加入封闭液(含50 g/L脱脂奶粉的PBST),每孔200 μL,37 ℃ 1 h,弃去封闭液;加入血清样品(用含50 g/L脱脂奶粉的PBST稀释),每孔100 μL,37 ℃ 1 h,同样方法洗板、拍干;加酶标二抗(用含50 g/L脱脂奶粉的PBST稀释),每孔100 μL,37 ℃ 1 h后,同样方法洗板、拍干;每孔加入100 μL的TMB,避光孵育15 min;每孔加入3 mol/L的浓硫酸50 μL终止反应后,用酶标仪测定每孔的OD450值。
1.7.2 抗原、血清和酶标二抗最佳稀释度的确定 用纯化后的Hexon蛋白、血清以及酶标二抗进行正交试验,将抗原(Hexon蛋白)分别稀释至质量浓度为2.5、5.0和7.5 mg/L,每孔100 μL包被至ELISA板中;阴阳性血清样品以1∶50、1∶100、1∶200和1∶400倍稀释;酶标二抗以1∶2 500、1∶5 000和1∶10 000倍稀释;每孔设置2个重复取平均值,同时设立阴阳性和空白对照。进行ELISA检测,测定各孔OD450值后进行数据分析。取阳性样品OD450值(P值)约为1.0,阴性样品OD450值(N值)在0.1左右,并且P/N值最大时,为最佳抗原包被量及血清和二抗稀释度。
1.7.3 作用时间的优化 以抗原、血清和酶标二抗最佳作用浓度为基础,优化抗原的最佳封闭时间(37 ℃,1、1.5、2 h)、血清反应时间(37 ℃,0.5、1、1.5 h)、酶标二抗最佳孵育时间(37 ℃,0.5 、1、1.5 h)以及最佳显色时间(37 ℃,10、20、30 min)等条件,取阳性样品OD450值(P值)约为1.0,阴性样品OD450值(N值)在0.1左右,并且P/N值最大时,为最佳作用时间。
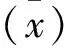
1.7.5 特异性试验 取鸡新城疫、禽流感、沙门菌、金黄色葡萄球菌、多杀性巴氏杆菌和大肠埃希菌阳性血清样品进行检测,统计分析结果。
1.7.6 敏感性试验 将FAV Ⅰ阳性血清以1∶50、1∶100、1∶200、1∶400、1∶800、1∶1 200、1∶1 600倍稀释,用建立的ELISA方法检测。在最优条件下,用建立的间接ELISA对70份FAVⅠ阳性血清样品(经进口ELISA试剂盒检测为阳性)进行检测,统计分析阳性血清的检出率。
1.7.7 重复性试验 取FAVⅠ阳性血清和阴性血清各3份,在同一条件下,用已建立的最佳间接ELISA检测方法进行检测,每份血清设置4个重复,根据每孔的OD450值,分析其批次内的可重复性。用3个批次纯化复性的Hexon蛋白包被酶标板检测1份阳性血清,根据每孔的OD450值,分析批次间的可重复性。
1.7.8 临床样品检测 用已建立的检测方法检测陕西省4个地区规模化养鸡场的279份鸡血清样品,评价该ELISA检测方法的检测效果。
2 结果与分析
2.1 PCR扩增和重组质粒双酶切鉴定
PCR扩增得到1 017 bp的目的基因Hexon。将Hexon基因连接至pET-28a(+),重组质粒pET-Hexon进行双酶切,获得预期的片段(图1)。
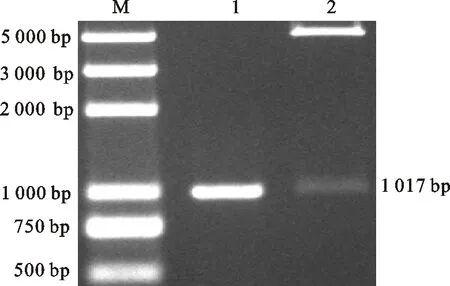
M. DM2000 plus DNA marker;1.Hexon基因扩增产物 Production ofHexongene;;2. pET-Hexon双酶切分析 Restriction enzyme analysis of recombanant r plasmid pET-Hexon
图1重组质粒酶切鉴定
Fig.1Restrictionanalysisofrecombinantplasmid
2.2 重组蛋白的原核表达与纯化
原核表达诱导剂IPTG浓度优化结果显示,当IPTG终浓度为0.25~1.0 mmol/L时,重组蛋白Hexon表达量一致,选择诱导剂IPTG浓度为0.25~1.0 mmol/L均可;全部采用终浓度为0.5 mmol/L的IPTG诱导5 h,重组蛋白Hexon可大量表达,而pET-Hexon未诱导,对照没有重组蛋白的表达。在最佳诱导条件下,分别取菌体超声裂解上清、菌体超声裂解沉淀进行SDS-PAGE,结果显示Hexon重组蛋白主要以包涵体形式存在。包涵体蛋白经ProteinIso Ni-NTA Resin纯化并复性后均获得37.4 ku大小的Hexon重组蛋白(图2)。

M. 蛋白marker Protein marker;1. 未诱导pET-Hexon Uninduced BL21 (DE3) containing pET-Hexon;2. 诱导5 h的pET-Hexon BL21 (DE3) containing pET-Hexon induced for 5 h;3.pET-Hexon菌体裂解上清 Supernate of the lysed recombinantEcoliBL21 (DE3) of pET-Hexon ;4.pET-Hexon菌体裂解沉淀 Precipiate of the lysed recombinantEcoliBL21 (DE3) of pET-Hexon;5. 纯化的Hexon重组蛋白 Purification of Hexon fusion protein
图2Hexon重组蛋白SDS-PAGE分析
Fig.2SDS-PAGEanalysisofofHexonfusionprotein
2.3 重组蛋白的Westernblot分析
Westernblot结果表明,Hexon重组蛋白能与FAVⅠ阳性血清发生特异性反应,出现大小为37.4 ku的条带,而与SPF鸡血清无特异性条带出现,无特异性反应(图3)。
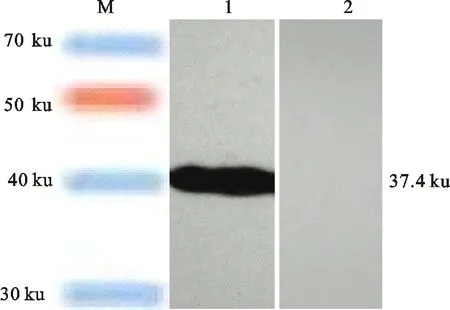
M. 预染蛋白 Marker Blue plus Ⅱ protein marker;1. FAVⅠ阳性血清 FAVⅠpositive chicken sera;2. SPF鸡血清 SPF chicken sera
图3Hexon重组蛋白的Westernblot分析
Fig.3WesternblotanalysisofHexonfusionprotein
2.4 间接ELISA检测方法的建立
2.4.1 抗原包被量及血清和酶标二抗最佳稀释度的确定 多次正交试验结果显示,当抗原Hexon重组蛋白的质量浓度为5.0 mg/L,血清稀释度为1∶ 200,酶标二抗的稀释度为1∶5 000时为最佳条件(表1)。

表1 抗原包被量、血清和酶标二抗工作浓度的确定
注:A代表抗原的质量浓度为2.50 mg/L,B代表抗原的质量浓度为5.0 mg/L,C代表抗原的质量浓度为7.50 mg/L。
Notes: A.mass concentrations of antigen is 2.50 mg/L;B.mass concentrations of antigen is 5.0 mg/L; C.mass concentrations of antigen is 7.50 mg/L.
2.4.2 作用时间的优化 当抗原质量浓度为5.0 mg/L,包被量为每孔100 μL,封闭条件为37 ℃作用1 h,血清以1∶200倍稀释37 ℃作用1 h,酶标二抗以1∶5 000倍稀释37 ℃作用1 h,每孔100 μL的TMB 37 ℃孵育10 min时效果最佳。
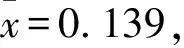
2.4.4 特异性试验 用建立的间接ELISA检测鸡新城疫、禽流感、沙门菌、金黄色葡萄球菌、多杀性巴氏杆菌和大肠埃希菌阳性血清样品进行检测,结果OD450值均小于0.3,为阴性,阴、阳性对照成立,表明检测方法特异性良好(表2)。
2.4.5 敏感性试验 将FAV Ⅰ阳性血清以1∶50、1∶100、1∶200、1∶400、1∶800、1∶1 200、1∶1 600 稀释,用建立的ELISA方法检测,结果当阳性血清以1∶50、1∶100、1∶200、1∶400、1∶800、1∶1 200稀释时,结果为阳性,当阳性血清以1∶1 600稀释时,结果为阴性(表3);并且用建立的间接ELISA对70份FAVⅠ阳性血清样品(经进口ELISA试剂盒检测为阳性)进行检测,有2份未检出,检出阳性率为97.1%,表明所建立的检测方法敏感性良好。

表2 特异性试验

表3 敏感性试验结果
2.4.6 重复性试验 在建立的最优条件下,检测3份阳性血清和3份阴性血清的OD450值,结果表明,OD450值批内变异系数为1.2%~3.5%;分别用3批次纯化复性的Hexon蛋白检测1份阳性血清和1份阴性血清,结果表明,OD450值批间变异系数为5.1%~8.3%。批内变异系数和批间变异系数都较小,表明建立的检测方法具有良好的重复性。
2.4.7 临床样品检测 对采自不同地区规模化养鸡场的279份鸡血清样品进行Hexon蛋白抗体水平的检测。结果表明,143份血清为阳性,阳性率为51.3%(表4)。

表4 陕西省4个地区鸡血清Hexon抗体水平检测
3 讨 论
近年来,由FAVⅠ引起的包涵体肝炎、心包积液综合征和砂囊糜烂的感染呈上升趋势[11-12]。特别是2015年6月以来,中国多数省份的鸡群爆发安卡拉病,发病率和病死率高,给禽鸡类养殖造成严重危害[5,13]。因此建立灵敏度高、特异性强且能快速、安全、有效的检测鸡腺病毒血清抗体的ELISA检测方法至关重要。
本试验针对FAVⅠ的Hexon基因进行分析,选取Hexon蛋白主要抗原区的序列,构建原核表达质粒pET-Hexon,转化大肠埃希菌BL21(DE3)后,对其进行大量的诱导表达,经表达形式分析,该蛋白主要以包涵体形式存在。将纯化复性后的重组Hexon蛋白作为包被抗原,抗原质量浓度为5.0 mg/L,包被量为每孔100 μL,血清最佳稀释度为1∶200,二抗最佳稀释度为1∶5 000,建立间接ELISA抗体水平检测试验。试验结果显示,该检测方法具有较强的特异性,不能与鸡新城疫、禽流感、沙门菌、金黄色葡萄球菌、多杀性巴氏杆菌和大肠埃希菌阳性血清发生反应;批间和批内重复性试验结果可以看出,其变异系数小,重复性好;敏感性试验结果显示,该试验敏感性强;并且本试验方法操作简单快速,成本低,适合大量样品检测。对采自不同地区规模化养鸡场的279份鸡血清样品进行Hexon蛋白抗体水平的检测,检测结果显示143份血清为阳性,阳性率为51.3%。在以后的临床检测应用中,可以对腺病毒疫苗免疫鸡群的免疫效果进行检测评估,也可以应用该方法对未免疫鸡群的感染情况进行调查。
在现在的养殖生产中“以防为主,防重于治”是防控疾病的基本原则,疫苗的免疫极为重要。因此,间接ELISA检测方法的建立为开展腺病毒疫苗免疫效果评估及未免疫鸡群疾病诊断提供技术支持,促进鸡包涵体肝炎和安卡拉等相关鸡病的有效防治。
参考文献Reference:
[1] 罗思思,谢芝勋,刘加波,等.Ⅰ群禽腺病毒抗体间接hexon-ELISA检测方法的建立[J].中国兽医科学,2012(7):701-707.
LUO S S,XIE ZH X,LIU J B,etal.Establishment of an indirect hexon-elisa for the detection of antibodies against fowl adenovirus groupⅠ[J].ChineseVeterinaryScience,2012(7):701-707.
[2] MITTAL D,JINDAL N,TIWARI A K,etal.Characterization of fowl adenoviruses associated with hydropericardium syndrome and inclusion body hepatitis in broiler chickens[J].VirusDisease,2014,25(1):114-119.
[3] 罗思思,谢芝勋,刘加波,等.Ⅰ群禽腺病毒Hexon蛋白的截短表达与鉴定[J].基因组学与应用生物学,2011,30(5):550-555.
LUO S S,XIE ZH X,LIU J B,etal.Expression and identification of the truncated hexon protein of fowl adenovirus group Ⅰ[J].Genomics&AppliedBiology,2011,30(5):550-555.
[4] CHOI K S,KYE S J,KIM J Y,etal.Epidemiological investigation of outbreaks of fowl adenovirus infection in commercial chickens in Korea[J].PoultryScience,2012,91(10):2502-2506.
[5] LI H,WANG J,QIU L,etal.Fowl adenovirus species C serotype 4 is attributed to the emergence of hepatitis-hydropericardium syndrome in chickens in China[J].InfectionGenetics&Evolution,2016,45:230-241.
[6] 罗 玲,赵 康,张 媛,等.鸡心包积水综合征病原的分离与鉴定[J].中国家禽,2016,38(6):56-58.
LUO L,ZHAO K,ZHANG Y,etal.Isolation and identificationof a fowl adenovirus serotype 4 strain from chickens with hydropericardium syndrome[J].ChinaPoultry,2016,38(6):56-58.
[7] 李昕键,吴 彻,雷小亚,等.鸡心包积液综合征病原的分离鉴定与进化分析[J].动物医学进展,2017(2):27-31.
LI X J,WU CH,LEI X Y,etal.Isolation,identification and evolution analysis of a fowl adenovirus serotype 4 strain from chickens with hydropericardium syndrome[J].ProgressinVeterinaryMedicine,2017(2):27-31.
[8] 唐 熠,谢芝勋,熊文婕,等.Ⅰ群禽腺病毒环介导等温扩增检测方法的建立[J].中国兽医科学,2010(7):713-716.
TANG Y,XIE ZH X,XIONG W J,etal.Development of a loop-mediated isothermal amplification assay for detection[J].ChineseVeterinaryScience,2010(7):713-716.
[9] 唐 熠,谢芝勋,熊文婕,等.PCR-RFLP技术对Ⅰ群禽腺病毒12个血清型毒株的分型鉴定[J].中国兽医科学,2009(10):886-889.
TANG Y,XIE ZH X,XIONG W J,etal.Identification of 12 serotypes of aviadenovirus group Ⅰ by PCR-RFLP assay.[J].ChineseVeterinaryScience,2009(10):886-889.
[10] 韦 悠,谢芝勋,刘加波,等.禽腺病毒Ⅰ型抗体间接ELISA检测方法的建立[J].畜牧与兽医,2011,43(10):50-53.
WEI Y,XIE ZH X,LIU J B,etal.Establishment of indirect ELISA for detection of antibodies of fowl adenovirus group Ⅰ[J].AnimalHusbandry&VeterinaryMedicine,2011,43(10):50-53.
[11] 刘 东,刘红祥,于 静,等.Ⅰ亚群腺病毒在我国鸡群的流行病学调查[J].中国家禽,2015,37(15):70-73.
LIU D,LIU H X,YU J,etal.Epidemiological study of fowl adenovirus group Ⅰ in China[J].ChinaPoultry,2015,37(15):70-73.
[12] 罗思思,谢芝勋,刘加波,等.Ⅰ群禽腺病毒100K蛋白主要抗原区基因片段的表达及鉴定[J].西北农业学报,2012,21(5):22-25.
LUO S S,XIE ZH X,LIU J B,etal.Expression and identification of the major antigenic region fragment of 100K gene of fowl adenovirus group Ⅰ[J].ActaAgriculturaeBoreali-OccidentalisSinica,2012,21(5):22-25.
[13] ZHANG T,JIN Q,DING P,etal.Molecular epidemiology of hydropericardium syndrome outbreak-associated serotype 4 fowl adenovirus isolates in central China[J].VirologyJournal,2016(13):188.

