松墨天牛幼虫肠道纤维素降解细菌的分离与鉴定
胡 霞, 傅慧静, 李俊楠, 林中平, 张飞萍
(1.福建农林大学林学院,福建 福州 350002;2.福州市林业局,福建 福州 350000)
纤维素是林木蛀干害虫食物中的主要营养成分,在害虫完成其正常生长发育过程中起着重要作用[1].大量研究表明,蛀干害虫肠道内生长着许多微生物,其数量甚至远远超过昆虫自身细胞的总数[2].这些微生物可以分泌纤维素降解酶,从而在昆虫自身消化系统和体内共生微生物的协同作用下,完成对木质纤维素的高效降解、消化、吸收和利用[3].因此,蛀干害虫肠道微生物是其完成生活史不可或缺的协同因素.
目前已知的蛀干害虫肠道微生物主要包括细菌、真菌和原生动物,其中真菌、细菌被认为是木质纤维素类物质的主要降解者.在以往的研究中,国内外学者大多关注形态较大,能够胞外分泌酶的木质纤维素降解真菌,如瑞氏木霉(Trichodermareesei)等[4].但是,目前发现的纤维素降解真菌大多为好氧菌,它们一般不适宜在昆虫肠道的缺氧型环境中生长[5].具有厌氧或兼性厌氧特点的纤维素降解细菌,则能够在昆虫肠道内维持较高的种群丰度,其种类和数量要远远超过真菌[6].Cazemier et al在1头太阳甲虫(Pachnodamarginata)成虫肠道内,就发现了数量多达2.5±1.1×108的纤维素降解细菌,而Delalibera et al在楔天牛(Saperdavestita)肠道也发现了多达0.24~3.57×106的纤维素降解细菌[7,8].由此可见,细菌是蛀干害虫肠道中降解木质纤维素的重要成员.
松墨天牛(MonochamusalternatusHope)是松树的主要蛀干害虫,除能直接钻蛀危害造成松树衰弱甚至死亡外,还是松材线虫病的病原物松材线虫(BursaphelenchusxylophilusNickle)的传播媒介[9].松材线虫病作为世界上最危险的森林病害,自1982年传入中国以来,已造成15个省份,100多万hm2的松林枯死,经济损失超过200亿美元[10].长期以来,控制松墨天牛,切断松材线虫病传播途径,是我国防控松材线虫病最重要和最有效的措施之一.与其它蛀干类害虫相同,在松墨天牛整个生长发育周期,尤其是幼虫时期,木质纤维是其最主要的营养来源[11],肠道细菌在天牛幼虫降解木质纤维,帮助消化这类大分子物质中可能发挥了重要作用.目前有关微生物降解纤维素的研究已较为深入,然而有关松墨天牛肠道细菌的纤维素降解研究鲜见报道.本研究通过可培养的方法筛选松墨天牛幼虫肠道木质纤维素降解细菌,并测定其纤维素酶活性,从而为解析松墨天牛幼虫肠道木质纤维素降解细菌的群落结构及功能奠定基础,也为进一步揭示肠道细菌与松墨天牛的互作关系提供理论依据.
1 材料与方法
1.1 供试昆虫
马尾松虫害木采集于福建省连江琯头镇(N 26°150′;E 119°593′),将虫害木锯成长约1 m的木段,置于1.5 m3的养虫笼内,养虫笼用网径小于2 mm的铁砂网密封.采用剥开马尾松树皮,劈开木段的办法收集松墨天牛幼虫以备实验需要.
1.2 试验方法
(1)昆虫的预处理:将收集的松墨天牛幼虫立即置于湿润的无菌环境中,饥饿处理48 h,以排空松墨天牛肠道食物残渣.选取9头健康的松墨天牛幼虫,用75%的酒精浸泡3 min,然后用无菌水漂洗3遍,继而在体式显微镜下进行肠道解剖,将获得的幼虫中后肠部分转移至含有0.01 mL磷酸盐缓冲液(PBS:138 mM NaCl,2.7 mM KCl,pH 7.4)的1.5 mL离心管中.
(2)培养基的配制:参照Delalibera et al[8]的方法,1号液体培养基(滤纸培养基)内含有5 g·L-1滤纸条(Whatman),40 mg·L-1胰蛋白粉(Becton Dickinson, Sparks, MD),100 mg·L-1麦芽粉(Becton Dickinson)和2 g·L-1CaCO3,pH值为7.0;2号液体培养基(CMC培养基)内含有5 g·L-1羧甲基纤维素钠(CMC, low viscosity; Sigma, St. Louis, MO),30 mg·L-1酵母浸提物,100 mg·L-1麦芽粉和2 g·L-1CaCO3,pH值为7.0;3号液体培养基内含有5 g·L-1磷酸化微晶纤维素(PH105),1.9 g·L-1K2HPO3,0.94 g·L-1KH2PO3,1.68 g·L-1NaHCO3,1.6 g·L-1KCl,1.43 g·L-1NaCl,0.15 g·L-1NH4Cl,0.037 g·L-17H2O·MgSO4,0.017 g·L-1CaCl2·2H2O和0.1 g·L-1yeast extract,pH值为7.0;4号固体培养基内含有5 g·L-1羧甲基纤维素钠,0.2 g·L-1酵母浸提物和12 g·L-1琼脂,pH值为7.0[6].
(3)纤维素降解菌的计数与分离:参照Delalibera的方法,并进行了适当调整[8].取3只含1 mL PBS的离心管,分别装入1条松墨天牛幼虫肠道,用塑料研磨棒研磨10~20次.然后在4 ℃下以4 000 r·min-1的转速离心10 s,将肠道微生物从肠道组织分离,作为松墨天牛幼虫肠道细菌的原始菌液.为方便菌落计数,依次将原始菌液稀释至10-9,并分别取各个稀释梯度菌液100 mL涂布于4号培养基平板上,然后配合刚果红染色法记录纤维素降解菌数;为方便分离纯化纤维素降解菌株,将0.1 mL原始菌液转转移至含15 mL以滤纸作为唯一碳源的1号液体培养基或15 mL以CMC作为唯一碳源的2号液体培养基的50 mL三角瓶中,在避光条件下190 r·min-1,28 ℃有氧培养直至观察到1号培养基中滤纸出现被降解现象.为了确定微生物的微晶纤维素降解活性,将经过1号和2号培养基培养筛选获得的细菌接种至仅以微晶纤维素作为碳源的3号液体培养基中,在避光处理下190 r·min-1,28 ℃有氧培养7 d.最后将菌液梯度稀释至10-9,各梯度菌液取0.1 mL涂平板于4号固体培养基,用于菌落计数及分离松墨天牛幼虫肠道纤维素降解细菌菌株.该部分所有试验均设置3次重复.
(4)纤维素酶活性测定:分别在形成菌落的4号固体培养基中加入1 g·L-1刚果红染液染色30 min,倒出后加入1 mol·L-1NaCl溶液浸洗30 min,倒掉浸洗液后可观察到菌落周围形成透明圈,然后通过测量透明圈直径与菌落直径的比值判断该菌落的CMC相对降解活性[12].
(5)形态鉴定及生理特征测定:通过平板培养后,在光学显微镜下观察并记录单菌落的颜色,形状及质地等特征,细菌细胞形态的鉴定参照《伯杰氏细菌鉴定手册》的方法,鉴定细菌的菌落颜色、菌体形状、大小、革兰氏阴性阳性区分、有无鞭毛、有无菌膜以及该菌株代表的细菌菌落个数等[13].
(6)分子鉴定:根据细菌DNA提取试剂盒(Omega,美国)说明分别提取各细菌总DNA,继而使用细菌通用引物fD1和rP1扩增细菌16S rDNA,具体办法参见Hu et al[14].将测序数据16S rDNA序列上传至Genbank(http://www.ncbi.nlm.nih/gov/blast/),本研究松墨天牛幼虫肠道具有纤维素降解活性的细菌菌株16S rDNA序列基因登陆号为:KX461909-KX461918.为进一步确定各松墨天牛肠道纤维素降解细菌的分类地位,首先将所有序列与RDPⅡ数据库序列匹配[15],然后通过BLAST在EzTaxon-e数据库和NCBI数据库中与已知16S rDNA序列比对[16],下载相似度高且可靠序列用于聚类分析.将测序获得的所有序列和Genbank下载的可靠相似序列通过MEGA 6.0中的MUSCLE进行匹配,计算最佳模型,构建Neighbor-joining系统发育树[17,18],为计算每个分支的支持率,设置自展分析为1000个重复.
1.3 数据分析方法
差异显著性分析均采用F检验(SPSS,Version 22).
2 结果与分析
2.1 松墨天牛幼虫纤维素降解细菌菌落计数
以羧甲基纤维素钠(CMC)作为唯一碳源,结合刚果红染色法筛选的松墨天牛幼虫消化道纤维素降解菌,通过稀释涂平板法的菌落计数结果为每头(5.2±0.38)×106CFU·mL-1.该结果与椴六点楔天牛(Saperdavestita)肠道纤维素降解细菌的菌落计数结果类似[(0.24~3.57)×106CFU·mL-1],高于瑞肇大小蠹(Dendroctonurhizophagus)肠道纤维素降解菌的菌落计数结果[(2.3±0.43)×103CFU·mL-1][8],明显少于太阳甲虫(Pachnodamarginata)成虫肠道纤维素降解细菌的菌落计数结果[(2.5±1.1)×108CFU·mL-1][7].
2.2 CMC酶活细菌菌株分离与鉴定
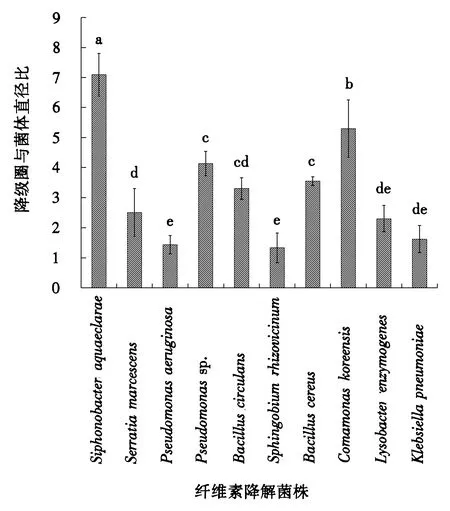
不具有相同字母则表明彼此差异显著.图1 松墨天牛肠道细菌降解纤维素产生的透明圈与菌落的直径比率Fig.1 The ratio of the CMC clearance zone diameter to the colony diameter of cellulolytic bacteria associated the gut of Monochamus alternatus
从松墨天牛幼虫中后肠肠道中分离出154株具纤维素酶活性的细菌,其中65株为滤纸培养基(1号培养基)所得,89株从CMC培养基(2号培养基)中得到.这些菌株均能降解微晶纤维素,且经刚果红染色显示不同大小的透明圈,其透明圈直径与菌落的直径比的平均值1.33~7.09(图1).降解能力最强菌落降解透明圈直径比与其它菌株均呈显著差异(F=33.409,P<0.05).
对筛选获得的154株具有木质纤维素降解能力的细菌进行形态鉴定,结合代表菌株的分子鉴定结果表明这154株细菌分别隶属于变形菌门、厚壁菌门和拟杆菌门细菌的8个菌属、10个菌种(表1)(图2).其中菌株HX-1具有最强的木质纤维素降解能力,其纤维素降解透明圈与细菌菌落直径比为7.09.细菌鉴定结果表明菌株HX-1隶属于拟杆菌门(Bacteroidetes),纤维粘网菌纲(Cytophagia),噬纤维菌目(Cytophagales),噬纤维细菌科(Cytophagaceae),Siphonobacter菌属,Siphonobacteraquaeclarae菌种.菌株HX-8也具有较强的木质纤维素降解能力,其透明圈与菌落直径比为5.30,经鉴定其为丛毛单孢菌(Comamonaskoreensis).菌株HX-4经鉴定为假单胞菌(Pseudomonassp.),其纤维素降解透明圈与细菌菌落直径比为4.13.菌株HX-7和菌株HX-5纤维素降解透明圈与细菌菌落直径比近似,分别为3.55和3.30,经鉴定二者分别为蜡样芽孢杆菌(Bacilluscereus)和环状芽孢杆菌(Bacilluscirculans).菌株3纤维素降解透明圈与细菌菌落直径比为2.51,经鉴定其为粘质沙雷氏菌(Serratiamarcescens).菌株HX-9为黄色单胞菌(Lysobacterenzymogenes),其纤维素降解透明圈与细菌菌落直径比为2.30.菌株HX-10、菌株HX-2和菌株HX-6纤维素降解透明圈与细菌菌落直径比都较小,分别为1.62、1.43和1.33,经鉴定其分别为克雷伯氏杆菌(Klebsiellapneumoniae)、铜绿假单胞菌(Pseudomonasaeruginosa)和鞘脂菌(Sphingobiumrhizovicinum).

表1 松墨天牛肠道纤维素降解细菌的形态鉴定及菌落计数1)Table 1 Characteristics of cellulose-degrading microorganisms separated from guts of Monochamus alternatus
1)+表示有;-表示无;ND表示未观察到.
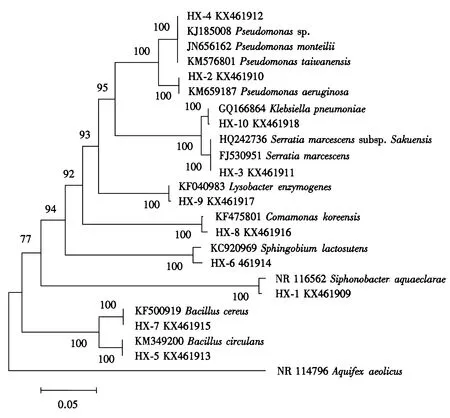
图2 松墨天牛肠道纤维素降解细菌16S rRNA系统发育树Fig.2 Neighbor-joining phylogenetic tree of 16S rRNA gene fragments of Monochamus alternatus gut cellulolytic bacteria
对筛选培养的154株具有木质纤维素降解能力的细菌进行菌落计数分析,结果表明,松墨天牛幼虫肠道纤维素降解细菌群落由46.8%的γ变形菌(γ-Proteobacteria)、31.8%的拟杆菌(Bacteroidetes)、14.3%的厚壁菌(Firmicutes)、3.3%的β变形菌(β-Proteobacteria)和3.9%的α变形菌(α-Proteobacteria)组成(图3).从菌属水平分析,有49株细菌被鉴定为噬纤维菌(Siphonobacter),占肠道纤维素降解细菌群落的31.8%,为松墨天牛幼虫肠道纤维素降解优势菌;31株沙雷菌(Serratia)占肠道纤维素降解细菌群落的20.1%,24株假单胞菌属细菌(Pseudomonas)和22株芽孢杆菌属细菌(Bacillus)分别占肠道纤维素降解细菌群落的15.6%和14.3%;而另外4个菌属在松墨天牛幼虫肠道纤维素降解细菌群落中的比例相对较小,其中克雷伯氏杆菌(Klebsiella)占9.7%,鞘脂菌(Sphingobium)占3.9%,丛毛单孢菌(Comamonas)占3.3%,黄色单胞菌(Lysobacter)占1.3%.
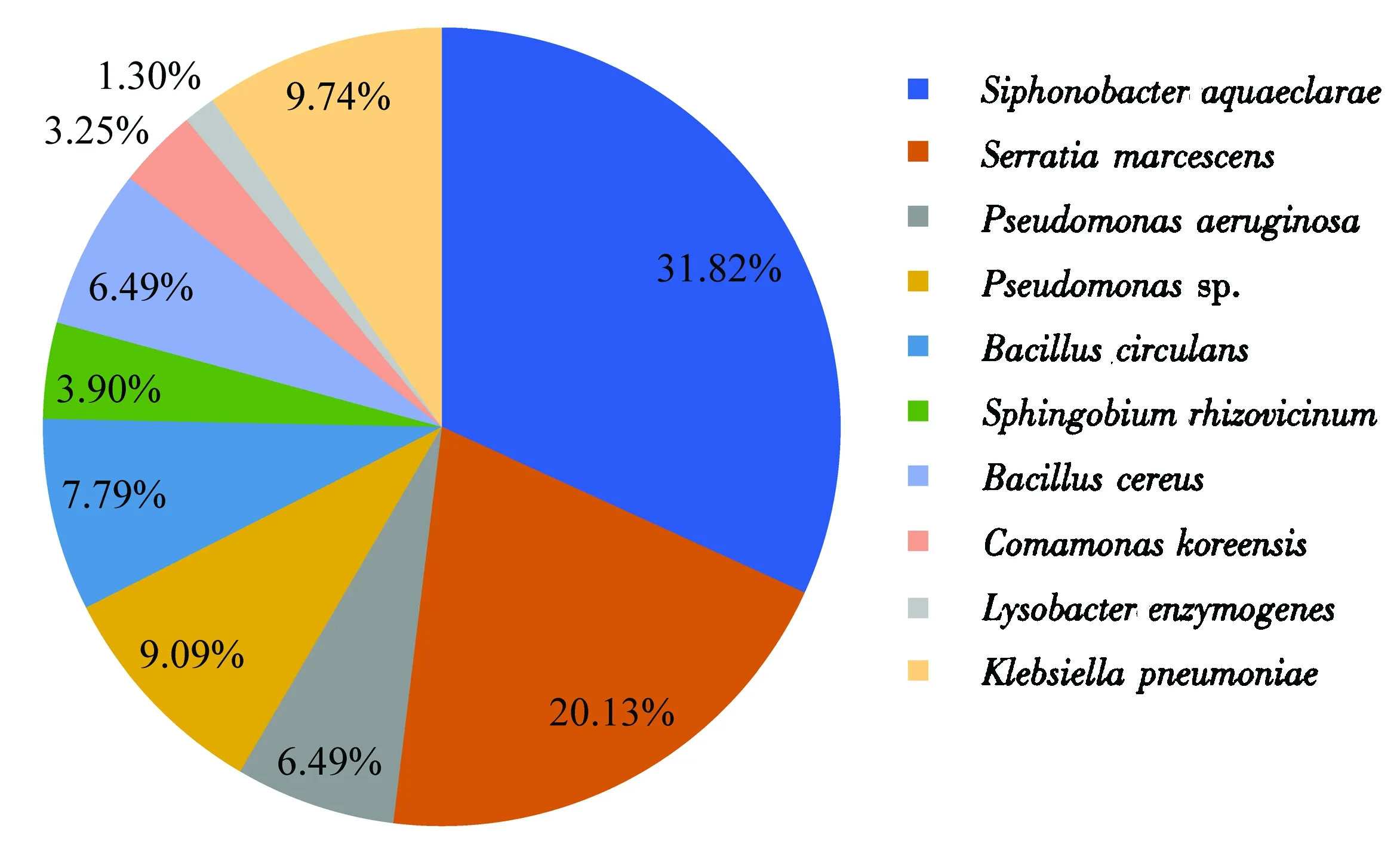
图3 松墨天牛肠道纤维素降解细菌的菌落计数百分比(n=154)Fig.3 The percent of cellulolytic bacteria derived from Monochamus alternatus
3 讨论
本研究采用可培养的方法从松墨天牛幼虫肠道中获得154株纤维素降解细菌,分别隶属于变形菌门、厚壁菌门和拟杆菌门细菌的8个菌属、10个菌种.相对于其它鞘翅目昆虫而言,松墨天牛幼虫肠道纤维素降解菌菌落密度较高,但菌群落结构组成相对简单,这可能与部分细菌不能被纯培养获得有关[7,14].肠道纤维素降解细菌在蛀干类害虫高效降解、消化、吸收和利用木质纤维素的过程中起到非常重要的作用,对天牛类蛀干害虫幼虫肠道纤维素降解细菌的研究已是害虫生物防治的热点.曹月青等从桑粒肩天牛(Aprionagermari)幼虫中肠分离获得一种兼性厌氧纤维素分解菌[19];Delalibera et al在椴六点楔天牛(Saperdavestita)幼虫肠道中也得到了分解纤维素细菌菌群,但这些细菌仅能分解羧甲基纤维素钠,不具有滤纸降解活性[8];苏丽娟等从桃红颈天牛(Aromiabungii)幼虫肠道中筛选的一株枯草芽孢杆菌能高效降解纤维素[20];周峻沛从云斑天牛(Batocerahorsfieldi)幼虫肠道细菌群落中也发现了大量具有纤维素酶活的细菌菌群,并认为纤维素降解细菌对云斑天牛的幼虫生长发育和抵御寄主营养匮乏具有重要的作用[21].
本研究筛选获得的噬纤维菌(Siphonobacteraquaeclarae)纤维素降解能力最强,且在松墨天牛幼虫肠道中表现为优势菌,占肠道纤维素降解细菌群落的31.8%.Wilson和David在S.aquaeclarae所隶属的噬纤维菌科细菌中发现存在第三种纤维素降解机制:其既不分泌游离的纤维素酶,也没有纤维小体结构,而是通过菌体表面分泌纤维素酶并吸附结晶纤维素,增大接触面积来实现高效降解[22].基于噬纤维菌科细菌强大的纤维素降解能力和独特的纤维素降解机制,国内外学者先后对该科哈氏噬纤维菌Cytophagahutchinsonii,古字状菌Runellaslithyformis,蟑螂杆状体Leadbetterellabyssophila,螺状菌Spirosomalinguale,Dyadobacterfermentans展开研究,结果发现这类细菌的纤维素降解酶活力与细胞相关联,它们对纤维素的降解可能是细胞表面纤维素酶以及部分非酶蛋白的协同作用来完成的[23].基于其独特的纤维素降解机制,松墨天牛肠道内木质纤维丰富的微环境,恰好为S.aquaeclarae的大量富集提供可能.另外,噬纤维菌科细菌常常具有高效的纤维素降解能力,这一特性对于以纤维素为主要营养源的昆虫来说非常重要.松墨天牛幼虫以马尾松韧皮部和木质部为食物来源,通过松墨天牛的咀嚼和肠道自身分泌的消化酶液等并不能很好地吸收纤维素大分子物质,满足其营养需求,因此,高丰度的具有纤维素降解活性的S.aquaeclarae为松墨天牛幼虫的营养代谢及生长发育提供了必要条件.这也可能是S.aquaeclarae在松墨天牛幼虫肠道占据种群丰度优势的一个重要原因.在以往对昆虫肠道微生物的研究中,仅在地下害虫暗黑鳃金龟幼虫肠道中有发现S.aquaeclarae,而对其在暗黑鳃金龟幼虫该肠道中的功能尚不清晰[24].在松墨天牛肠道中发现S.aquaeclarae尚属蛀干类害虫中的第一例,该菌极有可能是蛀干害虫肠道木质纤维降解细菌的一个新成员.但是,针对该科Siphonobacter属细菌的木质纤维素降解功能和机制还未见报道,作为蛀干害虫肠道木质纤维降解细菌的一个新成员,噬纤维细菌S.aquaeclarae也可能在纤维素酶系组成、酶学特性、功能基因和代谢通路上存在特异性,以适应松墨天牛肠道独特的微生态环境,S.aquaeclarae在松墨天牛肠道的木质纤维素降解功能和作用机制还有待于进一步研究.
沙雷菌(Serratia)在松墨天牛幼虫肠道纤维素降解细菌群落中的比例相对较高,占20.1%,为优势菌属.沙雷菌为革兰氏阴性菌,广泛分布于世界各地,能够在水,土壤和各种动物肠道等复杂环境中存活[25].何正波等从桑粒肩天牛幼虫肠道中也分离出了具有纤维素降解活性的沙雷氏菌属(Serratia)、芽孢杆菌属(Bacillus)和克雷伯氏菌属(Klebsiella)细菌[26].目前研究发现沙雷菌具有分泌纤维素酶等多种胞外酶的能力[27],这表明沙雷菌普遍存在于松墨天牛等木食性昆虫肠道中,并与宿主的纤维素降解功能息息相关.沙雷菌还具有的稳定性强和快速适应环境的能力,这可能也是沙雷菌在松墨天牛幼虫肠道纤维素降解细菌群落中占据种群丰度优势的一个重要原因[25].变形菌纲肠杆菌科假单胞菌(Pseudomonas)是松墨天牛幼虫肠道降解纤维素细菌群落中的第三大类群.Huang等在鞘翅目暗黑鳃金龟(Holotrichiaparallela)幼虫肠道中也发现假单胞菌(Pseudomonas)为优势细菌菌群[24].假单胞菌广泛分布于植物组织、动物组织、水和土壤中,也是动植物的病原菌,但同时许多假单胞菌也具有纤维素降解活性[28-30].
本研究通过单碳源培养基筛选培养、形态及分子鉴定和相对纤维素降解活性测定方法,明确了松墨天牛肠道纤维素降解细菌的群落多样性及部分功能,但肠道细菌纤维素降解机制还有待进一步研究.本研究结果不仅有助于丰富昆虫肠道微生物研究素材,还有助于深入理解松墨天牛的营养代谢和生境适应性,并为进一步揭示肠道细菌与松墨天牛的互作关系提供理论依据.
[1] PETERSON B F, STEWART H L, SCHARF M E. Quantification of symbiotic contributions to lower termite lignocellulose digestion using antimicrobial treatments[J]. Insect Biochemistry and Molecular Biology, 2015,59(1):80-88.
[2] SIX D L. The bark beetle holobiont: why microbes matter[J]. Journal of Chemical Ecology, 2013,39(7):989-1 002.
[3] 宁娜,张倪,吴燕,等.台湾乳白蚁和黄翅大白蚁消化道主要木质纤维素降解酶活性比较[J].应用与环境生物学报,2015,21(4):678-682.
[4] 宋贤冲,唐健,邓小军,等.产纤维素酶真菌的分离筛选,鉴定及其酶学性质分析[J].基因组学与应用生物学,2013,32(3):372-378.
[5] HU X, WANG C, WANG L, et al. Influence of temperature, pH and metal ions on guaiacol oxidation of purified laccase fromLeptographiumqinlingensis[J]. World Journal of Microbiology and Biotechnology, 2014,30(4):1 285-1 290.
[6] ENGEL P, MORAN N A. The gut microbiota of insects-diversity in structure and function[J]. FEMS Microbiology Reviews, 2013,37(5):699-735.
[7] CAZEMIER A E, VERDOES J C, REUBSAET F A G, et al.Promicromonosporapachnodae, sp. nov. a member of the (hemi) cellulolytic hindgut flora of larvae of the scarab beetlePachnodamarginata[J]. Antonie Van Leeuwenhoek, 2003,83(2):135-148.
[8] DELALIBERA I, HANDELSMAN J, RAFFA K F. Contrasts in cellulolytic activities of gut microorganisms between the wood borer,Saperdavestita(Coleoptera: Cerambycidae), and the bark beetles,IpspiniandDendroctonusfrontalis(Coleoptera: Curculionidae)[J]. Environmental Entomology, 2005,34(3):541-547.
[9] 许峻荣,吴小芹,刘云,等.基于松材线虫全基因组序列的SSR标记开发[J].南京林业大学学报,2014,8(2):36-42.
[10] ZHAO L, MOTA M, VIEIRA P, et al. Interspecific communication between pinewood nematode, its insect vector, and associated microbes[J]. Trends in Parasitology, 2014,30(6):299-308.
[11] 罗淋淋,韦春梅,林同.松墨天牛分子生物学研究进展[J].中国森林病虫,2014,33(1):24-28.
[12] WEISBURG W G, BARNS S M, PELLETIER D A, et al. 16S ribosomal DNA amplification for phylogenetic study[J]. Journal of Bacteriology, 1991,173(2):697-703.
[13] PHILIPP G E, MURRAY R G E. Methods for General and Molecular Bacteriology[M]. Washington, DC:American Society for Microbiology, 1994.
[14] HU X, YU J, WANG C, et al. Cellulolytic bacteria associated with the gut ofDendroctonusarmandilarvae (Coleoptera: Curculionidae: Scolytinae)[J]. Forests, 2014,5(3):455-465.
[15] COLE J R, WANG Q, CARDENAS E, et al. The ribosomal database project: Improved alignments and new tools for rRNA analysis[J]. Nucleic Acids Research, 2009,37(1):141-145.
[16] SAYERS E W, BARRETT T, BENSON D A, et al. Database resources of the national center for biotechnology information[J]. Nucleic Acids Res, 2010:199-205.
[17] EDGAR R C. Muscle: Multiple sequence alignment with high accuracy and high throughput[J]. Nucleic Acids Research, 2004,32(5):1 792-1 797.
[18] TAMURA K, PETERSON D, PETERSON N, et al. MEGA5: Molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Molecular Biology and Evolution, 2011,28(10):2 731-2 739.
[19] 曹月青,殷幼平,董亚敏,等.桑粒肩天牛肠道纤维素分解细菌的分离和鉴定[J].微生物学通报,2001,28(1):9-11.
[20] 苏丽娟,高新浩,王石垒,等.桃红颈天牛肠道纤维素降解菌的筛选及其对肉仔鸡生产性能的影响[J].饲料工业,2015,36(7):38-43.
[21] 周峻沛.云斑天牛胃肠道内共生细菌来源的纤维素酶和半纤维素酶的初步研究[D].北京:中国农业科学院,2010.
[22] WILSON D B. Evidence for a novel mechanism of microbial cellulose degradation[J]. Cellulose, 2009,6(4):723-727.
[23] 季晓飞.纤维素降解及滑动相关基因的研究[D].济南:山东大学,2013.
[24] HUANG S W, SHENG P, ZHANG H Y. Isolation and identification of cellulolytic bacteria from the gut ofHolotrichiaparallelalarvae (Coleoptera: Scarabaeidae)[J]. International Journal of Molecular Sciences, 2012,13(3):2 563-2 577.
[25] PETERSEN L M, TISA L S. Friend or foe? A review of the mechanisms that driveSerratiatowards diverse lifestyles[J]. Revue Canadienne De Microbiologie, 2013,59(9):627-640.
[26] 何正波,殷幼平,曹月青,等.桑粒肩天牛幼虫肠道菌群的研究[J].微生物学报,2001,41(6):741-744.
[27] ANAND A A P, VENNISION S J, SANKAR S G, et al. Isolation and characterization of bacteria from the gut ofBombyxmorithat degrade cellulose, xylan, pectin and starch and their impact on digestion[J]. Journal of Insect Science, 2010,10(1):107-126.
[28] BRODEY C L. Bacterial blotch disease of the cultivated mushroom is caused by an ion channel forming lipodepsipeptide toxin[J]. Molecular Plant-Microbe Interact, 1991,4(4):407.
[29] PALLERONI N J. ThePseudomonasstory[J]. Environmental Microbiology, 2010,12(6):1 377-1 383.
[30] SINDHU S S, DADARWAL K R. Chitinolytic and cellulolyticPseudomonassp. Antagonistic to fungal pathogens enhances nodulation byMesorhizobiumsp. Cicer in chickpea[J]. Microbiological Research, 2000,156(4):353-358.

