植物单链DNA结合蛋白WHIRLY2研究进展
蔡 倩, 任育军, 黄晨星, 缪 颖
(福建农林大学生命科学学院分子细胞和系统生物学中心,福建 福州 350002)
1 WHIRLY蛋白简介
1.1 WHIRLY蛋白的发现和在植物中的分布
WHIRLY转录因子是2000年Desveaux et al[1-4]首先从马铃薯(Solanumtuberosum)中分离出来的,又名PBF-2(PR-10abinding factor 2),它可以与顺式应答元件ERE(elicitor response element)以单链形式结合激活病原响应基因PR10的表达从而调控病原菌诱导的信号传导途径.在随后的十几年中,随着越来越多的植物基因组被解析出来,WHIRLY蛋白也被证明在植物中具有广泛的分布,是植物中非常保守和特异的一类转录因子小家族[5].目前已经在大约163种测序的植物中发现WHIRLY蛋白的存在[6].有趣的是,在单子叶植物中通常存在2个不同基因编码的不同类型的WHIRLY蛋白(WHIRLY1和WHIRLY2),而在双子叶植物如芸薹属植物中通常存在3个基因编码的不同类型的WHIRLY蛋白(WHIRLY1、WHIRLY2和WHIRLY3[7].
1.2 WHIRLY蛋白的结构
WHIRLY蛋白一般有3个结构域:N端结构域、WHIRLY结构域和C端多变区.N端结构域一般含有蛋白的亚细胞定位信号以及转录激活结构域;WHIRLY结构域是与单链DNA(ssDNA)结合的区域,在WHIRLY家族中最为保守,在其中间包含一段细胞核定位(NLS)的信号;而C端多变区则具有自我调节功能,可以调节WHIRLY蛋白与ssDNA的结合活性[4].Desveaux et al[1,3]和Cappadocia et al[8-11]先后对马铃薯StWHIRLYs和拟南芥AtWHIRLYs的晶体结构进行了解析,发现在溶解状态下WHIRLY蛋白通常以四聚体的形式存在,由4个呈陀螺状的WHIRLY单体通过中心的螺旋—环—螺旋连接在一起,呈C4对称分布.除了可以形成同源四聚体,异源酵母双杂交实验显示WHIRLY蛋白在体内也可能形成异源四聚体[3].根据WHIRLY蛋白是否含有转录激活结构域可以将其分为两种类型:含有转录激活结构域的WHIRLY蛋白(typeⅠ型)和没有转录激活结构域的WHIRLY蛋白(typeⅡ型),后者可能通过和前者形成异源四聚体来调节其对下游基因的转录活性调节[3].在模式植物拟南芥中,WHIRLY1和WHIRLY3归为typeⅠ型,而WHIRLY2归为typeⅡ型,其它植物中鉴定的WHIRLY蛋白则按照与拟南芥中的WHIRLY蛋白的同源性进行分类[6].Cappadocia et al[8]后来发现在体外结晶条件下WHIRLY蛋白甚至可以形成二十四聚体、四十八聚体甚至更大的多聚体,这些较大的多聚体可以保证WHIRLY蛋白能和更长的ssDNA分子结合.
1.3 WHIRLY蛋白的定位
在拟南芥中,蛋白预测分析发现AtWHIRLY1和AtWHIRLY3均含有N端叶绿体或质体定位信号和转录激活结构域.亚细胞定位试验也证实这两个typeⅠ型的WHIRLY蛋白主要定位于植物细胞的质体或叶绿体中[12],但后续的免疫电镜和细胞内迁移实验显示WHIRLY1蛋白也可以同时双定位于叶绿体和细胞核中[13,14].WHIRLY2属于typeⅡ型的WHIRLY蛋白,在拟南芥中其全长前体蛋白(238 aa)预测定位于线粒体中,且N端没有转录激活结构域.Krause et al[12]发现在拟南芥原生质体细胞中WHIRLY2主要定位于线粒体中,但体外胞器迁移实验发现WHIRLY2蛋白除了向分离的豌豆叶线粒体中转移外,在分离的叶绿体中也检测到蛋白的迁移,但在这两个细胞器中检测到的转移WHIRLY2蛋白的大小却存在显著的差异,线粒体中检测的转移WHIRLY2大小约为27 ku,而在叶绿体中检测的转移WHIRLY2大小约为22 ku,表明全长的WHIRLY2在向这两个细胞器迁移的过程中可能选择了不同的细胞器信号切割位点.WHIRLY2蛋白是否定位于细胞核中目前还未有实验进行证实,其是否真的能定位于叶绿体或质体中的细胞学证据也还未获得.
1.4 WHIRLY蛋白的功能
前人的研究表明ssDNA结合蛋白在核酸代谢中起着重要的调节作用,参与DNA的复制、修复、重组、转录和端粒保护等的调控[15].WHIRLY作为特异存在于植物中的一类ssDNA结合蛋白,其功能依赖于与ssDNA的结合.WHIRLY曾被报道与4种核酸序列结合:ERE(elicitor response element)元件[2,4]、端粒重复序列[16]、AtKP1基因启动子上的A/T富集区[17]以及同时包含ERE-A/T富集结构的序列[18].除ERE-A/T富集序列元件外,其它三种序列元件之间没有明显的相似性.目前对WHIRLY蛋白功能的研究主要集中在马铃薯、拟南芥、大麦、水稻和番茄等植物中,人们通过对WHIRLY基因过表达、RNAi以及突变体等的分析获得了一些了解WHIRLY蛋白功能的信息,发现它们在植物抗病信号转导(细胞核中)[2,4,19]、维持端粒结构稳定性(细胞核中)[16,20]、维持质体和线粒体基因组稳定和损伤修复(细胞器中)[8,11,15,21]、调控植物叶片衰老和角果发育(细胞核和线粒体)[18,22]以及调控质体和线粒体基因组表达(细胞器中)[17,23]等方面都发挥着重要的功能,表明WHIRLY蛋白在细胞内不同区域(核、叶绿体和线粒体)的定位似乎发挥着不同的作用[7,24].WHIRLY2作为WHIRLY蛋白家族中不含转录激活结构域的特殊一员,其亚细胞定位的研究目前还不够详细,它是如何实现对核基因的转录活性调节目前都还未可知.本文重点对已经获得的植物中WHIRLY2蛋白的研究进行综述,系统总结WHIRLY2基因的表达模式,蛋白结构以及已发现的功能等.这将为进一步研究WHIRLY2蛋白以及WHIRLY家族的功能提供一些参考.
2 WHIRLY2蛋白在植物中的存在及保守性
作为一类在植物中广泛存在的WHIRLY蛋白,WHIRLY2表现出多种自身具有的特异性.首先,大部分的WHIRLY2被预测定位于植物细胞的线粒体中[12,25,26],而且在拟南芥等模式植物中已经通过相关试验对其在线粒体中的定位进行了验证[12,23,26].通过基因组测序,已经在大约138种植物的基因组中发现WHIRLY2基因的存在,而且在有些植物中这些WHIRLY2基因可能还存在选择性剪切,产生更多的WHIRLY2转录本和更多类型的WHIRLY2蛋白[6].利用MEGA7软件,在基于JTT矩阵模型的最大似然法中利用缺省模式分析植物中26个WHIRLY2蛋白的同源进化关系,图中显示的是在对数可能性最大时(-2 044.01)的结果.该树按比例绘制,以每个节点的取代数量来衡量分支的长度.发现在单子叶和双子叶植物中WHIRLY2蛋白在进化上各自具有一定的保守性,可以分成明显的两个分支(图1).在双子叶植物中,芥菜属植物如拟南芥(Arabidopsisthaliana)、琴叶拟南芥(Arabidopsislyrata)和鼠耳芥(Arabidopsishalleri)等中的WHIRLY2具有最高的保守性,它们在进化上的距离也最短.芸薹属植株如白菜(Brassicarapa)和甘蓝(Brassicaoleracea)等中的WHIRLY2和芥菜属植物中WHIRLY2具有较高的同源性,其次是豆科植物,再次为双子叶木本植物等.在单子叶植物中,狗尾草属(Setaria)中的WHIRLY2具有最高的同源性,然后按照进化上的保守性依次为稻属(Oryza)、玉蜀黍属(Zea)、凤梨属(Ananas)和大叶藻属(Zostera)等.

图1 最大似然法构建植物中WHIRLY2蛋白的分子进化树Fig.1 Molecular phylogenetic analysis of WHIRLY2 proteins in plants by Maximum Likelihood method
利用DNAMAN软件自带的多重序列比对(Multiple Alignment)功能对双子叶和单子叶植物中比较典型的模式植物和农作物的WHIRLY2蛋白进行序列同源性分析.参数采用软件默认的缺省条件,右侧数字代表氨基酸的位置.分析结果显示所有蛋白在WHIRLY区的保守性都非常高,而在N端信号肽区和C端可变区的保守性都比较低,且所有蛋白在N端都缺少转录激活结构域(图2).有趣的是,和同源进化树中显示的单子叶和双子叶WHIRLY2出现分支的情况一致,单子叶植物如水稻(Oryzasativa, Os)、玉米(Zeamays, Zm)、高粱(Sorghumbicolor, Sb)和羊黍(Panicumhallii, Ph)中的WHIRLY2和双子叶植物如拟南芥(Arabidopsisthaliana, At)、白菜(Brassicarapa, Br)、大豆(Glycinemax, Gm)和苜蓿(Medicagotruncatula, Mt)中的WHIRLY2之间也表现出明显的序列保守性差异(图2).除单子叶和双子叶植物WHIRLY2蛋白共有的保守氨基酸区域外(蓝色标记),单子叶植物中的WHIRLY2在N端信号肽区、WHIRLY区和C端可变区都存在很高的保守性,而双子叶植物中的WHIRLY2除在WHIRLY区的保守性较高外,在N端信号肽区和C端可变区的保守性都较低.除此之外,单子叶和双子叶植物中的WHIRLY2在WHIRLY结构域区中除共有的氨基酸外还存在明显的氨基酸偏好性(红色标记),表明单子叶和双子叶中的WHIRLY2可能与ssDNA结合的效率以及在植物中发挥的功能上也存在一定的差异.
3 WHIRLY2基因的表达
目前对typeⅡ型WHIRLY2基因的表达研究主要集中在双子叶植物如拟南芥和番茄等模式植物中,对单子叶植物中WHIRLY2基因的表达研究报道较少.拟南芥中的研究发现,AtWHIRLY2在大部分组织中均有一定的表达活性,在叶、花序茎和花序顶端这三个器官的分生组织中的表达水平最高,在叶中的表达水平中等,在衰老叶中的表达要稍高于成熟叶,在花器官和角果中也有一定的表达活性[26,27].除此之外,拟南芥中WHIRLY2的表达受植物激素茉莉酸、水杨酸和脱落酸等的诱导[27].在番茄中,赵淑亚利用定量PCR技术对SlWHIRLY2基因的表达进行了分析,发现它在叶片中的表达水平要明显高于其它组织.除此之外,StWHIRLY2的表达还受到聚乙二醇、氯化钠、水杨酸、过氧化氢和青枯假单胞菌等的诱导[25].以上结果表明,WHIRLY2基因在叶中的表达可能具有一定的广泛性,同时也对各种体外环境胁迫等因素具有一定的响应.

图2 单子叶和双子叶植物中WHIRLY2蛋白的同源性分析Fig.2 Homology comparison of WHIRLY2 proteins in monocotyledonous and dicotyledonous plants
4 WHIRLY2的功能
4.1 WHIRLY2调控叶片衰老
衰老是由基因控制并受内外环境因素诱导的一种自然衰退和死亡过程[28],在植物的整个生命周期中扮演着重要的角色[28-30].目前已通过相关实验,发现WHIRLY2在植物中可能参与对叶片衰老的调节.Marechal et al[23]在拟南芥中的研究发现,WHIRLY2基因的敲除突变体kowhy2表现出与野生型类似的衰老表型,但WHIRLY2的超表达植株(oeWHY2)则表现出矮小,叶片形态扭曲,黄化早衰和角果短小等表型.RT-PCR实验检测5周WHIRLY2基因的超表达、突变体和野生型植株的第3和第4片真叶中相关衰老标志基因的表达差异,发现与野生型和突变体植株相比,所有超表达植株的叶片中与衰老相关基因的表达都出现显著上调,与形态上观察到的叶片衰老表型相一致[23].黄晨星等[27]研究了早期WHIRLY2超表达植株对植物激素的响应,发现在体外施加茉莉酸甲酯的情况下,WHIRLY2超表达植株的叶片会更早表现出衰老症状,表明茉莉酸甲酯在WHIRLY2介导的植物叶片衰老过程中具有正调控作用.
4.2 WHIRLY2调控线粒体DNA水平及影响线粒体的功能
共生起源学说表明,线粒体包含基因组DNA(即mtDNA),能编码氧化磷酸化相关的蛋白,对线粒体的功能是不可或缺的[31,32].DNA双链的断裂(DSBs)会导致基因组的不稳定[33],而同源重组(HR)可维持基因组的稳定性,使DNA的损伤得到修复[34].植物线粒体中存在活跃的重组事件[35],Cappadocia et al[11]通过回旋酶抑制剂及环丙沙星(CIP)等的处理发现,WHIRLY2基因的敲除突变体kowhy2植株与野生型相比,线粒体的DNA重组数量显著增长,表明WHIRLY2蛋白能够促进同源重组,帮助损伤的线粒体DNA得到及时的修复[36].Marechal et al[23]发现超表达WHIRLY2植株叶片细胞核中DNA的数量与kowhy2和野生型植株中的相似,但线粒体中DNA的含量大量降低,并缺乏复合物Ⅰ和复合物Ⅳ.测量这些复合物中由线粒体基因组编码的基因的表达水平,发现与野生型和kowhy2植株相比,oeWHY2植株中nad3、nad4、nad7、cox1、cox2和cox3基因的表达水平均显著降低.进一步的研究发现,在oeWHY2植株中,只有包含线粒体基因组编码的小单元的复合物才会受到影响,完全由核基因组编码的多肽复合物则完好无损.这些结果表明,线粒体的功能在超表达WHIRLY2植株的叶片中受到了损害[22].WHIRLY2与线粒体DNA之间的相互作用似乎发生在整个线粒体的基因组上[23],过表达WHIRLY2明显影响了叶片中线粒体基因组的表达,但WHIRLY2调节线粒体基因表达的机制仍有待进一步的研究.有趣的是,Qiang et al[37]的研究发现在花粉发育时期线粒体中DNA的水平呈降低趋势,并且WHIRLY2基因的转录水平也降低.WHIRLY2的减少以及线粒体DNA的降解同时发生在花粉发育的时期,表明可能是WHIRLY2影响了线粒体中DNA的积累水平.进一步的研究发现,WHIRLY2超表达植株的花粉营养细胞中线粒体的DNA增加,说明WHIRLY2可能导致线粒体中DNA的水平增高[26].这与Marechal et al[23]在叶片中观察到的结果正好相反,表明WHIRLY2在植物不同器官的线粒体中可能发挥不同的功能.
4.3 WHIRLY2调控拟南芥花粉管的活力
线粒体功能的缺陷往往涉及过量的活性氧物质的积累[38],而线粒体基因组上的AOX和NDA等基因则编码参与植物线粒体中ROS清除通路相关的蛋白[39,40].在植物中,花粉的萌发和花粉管的生长均需要快速而充足的线粒体呼吸活力[41].Qiang et al[26]的研究发现在拟南芥中超表达WHIRLY2会导致花粉营养细胞中线粒体DNA拷贝数的增加,从而影响线粒体的呼吸和线粒体的大小,以及花粉管的生长,并且线粒体基因组编码的AOX和NDA基因的转录水平都增加.通过苯胺蓝染色,发现在花粉管生长的起始阶段WHIRLY2超表达植株的花粉管与野生型没有显著的差别.但在花粉管生长的后期,超表达植株的花粉管比野生型要短,因此花粉管抵达未受精胚珠的机会大大减少.进一步的研究发现,超表达WHIRLY2抑制了花粉管中线粒体的分裂,增加了单个线粒体中DNA的拷贝数,导致线粒体中氧活性物质大量积累而无法及时得到清除,从而抑制了花粉管的生长[26].这一结果也暗示了在花粉管中线粒体中DNA拷贝数的适度降低并不影响线粒体的功能反而会促进线粒体的活力.
4.4 WHIRLY2调控拟南芥角果的发育
黄晨星等[22]观察了野生型、WHIRLY2超表达(oeWHY2)和kowhy2突变体植株在相同生长条件下角果的发育情况,发现oeWHY2植株的角果表现出干瘪、黄化的早衰异常发育现象,而kowhy2与野生型植株的角果发育情况相似,并未出现发育异常.通过组织切片,发现oeWHY2植株的角果果皮细胞内叶绿体的数目与野生型相比显著减少,而kowhy2植株的角果与野生型相比无明显差异.电镜超微结构显示,oeWHY2异常发育的角果果皮细胞中除线粒体的结构出现异常之外,叶绿体的结构也出现异常,基粒类囊体的垛层较野生型显著减少,基质类囊体之间的连接在一些位置出现断裂,叶绿体内腔中的脂滴(lipid droplet)数量相比于野生型也显著增多,而kowhy2突变体角果果皮细胞中的线粒体和叶绿体的情况则正好相反,线粒体和叶绿体的结构非常完整,脂滴的积累也较野生型中明显减少,基本看不到脂滴的存在.实时定量PCR检测野生型、oeWHY2和kowhy2植株角果中与能量代谢、线粒体基因组稳定性以及叶绿体代谢相关的60个基因的表达差异,发现线粒体基因组编码的基因nad1和cytc382的转录水平在oeWHY2植株的角果中显著上调,而在kowhy2植株的角果中显著下调;atp9基因的转录水平在oeWHY2和kowhy2植株的角果中都上调.EMSA实验发现,WHIRLY2能结合在线粒体基因组的4×Tel重复序列上,调控下游nad1和cytc382基因的表达.因此WHIRLY2超表达可能同时影响了拟南芥角果果皮细胞中的线粒体和叶绿体的结构稳定性,使这两个细胞器中DNA的拷贝数降低,脂滴的含量增高,从而引起角果发育的异常[22].
4.5 WHIRLY2调控植物对干旱和病原体的响应
干旱能直接影响植物的生长发育,严重时甚至引起植物不可逆的伤害,最终导致植物死亡.赵淑亚发现在干旱胁迫条件下,异源超表达番茄WHIRLY2基因(oeSlWHY2)的转基因烟草萌发率明显高于野生型,并且转基因烟草幼苗的抗旱性优于野生型,表现为较长的根长及较轻微的萎焉[25].进一步的研究发现干旱处理条件下野生型烟草中丙二醛的含量和相对电导率均明显高于转基因植株,表明转基因烟草细胞膜受损的程度低于野生型,由此推测SlWHY2过表达可能具有维持细胞膜稳定性的作用.另外,在干旱条件下野生型烟草中的相对含水量和游离脯氨酸的含量明显低于转基因植株,表现为更容易失水,因此SlWHY2过表达可能还会增强转基因烟草的保水性,从而提高其抗旱能力.
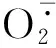
此外,试验发现oeSlWHY2转基因烟草相比于野生型植株能通过缓解青枯假单胞菌造成的ROS的积累而抵抗病菌的侵染扩散.并且在青枯假单胞菌侵染后转基因烟草中水杨酸的响应基因NtPR1和NtPR2的表达均明显高于野生型,由此推测SlWHY2可能通过参与水杨酸依赖的抗病响应途径来调控病程相关基因的表达,进而增强植株的抗病性.
5 总结与展望
本文系统总结了植物中特异存在的ssDNA结合蛋白转录因子WHIRLY家族成员WHIRLY2的研究进展.发现其主要在植物细胞的线粒体中发挥作用,通过参与微同源序列介导的重组(MHMR)修复来参与制止线粒体DNA损伤的易错修复.过表达WHIRLY2会影响线粒体结构的稳定性,使线粒体基因组编码基因的表达发生变化,在叶片中导致线粒体DNA的数量减少,促使植株叶片加速衰老;但是,过表达WHIRLY2也使花粉管中线粒体DNA的拷贝数增加,但同时抑制线粒体的分裂,使线粒体的活力降低,从而抑制花粉管的生长.除此之外,过表达WHIRLY2还影响拟南芥角果的发育和线粒体的功能等,同时也参与了植物抗旱和对病原体侵袭的响应等.因此,WHIRLY2作为WHIRLY转录因子家族中typeⅡ型的成员,在植物叶片衰老、花粉管活力和角果发育中都发挥着重要的功能,也在植物响应干旱胁迫和病原菌侵袭的过程中发挥作用.
然而,尽管目前的一些研究已经发现WHIRLY2蛋白在植物中的诸多重要功能,但是WHIRLY2在植物细胞器中发挥功能的分子机制目前解析得还不是很详细,如WHIRLY2是如何调节线粒体基因组编码基因的表达以及与叶片衰老、花粉管和角果发育之间的直接关系;WHIRLY2在植物发育过程中是否存在细胞器之间的迁移从而使其在细胞核和(或)叶绿体中也发挥作用等都需要进行深入的研究,而这些相关的研究领域也将成为以后WHIRLY家族蛋白研究的热点.
[1] DESVEAUX D, AllARD J, BRISSON N, et al. A new family of plant transcription factors displays a novel ssDNA-binding surface[J]. Nature Structural Biology, 2002,9(7):512-517.
[2] DESVEAUX D, SUBRAMANIAM R, DESPRES C, et al. A “Whirly” transcription factor is required for salicylic acid-dependent disease resistance inArabidopsis[J]. Development Cell, 2004,6(2):229-240.
[3] DESVEAUX D, MARECHAL A, BRISSON N. Whirly transcription factors: defense gene regulation and beyond[J]. Trends in Plant Science, 2005,10(2):95-102.
[4] DESVEAUX D, DESPRES C, JOYEUX A, et al. PBF-2 is a novel single-stranded DNA binding factor implicated in PR-10a gene activation in potato[J]. Plant Cell, 2000,12(8):1 477-1 489.
[5] KRAUSE K, KRUPINSKA K. Nuclear regulators with a second home in organelles[J]. Trends in Plant Science, 2009,14(4):194-199.
[6] JIN J, TIAN F, YANG D, et al. PlantTFDB 4.0: toward a central hub for transcription factors and regulatory interactions in plants[J]. Nucleic Acids Research, 2017,45(D1):1 040-1 045.
[7] 林文芳,任育军,缪颖.植物Whirly蛋白调控叶片衰老的研究进展[J].植物生理学报,2014(9):1 274-1 284.
[8] CAPPADOCIA L, PARENT J, ZAMPINI É, et al. A conserved lysine residue of plant Whirly proteins is necessary for higher order protein assembly and protection against DNA damage[J]. Nucleic Acids Research, 2012,40(1):258-269.
[9] CAPPADOCIA L, SYGUSCH J, BRISSON N. Purification, crystallization and preliminary X-ray diffraction analysis of the Whirly domain of StWhy2 in complex with single-stranded DNA[J]. Acta Crystallographica Section F Structural Biology and Crystallization Communications, 2008,64(11):1 056-1 059.
[10] CAPPADOCIA L, PARENT J, SYGUSCH J, et al. A family portrait: structural comparison of the Whirly proteins fromArabidopsisthalianaandSolanumtuberosum[J]. Acta Crystallographica Section F Structural Biology and Crystallization Communications, 2013,69(11):1 207-1 211.
[11] CAPPADOCIA L, MARECHAL A, PARENT J S, et al. Crystal structures of DNA-Whirly complexes and their role inArabidopsisorganellegenome repair[J]. Plant Cell, 2010,22(6):1 849-1 867.
[12] KRAUSE K, KILBIENSKI I, MULISCH M, et al. DNA-binding proteins of the Whirly family in Arabidopsis thaliana are targeted to the organelles[J]. FEBS Letters, 2005,579(17):3 707-3 712.
[13] GRABOESKI E, MIAO Y, MULISCH M, et al. Single-stranded DNA-binding protein Whirly1 in barley leaves is located in plastids and the nucleus of the same cell[J]. Plant Physiology, 2008,147(4):1 800-1 804.
[14] ISEMER R, MULISCH M, SCHAFER A, et al. Recombinant Whirly1 translocates from transplastomic chloroplasts to the nucleus[J]. FEBS Letters, 2012,586(1):85-88.
[15] DICKEY T H, ALTSCHULER S E, WUTTKE D S. Single-stranded DNA-binding proteins: multiple domains for multiple functions[J]. Structure, 2013,21(7):1 074-1 084.
[16] YOO H H, KWON C, LEE M M, et al. Single-stranded DNA binding factor AtWHY1 modulates telomere length homeostasis inArabidopsis[J]. The Plant Journal, 2007,49(3):442-451.
[17] XIONG J, LAI C, QU Z, et al. Recruitment of AtWHY1 and AtWHY3 by a distal element upstream of the kinesin gene AtKP1 to mediate transcriptional repression[J]. Plant Molecular Biology, 2009,71(4-5):437-449.
[18] MIAO Y, JIANG J, REN Y, et al. The single-stranded DNA-binding protein WHIRLY1 represses WRKY53 expression and delays leaf senescence in a developmental stage-dependent manner inArabidopsis[J]. Plant Physiology, 2013,163(2):746-756.
[19] 姚沁涛,张文蔚,刘莉,等.Whirly转录因子对非寄主菌诱导水稻HR反应的负调控作用[J].中国农业科技导报,2008(5):53-58.
[20] 姚侠妹.侧柏古树端粒相关基因克隆及其抗逆功能研究[D].北京:中国林业科学研究院,2017.
[21] MARECHAL A, PARENT J S, VERONNEAU-LAFORTUNE F, et al. Whirly proteins maintain plastid genome stability inArabidopsis[J]. Proceedings of the National Academy of Sciences, 2009,106(34):14 693-14 698.
[22] 黄晨星,任育军,李燕云,等.拟南芥WHIRLY2基因超表达引起拟南芥角果发育异常的分子细胞学分析[J].福建农林大学学报(自然科学版),2016,45(3):277-281.
[23] MARECHAL A, PARENT J, SABAR M, et al. Over-expression of mtDNA-associated AtWhy2 compromises mitochondrial function[J]. BMC Plant Biology, 2008,8(1):42.
[24] 孔凡英,邓永胜,周斌,等.Whirly转录因子研究进展[J].植物生理学报,2012(7):643-653.
[25] 赵淑亚.番茄SlWHY2基因的克隆、表达和功能分析[D].泰安:山东农业大学,2016.
[26] CAI Q, GUO L, SHEN Z R, et al. Elevation of pollen mitochondrial DNA copy number by WHIRLY2: altered respiration and pollen tube growth inArabidopsis[J]. Plant Physiology, 2015,169(1):660-673.
[27] 黄晨星.WHIRLY2蛋白介导拟南芥生长的分子细胞学研究[D].福州:福建农林大学,2016.
[28] THOMAS H. Senescence, ageing and death of the whole plant[J]. New Phytologist, 2013,197(3):696-711.
[29] WU X, KUAI B, JIA J, et al. Regulation of leaf senescence and crop genetic improvement[J]. Journal of Integrative Plant Biology, 2012,54(12):936-952.
[30] ZHANG H, ZHOU C. Signal transduction in leaf senescence[J]. Plant Molecular Biology, 2013,82(6):539-545.
[31] PIKO L, MATSUMOTO L. Number of mitochondria and some properties of mitochondrial DNA in the mouse egg[J]. Developmental Biology, 1976,49(1):1-10.
[32] ROBIN E D, WONG R. Mitochondrial DNA molecules and virtual number of mitochondria per cell in mammalian cells[J]. Journal of Cellular Physiology, 1988,136(3):507-513.
[33] SAN FILIPPO J, SUNG P, KLEIN H. Mechanism of eukaryotic homologous recombination[J]. Annual Review of Biochemistry, 2008,77(1):229-257.
[34] JANICKA S, KUHN K, LE RET M, et al. A RAD52-like single-stranded DNA binding protein affects mitochondrial DNA repair by recombination[J]. The Plant Journal, 2012,72(3):423-435.
[35] MANCHEKAR M, SCISSUM-GUNN K, SONG D, et al. DNA recombination activity in soybean mitochondria[J]. Journal of Molecular Biology, 2006,356(2):288-299.
[36] MARECHAL A, BRISSON N. Recombination and the maintenance of plant organelle genome stability[J]. New Phytologist, 2010,186(2):299-317.
[37] HONYS D, TWELL D. Transcriptome analysis of haploid male gametophyte development inArabidopsis[J/OL]. Genome Biology, 2004,5(11),http://genomebiology.com/2004/5/11/R85.
[38] ALANDIJANY T, KAMMOUNI W, ROY CHOWDHURY S K, et al. Mitochondrial dysfunction in rabies virus infection of neurons[J]. Journal of Neurovirology, 2013,19(6):537-549.
[39] MAXWELL D P, WANG Y, MCINTOSH L. The alternative oxidase lowers mitochondrial reactive oxygen production in plant cells[J]. Proceedings of the National Academy of Sciences, 1999,96(14):8 271-8 276.
[40] SVENSSON Å S, RASMUSSON A G. Light-dependent gene expression for proteins in the respiratory chain of potato leaves[J]. The Plant Journal, 2001,28(1):73-82.
[41] ROUNDA C M, WINSHIP L J, HEPLER P K. Pollen tube energetics: respiration, fermentation and the race to the ovule[J/OL]. AoB Plants, 2011,doi:10.1093/aobpla/plr019.

