碘-124的生产、标记及在肿瘤PET分子影像的应用
李立强,王 风,刘特立,朱 华,杨 志
(北京大学肿瘤医院暨北京市肿瘤防治研究所 核医学科 恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142)
PET/CT(positron emission tomography/computed tomography)基于PET与CT的有机结合,是一种无创的分子影像疾病检测手段,可以同时获得病变部位的功能代谢状况和精确的解剖结构定位,具有超高的灵敏度及分辨率,广泛应用于临床的疾病诊断及药物的药代动力学研究等方面。目前,用于PET/CT疾病诊断及研究的正电子核素主要以11C、13N、15O及18F为主,但这些核素半衰期较短(11C:T1/2=20 min;13N:T1/2=10 min;15O:T1/2=2min;18F:T1/2=110min),不适用于合成工艺较为复杂、耗时较长的标记分子探针,此外,在具有较长时间间隔的延时疾病扫描中也存在局限性。
碘放射性同位素(123I、125I、124I及131I)是一类核医学领域的常规应用核素,通常用于对单克隆抗体或其他类型的分子探针进行放射性标记,在核医学疾病诊断、显像定量分析以及放疗方面应用较多。目前,在碘的放射性同位素应用中,主要以123I、125I及131I核素为主。123I适合于疾病显像诊断,其释放出能量为159keV的γ射线,与核素99mTc(140keV)相近,可以应用低能高分辨的单光子发射计算机断层显像(SPECT)探头进行疾病诊断。然而,123I的半衰期相对较短,仅限于对合成简单、快速的分子探针进行标记,以及诊断周期较短的疾病,同时,123I核素的制备难度较大,进一步限制了其在临床上的广泛应用。125I主要释放出27keV的X射线以及35.5keV的γ射线,能量过低,无法得到清晰的疾病诊断图像,不适于临床应用,目前常被用于抗体或多肽标记,进行体外细胞实验。131I是应用最多的一种碘放射性同位素,主要释放出能量为606keV的β-射线,常被用于甲状腺恶性疾病的放射性治疗;131I还可以释放出γ射线,可进行SPECT/CT显像,但是释放的γ射线能量过高(364keV),需应用配有高能通用(high energy all purpose,HEAP)准直器的SPECT仪器进行检测,限制了131I在临床疾病诊断方面的广泛应用。
124I具有较长的半衰期(4.15d)及优异的核特质(β+:25.6%,电子俘获(EC):74.4%)。与其他常规的正电子核素相比,124I可以提供更高质量的PET/CT疾病诊断图像,其应用领域可从简单的甲状腺及甲状旁腺显像至复杂的神经递质受体功能显像。但124I较少的β+射线发射率(25.6%),复杂的衰变纲图和超高能量的γ射线(1.7MeV),限制了124I的临床应用。即便如此,诸多研究报道依旧认为124I是一种非常适于临床PET/CT疾病诊断的正电子核素[1-2]。因此,本文主要对正电子核素124I的物理性质、目前利用医用回旋加速器常规的生产途径、放射性标记方法及在肿瘤PET分子影像方面的临床应用进行阐述。
1 124I的核性质
124I经衰变主要释放出511keV(46%)、603 keV(61%)及1691keV(11%)的γ射线和1532keV(11%)及2135keV(11%)的β+射线。124I物理半衰期为4.15d,在机体内的生物半衰期为120~138d,有效半衰期为4.15d,主要摄取器官为甲状腺。当人体服入2.83×10-7Sv/Bq或吸入1.69×10-7Sv/Bq的124I会产生相应的毒性作用[3]。
124I为长半衰期正电子核素,其发射的高能量β+射线,可用于PET/CT疾病诊断并获高质量的检测图像;同时还可通过电子俘获(EC)方式发射俄歇电子,直接对肿瘤细胞DNA造成损伤,进行治疗。
2 124I的生产
2.1 制备途径
依据回旋加速器类型、粒子流束种类及轰击能量的不同,124I的制备途径可分为多种。124I核素常用制备途径列于表1。最初,124I被认为是124Te(p,2n)123I核反应制备123I核素生产过程中产生的污染核素,当发现124I具有良好的核医学应用前景后,便通过124Te(p,n)124I核反应制备了124I核素,但是产率较低[4]。Lambrecht等[5]采用15 MeV的氘核124Te轰击固体靶,通过124Te(d,2n)124I核反应可以制备大量高纯度的124I核素。该方法使用80~85 μA的电流轰击6 h,可以得到10 GBq的124I核素。由于当时缺乏可以应用80~85 μA电流进行氘核轰击的回旋加速器,且产物中存在较多125I杂质核素,致使该方法没有广泛应用。
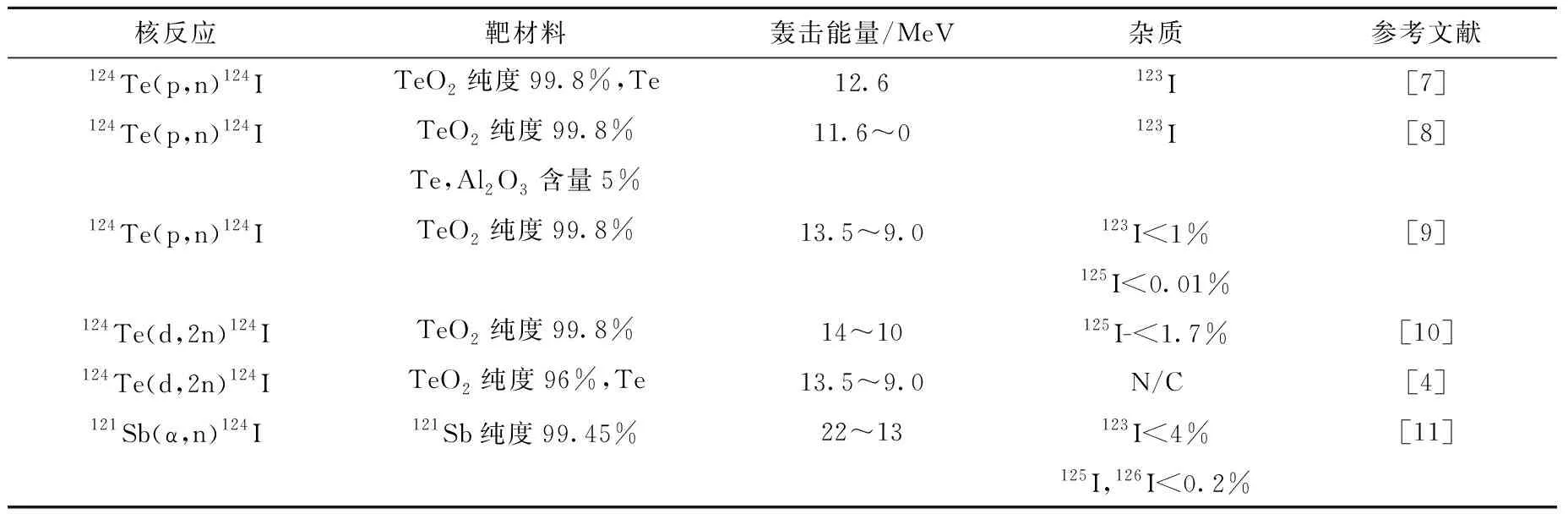
表1 124I的常用制备途经Table 1 The main nuclear reactions for the production of 124I
近年来,由于商业化高纯度富集124Te的出现,使得通过124Te(p,n)124I核反应生产124I的产率可以达到124Te(d,2n)124I的80%,并且轰击能量较低(<12 MeV),可以利用医用小型回旋加速器制备124I[6],因此,目前124Te(p,n)124I核反应为124I核素的主流制备途径。
2.2 靶片及靶材料
目前,124I的生产主要以固体靶为主,靶材料与生产123I相似,但需要满足一些独特的要求。Bosch等[12]于1977年首次提出124I生产的固体靶材料条件:(1) 靶材料与靶片的热稳定性及导热性质优越,能够在轰击打靶过程中保持稳定;(2) 制靶过程简单,每次轰击后可以回收99%以上的124Te;(3) 轰击结束后可以快速、简单的进行124I分离纯化;(4) 轰击后生产的124I以化学形态存在,且不影响后续标记过程或体内应用。
靶材料热稳定性的强弱至关重要。目前,应用于124I生产制备的靶材料主要有Te单质(element tellurium)与TeO2(tellurium doixide)。与Te单质相比,TeO2化学结构特殊,具有更高的熔点(733℃)以及更好的热稳定性,适用于124I的生产制备[12]。同时,由于Te单质在高温及O2存在的情况下会发生爆炸并使124I挥发,极易造成环境放射性污染,因此,近年来多数关于124I生产制备的研究报道都以TeO2为靶材料[13-16]。
为了进一步提高TeO2靶材料的热稳定性,通常会在其中掺杂5%的Al2O3。Al2O3可以增加靶材料与靶片的黏附性,还可进一步增加TeO2的熔点(895℃),同时,在高温环境下,Al2O3可以形成一种玻璃样表面结构,能有效地保持靶材料形态的完整性[9,17-19]。
靶体材料的性质对于124I生产制备同样具有决定性作用。通常,靶体材料的选择需要遵循以下原则:(1) 具有优异的热稳定性与良好的耐腐蚀性;(2) 与靶材料(如TeO2)具有一定的黏附能力;(3) 性质较为稳定或在粒子流束轰击下产生少量短半衰期核素的靶体材料。因此,目前常用的靶体材料主要以金属铂和钽为主[9,13,17,19-20]。此外,有研究表明合金金属也可作为靶体的构成材料,例如铂铱合金(90%铂,10%铱)等[21-23]。
2.3 纯化分离
靶片轰击后的核素分离纯化步骤对124I的生产产率和纯度有很大影响[24]。目前,用于124I分离及纯化的方法主要有碘升华法、萃取法、离子树脂交换法以及电化学分离法。其中,碘升华法为常用的方法。该方法将轰击后的靶片放入石英管中,通过梯度加热将124I升华,随后通入一定流速的惰性气体将124I蒸汽吹入碱性溶液中进行收集。该方法最初主要应用于131I与123I的分离纯化,随后,Weinreich
与Knust于1996年首次将该方法用于124I的生产[22,24-25]。
用碘升华法分离纯化124I过程中,参数的选择对于纯化效率有较大的影响(表2)。Knust等[22]认为,降低加热器与冷凝管中气体体积和124I的碱性收集溶液体积,可有效提高纯化后124I的放射性活度;一些研究者认为,对加热器与冷凝管之间的链接管道进行预加热,可以防止124I蒸汽提前凝结,提高产率[9,13];Glaser与Braghirolli等在冷凝管中增加Al2O3过滤网,显著提高了TeO2回收率[13,26]。

表2 不同参数的碘升华法用于124I分离及纯化Table2 Dry distillation setup parameters of 124I purification
3 124I的放射性标记
3.1 直接标记
直接标记利用Chloramine T、Iodogen和多种氧化酶等将124I-氧化为124I2单质,进而与标记物前体中酪氨酸残基上的H发生亲电取代。该方法适用于结构中存在酪氨酸残基,且该残基远离活性结构中心的探针前体。直接标记法操作步骤成熟、简单,标记率较高,且通过直接取代探针前体结构中的H进行放射性标记,可以有效地减少124I的引入对前体活性产生的影响,是目前最常用的一种124I放射性标记方法。目前应用直接标记方法制备的124I放射性探针列于表3。
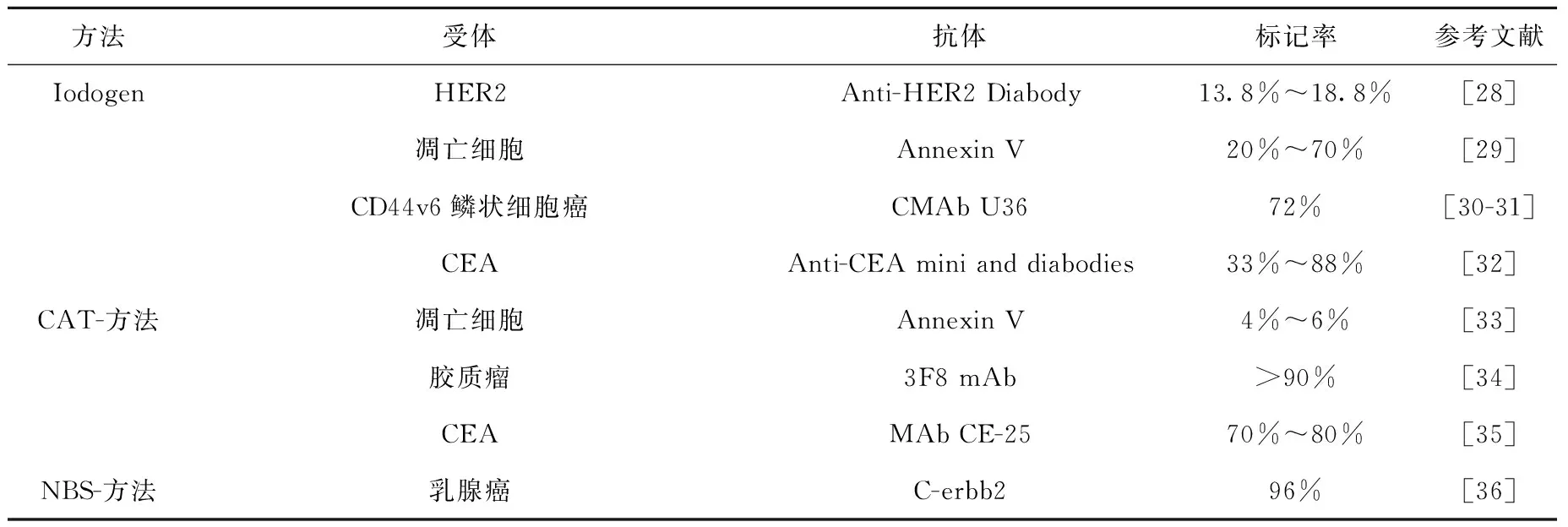
表3 应用直接标记法进行124I核素标记的蛋白与抗体Table 3 Direct labeling of proteins and antibodies with 124I
3.2 间接标记
间接标记方法预先将124I核素通过亲核或亲电取代反应标记到辅基上,再通过辅基与探针前体中的活性基团(氨基、巯基等)进行反应,间接的对探针前体进行124I核素标记。该方法适用于结构中不存在酪氨酸残基或酪氨酸残基位于活性结构中心的探针前体,但辅基的引入存在影响探针前体活性的可能。与直接标记方法相比,所得标记物在体内不易脱碘,有更好的生物稳定性。目前常见的124I标记辅基有Bolton-Hunter试剂[124I]SHPP、3-[124I]SIB与4-[124I]SIB(图1)等。其中,[124I]SHPP已被应用于对靶向血管内皮细胞生长因子受体(vascular endothelial growth factor receptor,VEGFR)的VG76e抗体进行标记(图2),进而监测针对血管内皮生长因子(VEGF)信号通路治疗的疗效[37]。
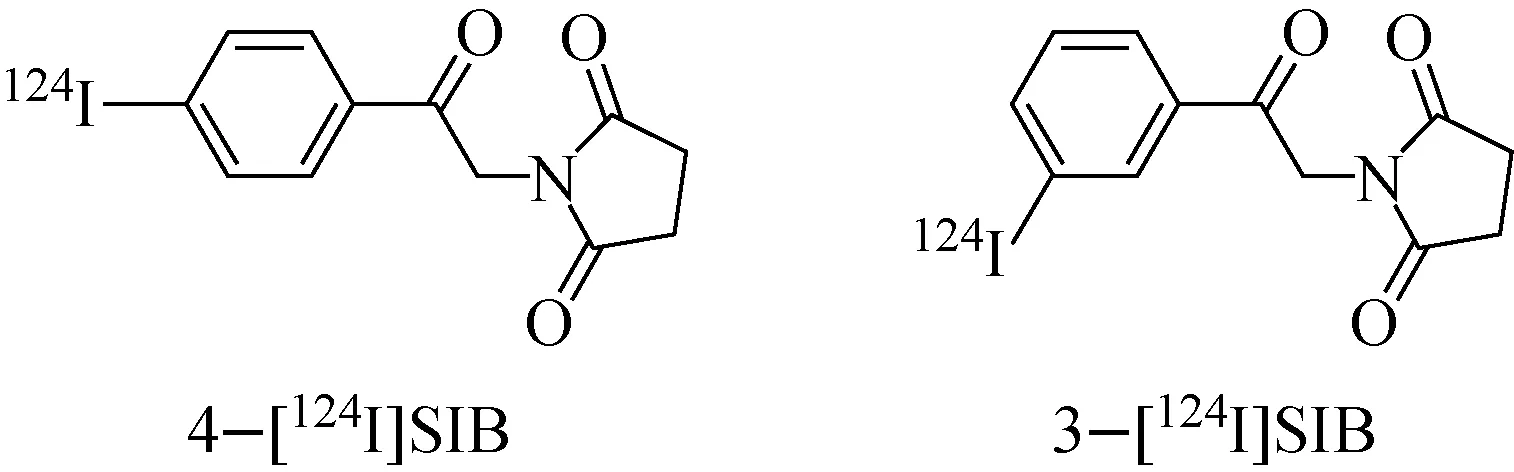
图1 4-[124I]SIB与3-[124I]SIB的化学结构式Fig.1 The structures of 4-[124I]SIB and 3-[124I]SIB
目前,已有多种类型探针应用直接或间接标记方法进行核素124I标记,并在核医学临床与临床前进行广泛研究,表4对这些探针进行了简要汇总。
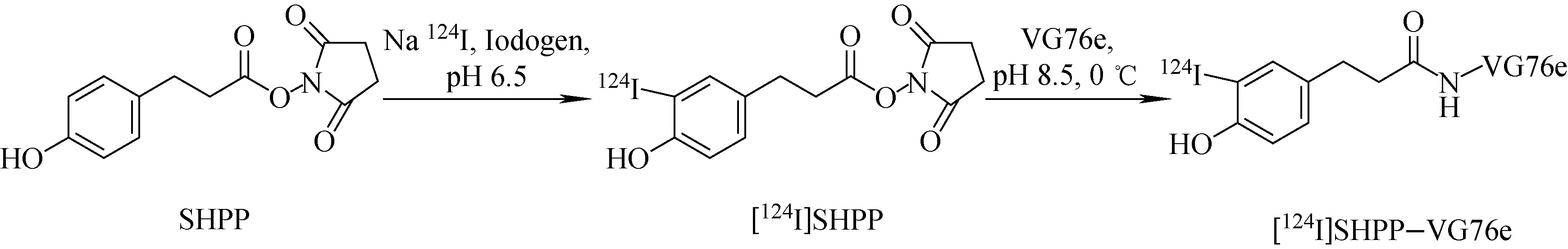
图2 [124I]SHPP与[124I]SHPP-VG76e的制备Fig.2 Synthesis of [124I]SHPP and [124I]SHPP-VG76e
应用配体探针参考文献肿瘤蛋白与多肽124I-SHPP, 124I-A14-iodoinsulin[37]肾癌抗体124I-Cg250[38-41]结直肠癌抗体124I-CDR huA33, 124I-minibodies[42-43]肿瘤细胞增殖抗体124I-IUdr, 124I-FIAU, 124I-drFIB[44-47]凋亡Annexin V124I-Annexin V[29, 48]乏氧抗体124I-IAZA, 124I-IAZG[49]
4 124I在PET分子影像的应用
4.1 肿瘤增殖
肿瘤细胞增殖(tumor proliferation)显像可以反馈肿瘤的生长情况并进行分级,对于多种类型肿瘤的诊断及治疗具有指导意义。多数关于肿瘤细胞增殖显像的研究报道都以DNA类似物作为探针靶标,这些靶标可以直接参与细胞内的DNA复制扩增,进而反应肿瘤细胞的增殖情况。由于DNA复制增殖过程持续时间较长,因此应选择半衰期与之相匹配的核素对这一类探针进行标记[44-45,50]。124I-IUdR与124I-FIAU为一种放射标记的核苷酸类似物,是目前被广泛研究的肿瘤增殖显像探针,但是这两种探针在生物体内都存在着明显的脱124I现象[44-46]。Blasberg等[51]曾应用124I-IUdR对20例脑膜瘤与脑神经胶质瘤患者进行PET显像诊断,结果发现,不同肿瘤类型患者组之间的肿瘤124I-IUdR摄取值(Ki)、标准摄取值(SUV)以及肿瘤/正常脑组织(Tm:Br)比值存在有很大差异,其中,不同患者组间Ki值差异最为明显,表明可以根据患者的Ki或SUV等值判断肿瘤类型,进而对后续治疗手段选择提供依据;此外,还发现在患者肿瘤部位除了对124I-IUdR具有较高摄取外,不同患者在肿瘤部位存在不同程度的124I-,这对Ki、SUV等值的计算存在有很大影响。
4.2 凋亡
细胞凋亡(Apoptosis)又称细胞程序性死亡,与坏死不同,是一种由基因调控、能量依赖的主动性细胞清除程序。凋亡是细胞的基本特征之一,在机体的胚胎发育、组织修复与内环境的稳定方面起着十分重要的作用。细胞凋亡同样存在于恶性肿瘤的生长以及发展过程中,尤其是大量存在于肿瘤缺氧坏死区域的附近,同时,对肿瘤细胞凋亡情况进行实时检测对于放疗及化疗的疗效预测具有重要意义。
Annexin V为常用的细胞凋亡检测试剂,它可以与表达于处于凋亡早期细胞表面的磷酯酰丝氨酸进行特异性结合,进而反馈细胞的凋亡情况。目前,许多研究者将Annexin V进行124I标记,并进行肿瘤细胞凋亡PET/CT显像,验证了其对于肿瘤诊断、放化疗疗效预测的能力[52]。例如,2005年,Dekker等[29,48]通过直接、间接法对Annexin V类似物进行124I标记,并通过体内、外实验探究不同标记方法对探针在体内生物学性质的影响,结果表明,直接标记产生的124I-Annexin V具有更好的生物学性质。此外,124I-4IB-Annexin V与124I-Annexin V相比,其在细胞凋亡非常活跃的肝脏部位摄取极低,表明4IB的引入影响了Annexin V与磷酯酰丝氨酸结合的能力。
4.3 Immuno PET/CT显像
单克隆抗体是目前用于治疗癌症的临床一线药物,在多种类型癌症治疗过程中都具有较好效果。Immuno PET显像是将单克隆抗体进行放射性核素标记,并进行相应癌症的PET/CT显像诊断或治疗疗效评价。单克隆抗体的特异性与PET/CT的超高灵敏度和分辨率的有机结合,使得Immuno PET成为了临床疾病诊断的主流检测方式。
124I是一种非常适用于Immuno PET肿瘤显像的放射核素,其较长的半衰期匹配单克隆抗体在机体内的药代动力学性质[53]。此外,131I、125I和123I等放射性核素对蛋白及单克隆抗体标记的研究体系较为完整,可以直接用于124I的单克隆抗体标记[54-56]。Wilbur等[57]研究了碘放射性同位素标记抗体的最佳方法,与Chloramin-T相比,应用PIB(N-succinimidyl 4-iodobenzoate)作为氧化剂进行标记,可以显著提高标记抗体在机体内的稳定,降低甲状腺部位放射性的凝聚。
124I-G250是用于肾细胞癌诊断的抗体类放射性探针,目前已经处于临床研究阶段,是一种具有代表性的124I核素标记的抗体类探针。G250主要通过Iodogen方法进行124I核素标记,124I-G250对于肾细胞癌的检出率(94%)明显高于131I-G250(30%)以及18F-FDG(90%)[38]。
Zechmann等[58]将靶向前列腺癌摸特异性抗原(PSMA)的单克隆抗体MIP-1095进行124I核素标记,并对多发转移的前列腺癌患者进行了PET/CT显像,结果表明,124I-MIP-1095在人体内具有具有很好地生物学性质,仅在患者肾脏、唾液腺和泪腺具有一定程度的放射性凝聚,患者前列腺处原发肿瘤病灶及多处转移病灶均具有较高的探针摄取。同时,利用124I-MIP-1095在患者体内的PET/CT显像结果进行了各器官组织的辐射剂量计算,成功计算出应用131I-MIP-1095对患者进行治疗所需的剂量。
除PSMA外,前列腺干细胞抗原(PSCA)是一种高度表达于前列腺癌原发病灶与骨转移病灶的膜蛋白抗原,且表达程度与患者的预后水平密切相关。Knowles等[59]通过124I核素对anti-PSCA A11minibody进行标记,并对LAPC-9前列腺癌骨转移模型进行PET/CT显像实验,与18F-Fluoride对比结果表明,124I-anti-PSCA A11minibody具有更强的LAPC-9骨转移病灶能力,且124I-anti-PSCA A11minibody连续显像可以实时检测MDV-3100D对LAPC-9皮下肿瘤的治疗疗效。
O'Donoghue等[60]合成并制备了靶向A33抗原的124I-huA33抗体探针,将该探针经静脉滴注方式注射入结直肠癌患者体内,注射后1周进行PET/CT显像检查,结果表明,124I-huA33可以对患者体内的结直肠肿瘤病灶进行清晰的显像诊断;肿瘤组织免疫组化及放射自显影实验表明,124I-huA33在肿瘤部位的摄取程度完全依赖该部位A33抗原的表达程度,为后续应用huA33抗体进行结直肠癌放射免疫治疗提供了参考依据。
还有诸多抗体进行了124I标记并用于相应癌症的显像诊断。例如,用于结直肠癌早期诊断的124I-Anti-CEA minibodies、124I-Anti-HER2 diabody等,以及广谱性肿瘤显像诊断探针124I-SHPP和124I-MIBG等[37,42-43,61]。
4.4 分化型甲状腺癌诊断
分化程度较高的甲状腺癌癌细胞表面存有Na+/I-转运体,具有摄碘能力,因此,临床上通常应用131I进行内照射治疗此类型甲状腺癌。目前,基于124I的甲状腺癌PET/CT显像检测在甲状腺癌的分型诊断以及核素131I放疗的剂量计算方面研究较多。基于124I的PET/CT与131I的SPECT/CT显像相比,在具有摄碘能力的甲状腺癌原位及远端转移病灶诊断方面,具有很高的灵敏度及检出率。Ruhlmann等[62]对227位具有不同转移情况的甲状腺癌患者分别进行了124I的PET/CT与131I的SPECT/CT显像诊断,比较二者对具有摄碘能力的甲状腺癌转移灶检出率的区别,结果表明,124I的PET/CT与131I的SPECT/CT显像均具有较好的转移病灶检出率,但在部分患者的淋巴结转移病灶诊断方面,124I的PET/CT具有更高的检测诊断灵敏度。
5 小结
本文主要介绍了124I的理化性质,并对124I的生产方式和临床应用进行了归纳。124I理化性质优越,生产方式多样、成熟、简单与便捷,并且对于多肽或蛋白进行标记的方法简单、有效,在临床疾病显像诊断与治疗领域研究与应用较多。但是,124I较低的正电子发射比例(23%)以及超高能量的γ射线(1.7 Mev)发射等缺点,对它的临床应用造成了一定的阻碍,有待进一步依据其特性进行应用方面的开发与拓展。
参考文献:
[1] Koehler L,Gagnon K,McQuarrie S,et al.Iodine-124:a promising positron emitter for organic PET chemistry[J].Molecules,2010,15(4):2 686-2 718.
[2] Chacko A M,Divgi C R.Radiopharmaceutical chemistry with iodine-124:a non-standard radiohalogen for positron emission tomography[J].Med Chem,2011,7(5):395-412.
[3] Pentlow K S,Graham M C,Lambrecht R M,et al.Quantitative imaging of iodine-124 with PET[J].J Nucl Med,1996,37(9):1557-1562.
[4] Kondo K,Lambrecht R M,Norton E F,et al.Cyclotron isotopes and radiopharmaceuticals-ⅩⅫ.Improved targetry and radiochemistry for production of123I and124I[J].Int J Appl Radiat Isot,1977,28(9):765-771.
[5] Lambrecht R M,Sajjad M,Qureshi M A,et al.Production of iodine-124[J].Journal of Radioanalytical & Nuclear Chemistry,1988,127(2):143-150.
[6] Scholten B,Kovács Z,Tárkányi F,et al.Excitation functions of124Te(p,xn)124,123I reactions from 6 to 31MeV with special reference to the production of124I at a small cyclotron[J].Applied Radiation & Isotopes,1995,46(4):255-259.
[7] Schmitz J.The production of [124I]iodine and [86Y]yttrium[J].European Journal of Nuclear Medicine & Molecular Imaging,2011,38(1):4-9.
[8] Nagatsu K,Fukada M,Minegishi K,et al.Fully automated production of iodine-124 using a vertical beam[J].Applied Radiation & Isotopes Including Data Instrumentation & Methods for Use in Agriculture Industry & Medicine,2011,69(1):146-157.
[9] Qaim S M,Hohn A,Bastian T,et al.Some optimisation studies relevant to the production of high-purity at a small-sized cyclotron[J].Applied Radiation & Isotopes,2003,58(1):69-78.
[10] Bastian T,Coenen H H ,Qaim S M.Excitation functions of124Te(d,xn)124,125I reactions from threshold up to 14 MeV:comparative evaluation of nuclear routes for the production of124I[J].Applied Radiation & Isotopes Including Data Instrumentation & Methods for Use in Agriculture Industry & Medicine,2001,55(3):303-308.
[11] Hassan K F,Qaim S M,Saleh Z A,et al.3He-particle-induced reactions on Sb for production of124I[J].Applied Radiation & Isotopes Including Data Instrumentation & Methods for Use in Agriculture Industry & Medicine,2006,64(4):409.
[12] Van den Bosch R,De Goeij J J,Van der Heide J A,et al.A new approach to target chemistry for the iodine-123 production via the124Te(p,2n) reaction[J].Int J Appl Radiat Isot,1977,28(3):255-261.
[13] Glaser M,Mackay D B,Ranicar A S O,et al.Improved targetry and production of iodine-124 for PET studies[J].Radiochimica Acta/international Journal for Chemical Aspects of Nuclear Science & Technology,2004,92(12):951-956.
[14] Zaidi J H,Qaim S M,Stöcklin G.Excitation functions of deuteron induced nuclear reactions on natural tellurium and enriched 122 Te:Production of123I via the122Te(d,n)123I-process[J].International Journal of Applied Radiation & Isotopes,1983,34(10):1425-1430.
[15] Oberdorfer F,Helus F,Maierborst W.Experiences in the routine production ofI via the Te(p,2n)I reaction with a low energy cyclotron[J].Journal of Radioanalytical Chemistry,1981,65(1-2):51-56.
[16] Apelt H,Blessing G,Knieper J,et al.Some technical improvements in the production of123I via the124Te(p,2n)123I reaction at a compact cyclotron[J].International Journal of Applied Radiation & Isotopes,1981,32(8):581-587.
[17] Sheh Y,Koziorowski J,Balatoni J,et al.Low energy cyclotron production and chemical separation of “no carrier added” iodine-124 from a reusable,enriched tellurium-124 dioxide/aluminum oxide solid solution target[J].Radiochimica Acta,2000,88(3-4):169.
[18] Sajjad M,Bars E,Nabi H A.Optimization of124I production via124Te(p,n)124I reaction[J].Applied Radiation & Isotopes,2006,64(9):965-970.
[19] Nye J A,Avilarodriguez M A,Nickles R J.Production of [124I]-iodine on an 11MeV cyclotron[J].Radiochimica Acta,2006,94(4):213-216.
[20] Alekseev I E,Darmograi V V,Marchenkov N S.Development of diffusion-thermal methods for preparing67Cu and124I for radionuclide therapy and positron emission tomography[J].Radiochemistry,2005,47(5):502-509.
[21] Smith G E,Sladen H L,Biagini S C,et al.Inorganic approaches for radiolabelling biomolecules with fluorine-18 for imaging with positron emission tomography[J].Dalton Trans,2011,40(23):6196.
[22] Knust E J,Dutschka K,Weinreich R.Preparation of124I solutions after thermodistillation of irradiated124TeO2targets[J].Applied Radiation & Isotopes,2000,52(2):181-184.
[23] Blasberg R,Roelcke U,Weinreich R.[124I]-iododeoxyuridine imaging tumor proliferation[J].Journal of Nuclear Medicine,1996,37(Suppl 5):106-128.
[24] Van d B R,De Goeij J J,Ja V D H,et al.A new approach to target chemistry for the iodine-123 production via the124Te(p,2n) reaction[J].International Journal of Applied Radiation & Isotopes,1977,28(3):255.
[25] Shikata E,Amano H.Dry-distillation of iodine-131from several tellurium compounds[J].Journal of Nuclear Science & Technology,1973,10(10):80-88.
[26] Braghirolli A M S,Waissmann W,Silva J B D,et al.Production of iodine-124 and its applications in nuclear medicine[J].Applied Radiation & Isotopes,2014,90(90C):138-148.
[27] Zweit J,Sharma H L,Goodall R,et al.Excitation functions of proton induced reactions in natural tellurium:production of no carrier added I-124 for PET applications[J].Proceed- ings of the Fourth International Workshop on Targetry and Target Chemistry,1991,63(5):76-78.
[28] Robinson M K,Doss M,Shaller C,et al.Quantitative immuno-positron emission tomography imaging of HER2-positive tumor xenografts with an iodine-124 labeled anti-HER2 diabody[J].Cancer Research,2005,65(4):1471-1478.
[29] Dekker B,Keen H,Shaw D,et al.Functional comparison of annexin V analogues labeled indirectly and directly with iodine-124[J].Nuclear Medicine & Biology,2005,32(4):403.
[30] Verel I,Visser G W M,Vosjan M J W D,et al.High-quality124I-labelled monoclonal antibodies for use as PET scouting agents prior to131I-radioimmunotherapy[J].European Journal of Nuclear Medicine & Molecular Imaging,2004,31(12):1645-1652.
[31] Verel I,Visser G W,Boerman O C,et al.Long-lived positron emitters zirconium-89 and iodine-124 for scouting of therapeutic radioimmunoconjugates with PET[J].Cancer Biotherapy & Radiopharmaceuticals,2003,18(4):655.
[32] Sundaresan G,Yazaki P J,Shively J E,et al.124I-labeled engineered anti-CEA minibodies and diabodies allow high-contrast,antigen-specific small-animal PET imaging of xenografts in athymic mice[J].Journal of Nuclear Medicine Official Publication Society of Nuclear Medicine,2003,44(12):1962-1969.
[33] Glaser M,Brown D J,Law M P,et al.Preparation of no-carrier-added [124I] A14-iodoinsulin as a radiotracer for positron emission tomography[J].Journal of Labelled Compounds & Radiopharmaceuticals,2001,44(6):465-480.
[34] Daghighian F,Pentlow K S,Larson S M,et al.Development of a method to measure kinetics of radiolabelled monoclonal antibody in human tumour with applications to microdosimetry:positron emission tomography studies of iodine-124 labelled 3F8 monoclonal antibody in glioma[J].European Journal of Nuclear Medicine,1993,20(5):402-409.
[35] Westera G,Reist H W,Buchegger F,et al.Radioimmuno positron emission tomography with monoclonal antibodies:a new approach to quantifying in vivo tumour concentration and biodistribution for radioimmunotherapy[J].Nuclear Medicine Communications,1991,12(5):429.
[36] Bakir M A,Eccles S,Babich J W,et al.C-erbB2 protein overexpression in breast cancer as a target for PET using iodine-124-labeled monoclonal antibodies[J].Journal of Nuclear Medicine Official Publication Society of Nuclear Medicine,1992,33(12):2 154-2 160.
[37] Glaser M,Carroll V A,Collingridge D R,et al.Preparation of the iodine-124 derivative of the Bolton-Hunter reagent ([124I]I-SHPP) and its use for labelling a VEGF antibody as a PET tracer[J].Journal of Labelled Compounds & Radiopharmaceuticals,2002,45(12):1077-1090.
[38] Divgi C R,Pandit-Taskar N,Jungbluth A A,et al.Preoperative characterisation of clear-cell renal carcinoma using iodine-124-labelled antibody chimeric G250 (I-cG250) and PET in patients with renal masses:a phase I trial[J].Lancet Oncology,2007,8(4):304-310.
[39] Brouwers A H,Dorr U,Lang O,et al.131I-cG250 monoclonal antibody immunoscintigraphy versus [18F]FDG-PET imaging in patients with metastatic renal cell carcinoma:a comparative study[J].Nucl Med Commun,2002,23(3):229-236.
[40] Pryma D A,O'Donoghue J A,Humm J L,et al.Correlation of in vivo and in vitro measures of carbonic anhydrase IX antigen expression in renal masses using antibody124I-cG250[J].J Nucl Med,2011,52(4):535-540.
[41] Salacinski P,Hope J,Mclean C.Iodination of proteins glycoproteins and peptides using a solid phase oxidizing agent (IODO-GEN)[J].Analytical Biochemistry,1981:117-146.
[42] Lee F T,Hall C,Rigopoulos A,et al.Immuno-PET of human colon xenograft- bearing BALB/c nude mice using124I-CDR-grafted humanized A33 monoclonal antibody[J].Journal of Nuclear Medicine Official Publication Society of Nuclear Medicine,2001,42(5):764.
[43] Sundaresan G,Yazaki P J,Shively J E,et al.124I-labeled engineered anti-CEA minibodies and diabodies allow high-contrast,antigen-specific small-animal PET imaging of xenografts in athymic mice[J].Journal of Nuclear Medicine Official Publication Society of Nuclear Medicine,2003,44(12):1962-1969.
[44] Guenther I,Wyer L,Knust E J,et al.Radiosynthesis and quality assurance of 5-[124I]Iodo-2′-deoxyuridine for functional PET imaging of cell proliferation[J].Nuclear Medicine & Biology,1998,25(4):359-365.
[45] Blasberg R,Roelcke U R,Beattie B,et al.Imaging brain tumor proliferative activity with [124I]iododeoxyuridine[J].Cancer Research,2000,60(3):624-635.
[46] Roelcke U,Hausmann O,Merlo A,et al.PET imaging drug distribution after intratumoral injection:the case for (124)I-iododeoxyuridine in malignant gliomas[J].Journal of Nuclear Medicine Official Publication Society of Nuclear Medicine,2002,43(11):1444-1451.
[47] Tjuvajev J G,Doubrovin M,Akhurst T,et al.Comparison of radiolabeled nucleoside probes (FIAU,FHBG,and FHPG) for PET imaging of HSV1-tk gene expression[J].J Nucl Med,2002,43(8):1072-1083.
[48] Dekker B,Keen H,Lyons S,et al.MBP-annexin V radiolabeled directly with iodine-124 can be used to image apoptosis in vivo using PET[J].Nuclear Medicine & Biology,2005,32(3):241.
[49] Reischl G,Dorow D S,Cullinane C,et al.Imaging of tumor hypoxia with [I-124] IAZA in comparison with [F-18] FMISO and [F-18]FAZA - first small animal PET results[J].Journal of Pharmacy & Pharmaceutical Sciences,2007,10(2):203-211.
[50] Bading J R,Shields A F.Imaging of cell proliferation:status and prospects[J].Journal of Nuclear Medicine Official Publication Society of Nuclear Medicine,2008,49 (Suppl 2):64S.
[51] Blasberg R G,Roelcke U,Weinreich R,et al.Imaging brain tumor proliferative activity with [124I]iododeoxyuridine[J].Cancer Res,2000,60(3):624-635.
[52] Fadok V A,Voelker D R,Campbell P,et al.Exposure of phosphatidylserine on the surface of apoptotic lymphocytes triggers specific recognition and removal by macrophages[J].J Immunol,1992,148(7):2 207-2 216.
[53] Verel I,Visser G W,Boerman O C,et al.Long-lived positron emitters zirconium-89 and iodine-124 for scouting of therapeutic radioimmunoconjugates with PET[J].Cancer Biother Radiopharm,2003,18(4):655-661.
[54] van Dongen G A,Visser G W,Lub-de Hooge M N,et al.Immuno-PET:a navigator in monoclonal antibody development and applications[J].Oncologist,2007,12(12):1379.
[55] Verel I V,Visser G W,Dongen G A.The promise of immuno-PET in radioimmunotherapy[J].Journal of Nuclear Medicine,2005,46(Suppl 1):164S-171S.
[56] Nayak T K,Brechbiel M W.Radioimmunoimaging with longer-lived positron-emitting radionuclides:potentials and challenges[J].Bioconjug Chem,2009,20(5):825.
[57] Wilbur D S,Hadley S W,Hylarides M D,et al.Development of a stable radioiodinating reagent to label monoclonal antibodies for radiotherapy of cancer[J].Journal of Nuclear Medicine,1989,30(2):216-226.
[58] Zechmann C M,Afsharoromieh A,Armor T,et al.Radiation dosimetry and first therapy results with a124I/131I-labeled small molecule (MIP-1095) targeting PSMA for prostate cancer therapy[J].European Journal of Nuclear Medicine & Molecular Imaging,2014,41(7):1280-1292.
[59] Knowles S M,Tavare R,Zettlitz K A,et al.Applications of immunoPET:using124I-anti-PSCA A11minibody for imaging disease progression and response to therapy in mouse xenograft models of prostate cancer[J].Clin Cancer Res,2014,20(24):6 367-6 378.
[60] O’Donoghue J A,Smith-Jones P M,Humm J L,et al.124I-huA33 antibody uptake is driven by A33 antigen concentration in tissues from colorectal cancer patients imaged by immuno-PET[J].J Nucl Med,2011,52(12):1878-1885.
[61] Lee C L,Wahnishe H,Sayre G A,et al.Radiation dose estimation using preclinical imaging with124I-metaiodobenzylguanidine (MIBG) PET[J].Medical Physics,2010,37(9):4 861-4 867.
[62] Ruhlmann M,Jentzen W,Ruhlmann V,et al.High level of agreement between pretherapeutic124I PET and intratherapeutic131I imaging in detecting iodine-positive thyroid cancer metastases[J].J Nucl Med,2016,57(9):1339-1342.

