99mTc-放射性药物的现状和展望
田佳乐,贾红梅
(放射性药物教育部重点实验室 北京师范大学 化学学院,北京 100875)
根据世界核协会(World Nuclear Association)的统计,2016年,全球放射性同位素市场价值96亿美元,预计到2021年将达到约170亿美元,其中医用放射性同位素约占80%[1]。众所周知,在医用放射性核素中,99mTc为最佳单光子显像核素(T1/2=6.01h,Eγ=140keV),可以从99Mo-99mTc发生器方便得到,99mTc-放射性药物可以通过其药盒化(kit)的标记前体方便制备,因此,99mTc被誉为核医学的“战马”。此外,锝具有从-1价到+7价的各种化学价态,其丰富的配位化学性质为设计合成具有不同生物分布特性的锝放射性药物提供了广阔的应用前景。目前,用于临床的99mTc-放射性药物可以对人体所有脏器进行显像,其SPECT显像年检查总数约有4000万人次,约占全球所有核医学诊断总数的80%。在中国,2015年的单光子显像年检查总数占核医学诊断总数的82%[2]。其中,99mTc-放射性药物是用于临床单光子显像的主要药物。
根据99mTc在药物分子中起到的作用不同,99mTc-放射性药物可分为两类:“99mTc-essential”放射性药物和“99mTc-tagged”放射性药物。“99mTc-essential”放射性药物的特点是:99mTc是药物分子的重要组成部分,且决定药物分子的理化性质和生物靶向性,药物分子若没有99mTc即失去靶向目标器官或组织或靶向特异受体等功能。“99mTc-tagged”放射性药物的特点是单抗、多肽或激素等生物靶向分子通过直接标记法或通过双功能联接剂(bifunctional conjugating agents,BFCA,指的是既含有与99mTc配位的基团,又含有与生物大分子反应形成共价结合的功能基团)与99mTc联接,且99mTc的引入基本不影响这些生物靶向分子的性质,只起示踪作用[3]。
纵观锝放射性药物的发展,根据其生物分布性质和制备方法可以将其分成3个发展阶段[4]。第一代99mTc-放射性药物指的是目前临床上广泛使用的灌注显像剂,主要用于器官或组织(如脑、心肌、肝、肺、肾等器官)的灌注显像。这些药物可以通过即时药盒方便制备,其特点是以锝为核心,即配体与99mTc配位前不具有生物活性,属于“99mTc-essential”放射性药物;该类99mTc-放射性药物的生物分布性质主要由脂溶性、电荷和配合物大小等理化性质决定。第二代99mTc-放射性药物指的是特异靶向的示踪剂,如与特异受体结合的99mTc-放射性药物;该类放射性药物的特点是通过双功能联接剂方法制备,99mTc的引入基本不影响生物靶向分子与特异受体的结合。第三代99mTc-放射性药物指的是利用整体法设计的靶向特异受体等生物大分子的99mTc-放射性药物,即用99mTc-螯合基团替换受体配体分子的一部分结构,尽量保持原有配体分子的大小、形状和结构,也属于“99mTc-essential”放射性药物;与第一代99mTc-放射性药物不同的是,这些药物靶向特异受体等生物大分子,而不是靶向器官的灌注显像剂。
本文介绍临床上正在使用的、处于临床试验阶段或临床研究阶段的99mTc-放射性药物,根据99mTc-放射性药物的特点和靶向性,对99mTc-放射性药物的发展前景和发展趋势进行评述。
1 99mTc-放射性药物的临床使用现状和研究进展
1.1 正在临床使用的99mTc-放射性药物
美国食品药品监督管理局(FDA)批准的正在临床使用的锝[99mTc]放射性药物列于表1。其中,99mTc tilmanocept是FDA于2013年3月批准的前哨淋巴结(sentinel lymph node,SLN)显像剂,通过与巨噬细胞和树突状细胞表面甘露糖受体(mannose receptor,也称为CD206)特异性结合而浓集于淋巴组织,用于乳腺癌和黑色素瘤的术中淋巴结定位。

表1 FDA批准的正在临床使用的99mTc-放射性药物1)Table 1 Examples of FDA-approved 99mTc-radiopharmaceuticals used in clinic
注:1) https:∥www.fda.gov.
Tilmanocept是二亚乙基三胺五乙酸甘露糖右旋糖苷(DTPA mannosyl detran)的通用名,由多个甘露糖、DTPA片段以及葡聚糖骨架(右旋糖酐,detran)组成的分子,平均直径为7 nm[5]。其中,甘露糖是与甘露糖受体的结合部位,DTPA与99mTc螯合形成配合物。与99mTc标记的硫胶体(99mTc Sulphur Colloid,整体尺寸相对较大且颗粒大小不均)和99mTc标记的人血清白蛋白(human serum albumin,HSA)纳米胶体(4~80 nm)等非特异前哨淋巴结显像剂相比,99mTc tilmanocept具有快速浓集于前哨淋巴结、从注射部位快速清除以及在其余各级淋巴结摄取低等优点。值得一提的是,临床级别的右旋糖酐具有分子粒径均匀、便宜、安全和溶于水等特点,可以将多个功能基团(包括与特异受体结合的靶向分子、与99mTc或其他放射性金属核素螯合的双功能联接剂)引入到该大分子骨架上。99mTc tilmanocept不仅是近年来前哨淋巴结显像剂的突出成果,而且其设计策略为设计性质更优的前哨淋巴结显像剂以及设计多模态显像剂提供了很好的借鉴作用[6]。
中国国家食品药品监督管理局(CFDA)批准的正在临床使用的锝[99mTc]放射性药物列于表2,含10种99mTc-放射性药物。需要指出的是,目前CFDA网站上的锝[99mTc]放射性药物是正在临床使用的药物,与收入到中国药典中的锝[99mTc]放射性药物不完全相同。锝[99mTc]亚甲基二膦酸盐注射液、锝[99mTc]依替菲宁注射液、锝[99mTc]喷替酸盐注射液、锝[99mTc]植酸盐注射液、锝[99mTc]焦磷酸盐注射液、锝[99mTc]聚合白蛋白注射液、锝[99mTc]双半胱氨酸注射液、锝[99mTc]双半胱乙脂注射液、锝[99mTc]甲氧异腈注射液和高锝[99mTc]酸钠注射液,以及注射用亚锡亚甲基二磷酸盐、注射用亚锡依替菲宁、注射用亚锡喷替酸、注射用亚锡植酸钠、注射用亚锡焦磷酸钠、注射用亚锡聚合白蛋白药盒被收入2015年中国药典。值得一提的是,锝[99mTc]亚甲基二膦酸盐注射液用于骨显像,而锝[99Tc]亚甲基二膦酸盐注射液(商品名为云克)被CFDA批准用于治疗类风湿性关节炎、骨质疏松等疾病,后者是中国自主研制成功的高效低毒放射性治疗药物。

表2 CFDA批准的正在临床使用的99mTc-放射性药物1)Table 2 Examples of CFDA-approved 99mTc-radiopharmaceuticals used in clinic
注:1) http:∥app2.sfda.gov.cn
此外,99mTc-DTPA-半乳糖人血清白蛋白(99mTc-GSA)是去唾液酸糖蛋白受体(Asialoglycoprotein receptor,ASGP-R)的特异性配体,注射后可迅速浓集到肝脏,30 min即可清晰成像。其注射液于1992年在日本批准上市。由于去唾液酸糖蛋白受体与肝实质细胞功能直接相关,术前用99mTc-GSA进行肝受体显像,不仅可以定量评估肝脏整体功能,而且可以评估剩余(局部)肝脏功能、估计安全切除的范围,预测手术风险等。该显像剂主要用于急、慢性肝脏疾病、肝硬化、怀疑肝脏占位性病变拟进行肝脏手术切除等需评价肝功能的患者。我国目前已经研制成功该显像剂的配套药盒[7],具有标记方法简便、标记率高,利于临床使用等优点,该显像剂在我国处于临床研究阶段。
1.2 处于临床试验阶段或临床研究阶段的99mTc-放射性药物
处于临床试验阶段或临床研究阶段的部分99mTc-放射性药物列于表3。
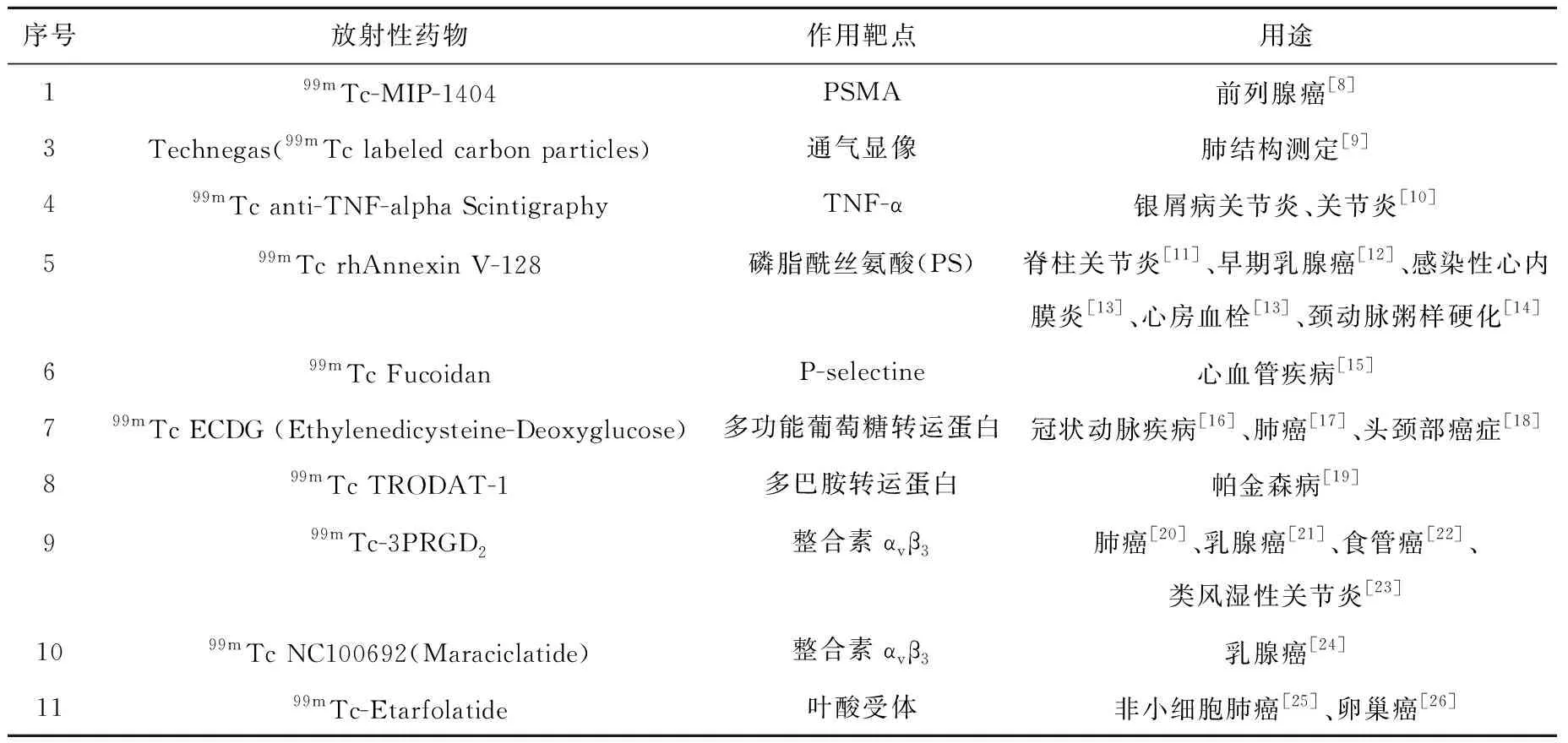
表3 处于临床试验阶段或临床研究阶段的部分99mTc-放射性药物1)Table 3 Examples of 99mTc-radiopharmaceuticals used in clinical trials or clinical studies
注:1) https:∥clinicaltrials.gov
1.2.1靶向前列腺特异性膜抗原(PSMA)的探针
前列腺特异性膜抗原(prostate specific membrane antigen,PSMA)也称为叶酸水解酶Ⅰ或谷氨酸羧肽酶Ⅱ,是一种在前列腺癌上皮细胞中高表达的金属肽酶[27],尤其在低分化和转移性前列腺癌细胞中高度过表达[28-29],是诊断和治疗前列腺癌高特异性、高敏感性的理想靶标。近年来,靶向PSMA的放射性药物已成为前列腺癌领域的研究热点。迄今为止,靶向PSMA的18F和68Ga等标记的PET显像剂、123I和99mTc等标记的SPECT显像剂以及177Lu等标记的用于治疗的放射性药物相继报道,有些药物已经进入临床试验阶段[30-31]。其中,99mTc-MIP-1404目前已经完成三期临床试验[8],有可能成为第一个被批准进入临床使用的靶向PSMA的放射性药物。
99mTc-MIP-1404是第一个用于人体临床试验的第三代锝放射性药物,它是含有谷氨酸-尿素-谷氨酸药效团的小分子PSMA抑制剂,通过第二代单氨基酸螯合剂(single-amino-acid chelator,SAAC)TIM与99mTc(CO)3形成配合物,对PSMA有纳摩尔亲和性(Kd=1.07 nmol/L,LNCaP细胞)。荷LNCaP肿瘤裸鼠的生物分布结果表明,该示踪剂从肾脏和大多数非靶组织快速清除,注射后4 h的肿瘤摄取值为11.0%ID/g,肿瘤/血比和肿瘤/骨骼肌比分别是550和157,SPECT显像结果也表明该配合物仅在表达PMSA的肾脏和肿瘤部位特异摄取,通过膀胱清除[32]。与含有谷氨酸-尿素-赖氨酸药效团的99mTc-MIP-1405相比[33],99mTc-MIP-1404浓集于膀胱的放射性相对较低,且能检测到前列腺癌患者中大多数骨转移病灶和软组织病灶。此外,当前列腺癌患者的前列腺特异抗原(prostate specific antigen,PSA)水平大于2μg/L或低于该阈值时,99mTc-MIP-1404 SPECT/CT显像的检出率分别为90%和54%(225名患者)[34],说明99mTc-MIP-1404对PSMA阳性病灶的检测与定位比较成功。
此外,99mTc-EDDA/HYNIC-iPSMA在前列腺癌患者中显示高的肿瘤特异性摄取,平均肿瘤/背景比为8.99(3 h),能够检测骨、软组织和淋巴结中的转移病灶,也是非常有希望的靶向PSMA的99mTc放射性药物[35]。
1.2.2靶向CD20抗原的探针
前哨淋巴结(SLN)转移与否是乳腺癌最重要的预后因素,如何准确定位SLN进行分期至关重要。Rituximab(利妥昔单抗,商品名:美罗华)是一种靶向B淋巴细胞表面CD20抗原的人鼠嵌合单克隆抗体,通过与CD20特异性结合而定位于SLN中[36],于1997年被FDA批准用于治疗B细胞非霍奇金淋巴瘤。北京大学肿瘤医院首次将99mTc-Rituximab用于SLN显像。在2 217名患者的临床研究中,99mTc-Rituximab SLN显像和前哨淋巴结活检(SLNB)的成功率分别为98.8%和99.9%,表明99mTc-Rituximab是一种安全有效的SLN显像剂。99mTc-Rituximab能有效提升乳腺癌患者手术切除的精准性,降低手术创面,提高术后生活质量,目前已经成为乳腺癌病人手术前的常规检查手段,同时,该检测方法还用于黑色素瘤SLN的活检指导[37]。此外,99mTc-Rituximab还可用于非霍奇金淋巴瘤的显像[38]和评估炎症性自身免疫性疾病患者受影响器官的B淋巴细胞浸润情况[39]。
1.2.3靶向整合素αvβ3的探针
整合素αvβ3在正常组织和成熟血管内皮细胞内低表达或不表达,在新生血管内皮细胞表面和多种恶性肿瘤如乳腺癌、肺癌、前列腺癌细胞表面高表达,其表达与肿瘤新生血管的形成、侵袭与转移密切相关[40-41]。
(1)99mTc-3PRGD2
99mTc-联肼尼克酰胺-3聚乙二醇-精氨酸-甘氨酸-天冬氨酸环肽二聚体(99mTc-HYNIC-3PEG4-E[c(RGDfK)2],99mTc-3PRGD2)是一种99mTc标记的二聚环状RGD肽,对整合素αvβ3具有高亲和性(IC50= 9.07 nmol/L)。该药物在裸鼠模型中具有良好的药代动力学,在非人灵长类动物食蟹猴体内以及临床研究中均显示出快速血清除率,通过肾脏迅速清除出体外[42-43]。作为一种肿瘤显像剂,99mTc-3PRGD2对恶性肺癌十分敏感,能够检测出大部分淋巴结与骨转移,而在良性肿瘤中则显示出较低的T/B值[44]。在最新的99mTc-3PRGD2多中心临床研究中,当99mTc-3PRGD2与18F-FDG灵敏度相当(88.3% vs 90.7%,P=0.557)时,99mTc-3PRGD2SPECT/CT在单区域淋巴结转移的诊断中显示出比18F-FDG PET/CT更高的特异性(94.6% vs 75.0%,P=0.008),而在肺癌诊断中与18F-FDG PET/CT无显著性差异,是一种极具前景的肿瘤显像剂[45]。此外,99mTc-3PRGD2也用于监测肝纤维化的进程与恢复[46]以及类风湿性关节炎的平面成像[47]。目前,99mTc-3PRGD2已用于乳腺病变的鉴别诊断[48]、类风湿性关节炎的早期诊断[49]、晚期肺腺癌的疗效评价与预后[50]等临床研究,该药物已经获得CFDA批准进行临床试验。
(2)99mTc-NC100692(Maraciclatide)
99mTc-NC100692是一种含有RGD序列的螯合肽,与整合素αvβ3以高亲和力(Ki≈1nmol/L)特异性结合[51]。在对恶性乳腺肿瘤显像的有效性和安全性评估试验[52]中,99mTc-NC100692检测出22个恶性病灶中的19个(86%),具有良好的安全性和耐受性。在8例高度怀疑为乳腺癌的患者中,99mTc-NC100692配合专用γ相机LumaGEM进行闪烁显像,检测出11个恶性肿瘤中的9个,大小为6~20 mm[53]。另外,还进行了99mTc-NC100692检测乳腺癌或肺癌转移病灶的可行性的临床试验。在10名乳腺癌患者中,99mTc-NC100692检测出7个肝转移病灶中的1个,5个肺转移病灶中的4个,17个骨转移病灶中的8个,1个脑转移病灶中的1个。15名肺癌患者中,检测出2个肝转移病灶中的0个,18个肺部病灶中的17个,2个骨转移病灶中的2个,9个脑转移病灶中的7个。以上结果说明99mTc-NC100692在检测乳腺癌和肺癌的肺部和脑部转移是可行的,而对肝脏和骨骼转移的检测则较差[54]。目前,99mTc-NC100692已完成二期临床研究[24]。
1.2.4靶向磷脂酰丝氨酸(PS)的探针
在细胞凋亡早期,原本位于细胞膜内层的磷脂酰丝氨酸(PS)翻转,暴露于细胞膜外表面。在钙离子存在下,人体内源性蛋白膜联蛋白V(Annexin V)能够与PS紧密结合(Kd=0.1nmol/L)[55]。用不同的放射性核素标记Annexin V可以对细胞凋亡进行可视化成像。其中,99mTc标记的Annexin V是迄今为止研究最深入、应用最广泛的细胞凋亡显像剂,已有多种利用不同类型螯合剂和共配体开发出的99mTc-Annexin V放射性药物[56]。
99mTc-BTAP-Annexin V(也称为99mTc-Apomate)是99mTc-N2S2核心配合物,也是第一个用于人体试验的99mTc-Annexin V放射性药物。一期临床研究结果显示,其放射性随时间主要浓集于肾、肝和膀胱中。该药物已成功用于急性心脏移植排斥和心内肿瘤的细胞凋亡显像,以及肺癌、乳腺癌、淋巴瘤患者化放疗诱导的细胞凋亡显像。但是,该显像剂显示快速肠排泄,可能会妨碍其在腹部区域的细胞凋亡显像[57-58]。此外,该显像剂制备时间长,放射化学产率相对较低,不利于其临床应用。
另一种99mTc标记的Annexin V药物99mTc-i-Annexin V也进入了临床试验,主要浓集于肾脏,肝脏的放射性浓集相对较低,主要通过尿液排出体外,生物半衰期为62 h。从剂量学的角度来看,99mTc-i-Annexin V十分适合于细胞凋亡成像[59]。但是,利用药盒制备99mTc-i-Annexin V时存在标记率低和放射化学纯度低的问题,不适于临床使用。
目前,99mTc-HYNIC-Annexin V是临床使用最广泛的99mTc-Annexin V放射性药物[60-62]。它具有良好的生物分布性质,几乎全部通过尿液排出,可以用于腹部及胸部的细胞凋亡成像[63]。此外,99mTc-HYNIC-Annexin V的制备过程只需要一步反应,不仅简便快捷,而且放射化学产率高,不需要纯化,产品的比活度高,适合常规生产和临床应用[64-65]。
1.2.5靶向叶酸受体的探针
相对于正常细胞,叶酸受体在卵巢癌、乳腺癌、子宫内膜癌、非小细胞肺癌等许多源于上皮组织的恶性肿瘤细胞中高度表达[66]。对于乳腺癌等,叶酸受体的表达与肿瘤的分级和预后关系密切。因此,叶酸受体已成为抗癌药物的潜在靶点,放射性核素标记的靶向叶酸受体的探针则可以对叶酸受体进行无创显像,从而检测靶向叶酸受体抗癌药物的治疗疗效。99mTc-Etarfolatide也称为99mTc-EC20,是99mTcO-N3S核心标记的叶酸衍生物,与叶酸受体亲和性高并特异结合[67]。临床试验[68]结果表明,99mTc-Etarfolatide在肾脏和膀胱摄取高,代谢途径为尿排泄,可以进行肿瘤和炎症细胞显像。但是,该显像剂肝脏摄取较高,不能用于肝脏转移病灶的检测。作为叶酸受体显像剂和抗癌药物Vintafolide(EC145)、EC1456的伴侣显像剂,99mTc-Etarfolatide已进行过大量临床试验[69-72]。由于Vintafolide没有预期的治疗效果,已停止Vintafolide的临床研究,也撤销了它在欧洲药品管理局(EMA)的上市申请[73]。目前,99mTc-Etarfolatide与EC1456一起正在进行一期临床试验[25-26]。
1.2.6靶向多功能葡萄糖转运蛋白的探针/代谢显像剂
18F-FDG被誉为“世纪分子”,研究能与18F-FDG性质相当的99mTc标记的代谢显像剂一直是努力的方向。与18F-FDG类似,99mTc标记的双半胱氨酸-脱氧葡萄糖(99mTc-ethylenedicysteine-deoxyglucose,99mTc-ECDG)能够经多功能葡萄糖转运蛋白进入细胞内,对肿瘤进行显像。研究表明,99mTc-ECDG在肺肿瘤细胞系中的摄取与18F-FDG相当,在细胞内的摄取机制与代谢途径与18F-FDG类似,能够用于肿瘤成像[74]以及肿瘤治疗疗效评估[75]。临床试验[76]发现,99mTc-ECDG具有高靶/非靶比、浓集程度与疾病严重程度正相关以及安全有效等特点,在对晚期头颈部鳞状细胞癌局部放化疗的早期反应的评价中,显示出较好的初步结果[77]。另外,99mTc-ECDG还可用于类风湿性关节炎的诊断与疗效评估,具有区分退行性和炎症性关节疾病、评估炎症过程、评估肿瘤生长以及对轻度和早期疾病的诊断等方面的潜力[76]。尽管与18F-FDG在分子结构、全身分布以及生物动力学方面有许多相似之处,99mTc-ECDG与18F-FDG仍具有许多不同,例如,18F-FDG在脑和心肌显示出高摄取,而99mTc-ECDG不能穿过血脑屏障,在心肌摄取也较少。
可喜的是,我国学者Zhang等[78]报道的以脱氧葡萄糖为生物靶向分子,通过结构修饰合成的99mTc标记的葡萄糖类衍生物在动物实验中具有与18F-FDG相当的性质,期待后续临床研究结果和动物实验一致,实现99mTc标记的放射性药物的突破。
1.3 计算化学在99mTc-放射性药物中的应用
2 99mTc-放射性药物的发展趋势
2.1 99mTc-放射性药物将继续发挥重要作用
自美国2015年提出精准医学(precision medicine)计划以来,中国也启动了精准医疗研究计划。精准医疗的提出,提供了实现新的医学突破的前所未有的最好机会。众所周知,CT、超声和MRI分子影像技术可以显示人体解剖结构和生理功能,主要用于解剖学诊断,而核成像和光学成像技术可以在尚无解剖病变前检出疾病的异常,提供功能的、代谢的、分子水平的信息。PET/CT、PET/MRI和SPECT/CT等融合技术在临床上的广泛应用,既可以提供解剖学信息,又可以从分子水平上显示活体代谢和功能变化的不同生物过程,从分子或细胞水平上揭示疾病产生的机理。因此,利用分子影像技术,在体定量观察分子水平生物改变是实现精准医学的最佳途径。由于只有利用PET或SPECT分子探针,PET/CT、PET/MRI和SPECT/CT等融合技术才能显示活体的不同生物过程。因此,PET和SPECT放射性药物是实现精准医学的核心。现代分子核医学需要各种靶向的放射性药物,决定其价值的关键因素是放射性示踪剂对特定靶点的选择性和特异性。
根据1980—2012期间PET和SPECT发表论文统计(PubMed),21世纪以来,尽管PET和SPECT均呈现发展趋势,但PET论文呈指数倍增,远远高出SPECT论文发表数量[83]。因此,PET放射性药物近年来呈快速发展势头,其未来的发展速度有可能超过SPECT放射性药物的发展。但是,若考虑临床显像仪器数量、诊断费用以及放射性诊断核素来源方便等因素,临床上使用的99mTc标记的放射性药物的SPECT显像仍占临床放射性药物诊断总数的70%~80%。就中国而言,截至2015年12月31日,我国共有正电子显像设备246台,PET(CT)年检查总数46.936 4万例,单光子显像设备774台,单光子显像年检查总数210.628 3万例[2]。从以上数据看,SPECT的数量远远多于PET,SPECT显像仍是核医学临床诊断疾病的主要手段,而99mTc-放射性药物占临床SPECT显像的绝大部分。与PET药物相比,99mTc-放射性药物起步更早,发展更成熟,SPECT显像仪器更普及,显像成本更低,在目前和未来的很长一段时间内,99mTc-放射性药物仍会保持在核医学临床诊断中的领军地位,尤其是在包括我国在内的发展中国家的医院和核医学中心中,99mTc-放射性药物的地位在未来一段时间内仍将不可替代。此外,不同于正电子核素,单光子核素显像的分辨率不存在理论极限,不断改进SPECT,提高其探测效率,定量SPECT的时代即将到来[84-85]。如碲锌镉(CZT)探测器可直接将γ光子转化为电信号,CZT探测器SPECT可以大幅提高空间分辨率、能量分辨率和灵敏度等,并减少显像剂注射剂量,缩短扫描时间[86]。因此,综合考虑临床显像仪器数量、仪器的不断发展、诊断费用、放射性诊断核素来源方便以及在分子水平上实现真正功能诊断方面等因素,99mTc标记的放射性药物未来仍将继续发挥重要作用,与其他SPECT药物和PET药物将继续在诊断人类疾病方面发挥重要作用,优势互补,平行发展[87]。
2.2 99mTc-放射性药物将推动188Re-放射性治疗药物的发展
在治疗领域,诊断治疗双功能放射性核素(dual-purpose theragnostic radionuclides)也是目前热点之一,即利用特异“诊断治疗双功能放射性核素”或“诊断/治疗放射性核素对”,对同一患者首先进行治疗前低剂量的显像(利用发射正电子或单光子的放射性核素进行PET/CT或SPECT/CT显像),根据得到的药物分布、剂量和最大耐受剂量等信息探索得到最有效治疗所需要的放射性治疗剂量,然后再实施放射性核素高剂量治疗,达到对癌症患者的个性化治疗。诊断治疗的理想情况是利用同一放射性核素对癌症患者既进行诊断又实施治疗,其次是应用具有相同电子结构的“诊断/治疗放射性核素对”[88]。由于镧系收缩,锝铼性质极为相似,99mTc标记的配合物结构常利用制备其相应的铼配合物来确定。而188Re也具有优良的核性质,可以很方便地从188W-188Re发生器得到,是一种极具前途的治疗用放射性核素。因此,99mTc和188Re是一对理想的“诊断/治疗放射性核素对”。利用99mTc标记的显像剂对肿瘤进行显像,得到肿瘤相关信息,确定放射性核素治疗的最佳剂量。然后利用188Re标记的放射性药物对肿瘤进行针对性地靶向分子治疗。由于不同癌症患者的肿瘤所处的状态不同,根据99mTc标记的示踪剂显示的肿瘤状态不同,确定其相应的188Re标记的放射性药物的肿瘤治疗方案。因此,加强99mTc/188Re标记的诊断治疗双功能放射性药物的研究,推动“诊断/治疗放射性核素对”的临床使用,能加速实现癌症患者的个性化诊断和治疗[89]。
2.3 99mTc-放射性药物的发展趋势
众所周知,利用分子影像技术,结合反映特异生命过程的可视化分子探针可以在活体水平上无创、高灵敏地显示人体生物化学过程,是实现精准医疗最直接的手段。因此,需要发掘反映活体特异生物化学过程的新靶点,并探索开发相应的靶向分子。对于给定的靶点,需要选择最合适的放射性核素,设计合成对特定受体等靶点亲和性高和特异性高的靶向分子探针。对于99mTc标记的放射性药物,靶向肿瘤、心血管系统、中枢神经系统(CNS)、炎症感染等分子探针仍旧是其重点研究方向。
需要指出的是,与11C、18F和123I等放射性核素不同,在有机小分子先导化合物中引入99mTc的同时,需要同时引入与锝配位的螯合剂。而锝及其螯合基团的引入通常会改变整个锝配合物的体积、构型,进而会改变配合物对相应受体的亲和性和选择性。因此,99mTc标记的小分子SPECT显像剂会面临极大的挑战。对于99mTc标记的CNS受体显像剂,进脑量低一直是限制其发展的瓶颈。迄今为止,只有99mTc-TRODAT-1进入临床试验阶段[19]。临床正在使用或处于临床试验阶段的CNS显像剂主要为11C或18F标记的放射性药物。但是,值得一提的是,随着第三代99mTc标记的放射性药物的研发,尤其是三羰基环戊二烯基锝([(Cp-R)99mTc(CO)3])核心的配合物,不但对特异靶点具有合适的亲和性和选择性,而且具有较高的脑摄取值。近年来,我国在99mTc标记的脑内β-淀粉样蛋白(Aβ)显像剂和脑σ受体显像剂领域取得了很大进展。其中,Zhang等[90]设计的99mTcO-N2S2核心标记的配合物是首例用于猴子显像的99mTc标记的Aβ斑块显像剂,该配合物对Aβ1-42蛋白具有高亲和性(Ki=13.4 nmol/L),在ICR小鼠的初始脑摄取值达2.10%ID/g(2min),在恒河猴脑摄取为1.94%~2.63%ID(SPECT/CT显像实验,20min)。此外,Wang等[91]设计合成的[(Cp-R)99mTc(CO)3]核心配合物对σ1受体具有高亲和性和高亚型选择性,在ICR小鼠的初始脑摄取值达3.25%ID/g(15min)。上述研究结果促进了99mTc标记的CNS示踪剂的进展,期待随着新的锝配位核心的出现,不断提高99mTc标记的CNS显像剂的脑摄取值,从而打破该类药物进脑量低的瓶颈。
同时,应该清醒地认识到,放射性核素标记的CNS药物不但需要穿过血脑屏障,而且要具备与脑内特定靶点具有高亲和性和选择性、体内与特定靶点特异结合、代谢物不能进脑等性质。因此,发展99mTc标记的CNS显像剂难度极大。
2.4 大力加强基础锝配位化学的研究
为了进一步推动99mTc标记的放射性药物在临床上的广泛应用,需要大力加强基础锝配位化学的研究,需要不断发展新的配位核心和新的标记方法[92]。新的配位核心会促进研制出新的反映活体生物化学过程的靶向分子探针,新的标记方法则是进一步将新型放射性药物推向临床的关键。对于临床上使用的99mTc标记的放射性药物,理想制备方法是把高锝酸钠(99mTcO4Na)淋洗液直接注入到药盒,室温下振摇即可得到适于注射的99mTc标记的放射性药物。目前,新型99mTc标记的放射性药物的制备离这个目标尚远。如Li等[93]设计合成的[(Cp-R)99mTc(CO)3]核心配合物对σ2受体具有高亲和性、选择性和特异性,有潜力用于肿瘤增殖状态的显像。但该类99mTc-放射性药物的临床转化,取决于是否开发出水相标记、简单纯化后即符合临床注射液的方法。也就是说,只有不断发展新型高效、简便、易普及的标记技术,才能满足新型99mTc-放射性药物的临床转化需求。
3 小结
实现精准医疗,需要分子影像技术和靶向人类疾病不同靶点以及反映特定生物过程的分子探针。99mTc-放射性药物与其他SPECT药物以及PET药物在疾病的临床诊断与预后、治疗疗效评估中优势互补,发挥着重要作用。为了继续保持99mTc-放射性药物在临床核医学的地位,需要探索新的靶点,加强基础锝配位化学研究,开发锝配合物新的配位核心,最终研制出反映活体生物化学过程或特异靶向体内生物分子的新型99mTc-放射性药物,同时发展出适于临床使用的99mTc标记技术等。加速新型99mTc-放射性药物的研发及临床转化,99mTc-放射性药物的发展将会踏上一个新的台阶,更好地为人类健康服务。
参考文献:
[1] http:∥www.world-nuclear.org/information-library/non-power-nuclear-applications/radiois-otopesresearch/radioisotopes-in-medicine.aspx,Updated December 2017[M].
[2] 中华医学会核医学分会.2016年全国核医学现状普查结果简报[J].中华核医学与分子影像杂志,2016,(5):479-480.Chinese Society of Nuclear Medicine.A brief report on the results of the national survey of nuclear medicine in 2016[J].Chinese Journal of Nuclear Medicine and Molecular Imaging,2016,5:479-480(in Chinese).
[3] Jurisson S S,Lydon J D.Potential technetium Small molecule radiopharmaceuticals[J].Chem Rev,1999,99(9):2 205-2 218.
[4] Juergens S,Herrmann W A,Kuehn F E.Rhenium and technetium based radiopharmaceuticals:Development and recent advances[J].Journal of Organometallic Chemistry,2014,751:83-89.
[5] Vera D R,Wallace A M,Hoh C K,et al.A synthetic macromolecule for sentinel node detection:99mTc-DTPA-mannosyl-dextran[J].J Nucl Med,2001,42(6):951-959.
[6] International Atomic Energy Agency,Radiopharmaceuticals for Sentinel lymph node detection:status and trends[C].Vienna:International Atomic Energy Agency,2015.
[7] 张现忠,杨文江,王学斌,等.一种用于制备锝-99m标记的GSA的药盒及其制备方法:中国,CN200810057222.1[P].2008-01-30.
[8] Molecular Insight Pharmaceuticals,Inc.Study to Evaluate99mTc-MIP-1404 SPECT/CT Imaging in Men With Biopsy Proven Low-Grade Prostate Cancer (proSPECT-AS)[DB].ClinicalTrials.gov Identifier:NCT02615067,2018.
[9] Cyclomedica Australia PTY Limited.A Comparison of technegas and Xenon-133 planar lung imaging in subjects referred for ventilation scintigraphy[DB].ClinicalTrials.gov Identifier:NCT03054870,2018.
[10] Universidade Federal do Rio de Janeiro.99mTc-anti-TNF-alpha scintigraphy in the evaluation of inflammatory processes activity[DB].ClinicalTrials.gov Identifier:NCT02134613,2016.
[11] Advanced Accelerator Applications.99mTc-rhAnnexin V-128 in diagnosis of spondyloarthritis[DB].ClinicalTrials.gov Identifier:NCT03232580,2017.
[12] Advanced Accelerator Applications.99mTc-rhAnnexin V-128 imaging and cardiotoxicity in Patients with early breast cancer[DB].Clinical-Trials.gov Identifier:NCT02677714,2017.
[13] Institut National de la Santé Et de la Recherche Médicale,France.Assessment of radiolabeled rhAnnexin V-128 in infective endocarditis (AnnIE)[DB].ClinicalTrials.gov Identifier:NCT02459613,2016.
[14] Advanced Accelerator Applications.99mTc-rhAnnexin V-128 imaging for carotid atherosclerosis[DB].ClinicalTrials.gov Identifier:NCT02667457,2018.
[15] Assistance Publique - Hpitaux de Paris.Study of tolerance,biodistribution and dosimetry of fucoidan radiolabeled by technetium-99m (NANO-ATHERO)[DB].ClinicalTrials.gov Identifier:NCT03422055,2018.
[16] Cell>Point LLC.Efficacy and saftey study of99mTc-ECDG in the evaluation of coronary artery disease (CAD)[DB].ClinicalTrials.gov Identifier:NCT01899833,2017.
[17] Cell>Point LLC.A Phase 3 Study of99mTc-EC-DG SPECT/CT Versus PET/CT in Lung Cancer[DB].ClinicalTrials.gov Identifier:NCT01394679,2017.
[18] University of Chicago.Feasibility of Imaging in the treatment of patients with advanced head and neck cancer[DB].ClinicalTrials.gov Identifier:NCT01359267,2017.
[19] Wolfson Medical Center.Trodat 1SPECT and dopamine polymorphism[DB].ClinicalTrials.gov Identifier:NCT01381302,2016.
[20] Peking Union Medical College Hospital.99mTc-3PRGD2 SPECT/CT in lung cancer patients (TcRGDLC)[DB].ClinicalTrials.gov Identifier:NCT01737112,2017.
[21] First Affiliated Hospital of Fujian Medical University.99mTc-3PRGD2 SPECT/CT in breast cancer patients[DB].ClinicalTrials.gov Identifier:NCT02742168,2016.
[22] First Affiliated Hospital of Fujian Medical university.99mTc-3PRGD2 SPECT/CT in esophagus cancer patients[DB].ClinicalTrials.gov Identifier:NCT02744729,2016.
[23] First Affiliated Hospital of Fujian Medical University.99mTc-3PRGD2 SPECT/CT in rheumatoid arthritis patients (TRGDRA)[DB].ClinicalTrials.gov Identifier:NCT02723760,2016.
[24] Michael O’Connor.Detection of Aggressive Breast Tumors Using Tc-99m-NC100692[DB].ClinicalTrials.gov Identifier:NCT00888589,2014.
[25] Endocyte.Folic Acid-Tubulysin Conjugate EC1456 In Patients With Advanced Solid Tumors[DB].ClinicalTrials.gov Identifier:NCT01999738,2018.
[26] Endocyte.An Exploratory Study of the Folic Acid-tubulysin conjugate EC1456 in ovarian cancer subjects undergoing surgery[DB].ClinicalTrials.gov Identifier:NCT03011320,2018.
[27] Ghosh A,Heston W D W.Tumor target prostate specific membrane antigen (PSMA) and its regulation in prostate cancer[J].J Cell Biochem,2004,91(3):528-539.
[28] Silver D A,Pellicer I,Fair W R,et al.Prostate-specific membrane antigen expression in normal and malignant human tissues[J].Clin Cancer Res,1997,3(1):81-85.
[29] Perner S,Hofer M D,Kim R,et al.Prostate-specific membrane antigen expression as a predictor of prostate cancer progression[J].Hum Pathol,2007,38(5):696-701.
[30] Afshar-Oromieh A,Babich J W,Kratochwil C,et al.The rise of PSMA ligands for diagnosis and therapy of prostate cancer[J].J Nucl Med,2016,57(Suppl 3):79S-89S.
[31] Virgolini I,Decristoforo C,Uprimny C,et al.Current status of theranostics in prostate cancer[J].Eur J Nucl Med Mol Imaging,2018,45(3):471-495.
[32] Hillier S M,Maresca K P,Lu G,et al.99mTc-labeled small-molecule inhibitors of prostate-specific membrane antigen for molecular imaging of prostate cancer[J].J Nucl Med,2013,54(8):1369-1376.
[33] Vallabhajosula S,Nikolopoulou A,Babich J W,et al.99mTc-labeled small-molecule inhibitors of prostate-specific membrane antigen:pharmacokinetics and biodistribution studies in healthy subjects and patients with metastatic prostate cancer[J].J Nucl Med,2014,55(11):1791-1798.
[34] Schmidkonz C,Hollweg C,Beck M,et al.99mTc-MIP-1404-SPECT/CT for the detection of PSMA-positive lesions in 225 patients with biochemical recurrence of prostate cancer[J].Prostate (Hoboken,NJ,U S),2018,78(1):54-63.
[35] Santos-Cuevas C,Davanzo J,Ferro-Flores G,et al.99mTc-labeled PSMA inhibitor:Biokinetics and radiation dosimetry in healthy subjects and imaging of prostate cancer tumors in patients[J].Nucl Med Biol,2017,52:1-6.
[36] Reff M E,Carner K,Chambers K S,et al.Depletion of B cells in vivo by a chimeric mouse human monoclonal antibody to CD20[J].Blood,1994,83(2):435-445.
[37] Li N,Wang X,Lin B,et al.Clinical evaluation of99mTc-rituximab for sentinel lymph node mapping in breast cancer patients[J].J Nucl Med,2016,57(8):1214-1220.
[38] Gmeiner S T,Fettich J,Zver S,et al.99mTc-labelled rituximab,a new non-Hodgkin’s lymphoma imaging agent:first clinical experience[J].Nucl Med Commun,2008,29(12):1059-1065.
[39] Malviya G,Anzola K L,Podesta E,et al.99mTc-labeled rituximab for imaging B lymphocyte infiltration in inflammatory autoimmune disease patients[J].Mol Imaging Biol,2012,14(5):637-646.
[40] Plow E F,Haas T A,Zhang L,et al.Ligand binding to integrins[J].J Biol Chem,2000,275(29):21785-21788.
[41] Brooks P C,Clark Ra F,Cheresh D A.Requirement of vascular integrin αvβ3 for angiogenesis[J].Science,1994,264(5 158):569-571.
[42] Jia B,Liu Z,Zhu Z,et al.Blood clearance kinetics,biodistribution,and radiation dosimetry of a kit-formulated integrin αvβ3-selective radiotracer99mTc-3PRGD 2 in non-human primates[J].Mol Imaging Biol,2011,13(4):730-736.
[43] Cheng G H,Gao S,Ji T F,et al.Pharmacokinetics and radiation dosimetry of Tc-99m 3PRGD2 in healthy individuals:A pilot study[J].Nuclear Science And Techniques,2012,23(6):349-354.
[44] Zhu Z H,Miao W B,Li Q W,et al.99mTc-3PRGD2 for integrin receptor imaging of lung cancer:a multicenter study[J].Journal of Nuclear Medicine,2012,53(5):716-722.
[45] Jin X,Liang N,Wang M,et al.Integrin imaging with Tc-99m-3PRGD2 SPECT/CT shows high specificity in the diagnosis of lymph node metastasis from non-small cell lung cancer[J].Radiology,2016,281(3):958-966.
[46] Yu X,Wu Y,Liu H,et al.Small-animal SPECT/CT of the progression and recovery of rat liver fibrosis by using an integrin αvβ3-targeting radiotracer[J].Radiology,2016,279(2):502-512.
[47] Huang C,Zheng Q,Miao W B.Study of novel molecular probe Tc-99m-3PRGD(2) in the diagnosis of rheumatoid arthritis[J].Nuclear Medicine Communications,2015,36(12):1208-1214.
[48] Chen G,Ouyang Z,Wang F,et al.Evaluation of Tc-99m-3PRGD2 integrin receptor imaging in the differential diagnosis of breast lesions and comparison with mammography[J].Cancer Investigation,2017,35(2):108-115.
[49] Wu Y,Zhang G J,Wang X C,et al.Early detection of rheumatoid arthritis in rats and humans with Tc-99m-3PRGD2 scintigraphy:imaging synovial neoangiogenesis[J].Oncotarget,2017,8(4):5 753-5 760.
[50] Zhang Z Q,Zhao X M,Ding C M,et al.Tc-99m-3PRGD2 SPECT/CT imaging for monitoring early response of EGFR-TKIs therapy in patients with advanced-stage lung adenocarcinoma[J].Cancer Biotherapy And Radiopharmaceuticals,2016,31(7):238-245.
[51] Hua J,Dobrucki L W,Sadeghi M M,et al.Noninvasive imaging of angiogenesis with a99mTc-labeled peptide targeted at αvβ3 integrin after murine hindlimb ischemia[J].Circulation,2005,111(24):3 255-3 260.
[52] Bach-Gansmo T,Danielsson R,Saracco A,et al.Integrin receptor imaging of breast cancer:a proof-of-concept study to evaluate99mTc-NC100692[J].J Nucl Med,2006,47(9):1434-1439.
[53] Bach-Gansmo T,Bogsrud T V,Skretting A.Integrin scintimammography using a dedicated breast imaging,solid-state gamma-camera and99mTc-labelled NC100692[J].Clin Physiol Funct Imaging,2008,28(4):235-239.
[54] Axelsson R,Bach-Gansmo T,Castell-Conesa J,et al.An open-label,multicenter,phase 2a study to assess the feasibility of imaging metastases in late-stage cancer patients with the alpha v beta 3-selective angiogenesis imaging agent99mTc-NC100692[J].Acta Radiol,2010,51(1):40-46.
[55] Gerke V,Moss S E.Annexins:From structure to function[J].Physiol Rev,2002,82(2):331-371.
[56] Wang X,Feng H,Zhao S,et al.SPECT and PET radiopharmaceuticals for molecular imaging of apoptosis:from bench to clinic[J].Oncotarget,2017,8(12):20 476-20 495.
[57] Van De Wiele C,Vermeersch H,Loose D,et al.Radiolabeled annexin-V for monitoring treatment response in oncology[J].Cancer Biother Radiopharm,2004,19(2):189-194.
[58] Kemerink G J,Boersma H H,Thimister P W,et al.Biodistribution and dosimetry of99mTc-BTAP-annexin-V in humans[J].Eur J Nucl Med,2001,28(9):1373-1378.
[59] Kemerink G J,Liem I H,Hofstra L,et al.Patient dosimetry of intravenously administered Tc-99m-annexin V[J].Journal of Nuclear Medicine,2001,42(2):382-387.
[60] Kartachova M,Van Zandwijk N,Burgers S,et al.Prognostic significance of Tc-99m Hynic-rh-annexin V scintigraphy during platinum-based chemotherapy in advanced lung cancer[J].Journal of Clinical Oncology,2007,25(18):2 534-2 539.
[61] Rottey S,Loose D,Vakaet L,et al.99mTc-HYNIC Annexin-V imaging of tumors and its relationship to response to radiotherapy and/or chemotherapy[J].Q J Nucl Med Mol Imaging,2007,51(2):182-188.
[62] Rottey S,Van Den Bossche B,Slegers G,et al.Influence of chemotherapy on the biodistribution of Tc-99m hydrazinonicotinamide annexin V in cancer patients[J].Quarterly Journal of Nuclear Medicine and Molecular Imaging,2009,53(2):127-132.
[63] Kemerink G J,Liu X,Kieffer D,et al.Safety,biodistribution,and dosimetry of99mTc-HYNIC-annexin V,a novel human recombinant annexin V for human application[J].J Nucl Med,2003,44(6):947-952.
[64] Blankenberg F G,Katsikis P D,Tait J F,et al.In vivo detection and imaging of phosphatidylserine expression during programmed cell death[J].Proc Natl Acad Sci USA,1998,95(11):6 349-6 354.
[65] Stratton J R,Dewhurst T A,Kasina S,et al.Selective uptake of radiolabeled annexin V on acute porcine left atrial thrombi[J].Circulation,1995,92(10):3 113-3 121.
[66] Hilgenbrink A R,Low P S.Folate receptor-mediated drug targeting:from therapeutics to diagnostics[J].J Pharm Sci,2005,94(10):2 135-2 146.
[67] Leamon C P,Parker M A,Vlahov I R,et al.Synthesis and biological evaluation of EC20:a new folate-derived,99mTc-based radiopharmaceutical[J].Bioconjugate Chem,2002,13(6):1200-1210.
[68] Fisher R E,Siegel B A,Edell S L,et al.Exploratory study of99mTc-EC20 imaging for identifying patients with folate receptor-positive solid tumors[J].J Nucl Med,2008,49(6):899-906.
[69] Naumann R W,Coleman R L,Burger R A,et al.PRECEDENT:a randomized phase II trial comparing vintafolide (EC145) and pegylated liposomal doxorubicin (PLD) in combination versus PLD alone in patients with platinum-resistant ovarian cancer[J].J Clin Oncol,2013,31(35):4 400-4 406.
[70] Herzog T J,Kutarska E,Bidzinsk M,et al.Adverse event profile by folate receptor status for vintafolide and pegylated liposomal doxorubicin in combination,versus pegylated liposomal doxorubicin alone,in platinum-resistant ovarian cancer:exploratory analysis of the phase Ⅱ PRECEDENT trial[J].Int J Gynecol Cancer,2016,26(9):1580-1585.
[71] Yamada Y,Nakatani H,Yanaihara H,et al.Phase I clinical trial of99mTc-etarfolatide,an imaging agent for folate receptor in healthy Japanese adults[J].Ann Nucl Med,2015,29(9):792-798.
[72] Morris R T,Joyrich R N,Naumann R W,et al.Phase II study of treatment of advanced ovarian cancer with folate-receptor-targeted therapeutic (vintafolide) and companion SPECT-based imaging agent (99mTc-etarfolatide)[J].Ann Oncol,2014,25(4):852-858.
[73] European Medicines Agency[EB/OL].http:∥www.ema.europa.eu/ema(accessed 18 April 2018).
[74] Yang D J,Kim C-G,Schechter N R,et al.Imaging with99mTc ECDG targeted at the multifunctional glucose transport system:feasibility study with rodents[J].Radiology,2003,226(2):465-473.
[75] Yang D,Yukihiro M,Yu D-F,et al.Assessment of therapeutic tumor response using99mTc-ethylenedicysteine-glucosamine[J].Cancer Biother Radiopharm,2004,19(4):443-456.
[76] Angelides S,El-Mashaleh M,Anagnostou M,et al.The role of99mTc-labelled glucosamine (99mTc-ECDG) in the evaluation of rheumatic joint disease:a screening experience[J].Nucl Med Commun,2014,35(6):655-665.
[77] Ginat D T,Westiin C,Chin C T,et al.Pilot study of99mTc-labeled ethylene dicysteine deoxyglucose SPECT-CT imaging in treatment response evaluation in patients with locally advanced head and neck cancer[J].Cureus,2017,9(4):e1152.
[78] 张俊波,张旭冉,甘倩倩,等.99mTc标记含异腈的葡萄糖衍生物及制备方法和应用:中国,CN201710451094.8[P].2017-10-13.
[79] Hernandez-Valdes D,Alberto R,Jauregui-Haza U.Quantum chemistry calculations of technetium and rhenium compounds with application in radiopharmacy:review[J].RSC Adv,2016,6(108):107 127-107 140.
[80] Wang X Y,Wang Y,Liu XQ,et al.The structure,energy and stability of components formed in the preparation offac-[99mTc(CO)3(H2O)3]+[J].Phys Chem Chem Phys,2003,5(3):456-460.
[81] Jia H M,Fang D C,Feng Y,et al.The interconversion mechanism between TcO3+ and TcO2+ core of99mTc labeled amine-oxime (AO) complexes[J].Theor Chem Acc,2008,121(5-6):271-278.
[82] Jia H,Ma X,Wang C,et al.Solvation effects on brain uptakes of isomers of99mTc brain imaging agents[J].Chin Sci Bull,2002,47(21):1786-1791.
[83] Pascu S,Dilworth J.Recent developments in PET and SPECT imaging[J].J Labelled Compd Radiopharm,2014,57(4):191-194.
[84] Bailey D L,Willowson K P.An evidence-based review of quantitative SPECT imaging and potential clinical applications[J].J Nucl Med,2013,54(1):83-89.
[85] Mariani G,Bruselli L,Duatti A.Is PET always an advantage versus planar and SPECT imaging?[J].Eur J Nucl Med Mol Imaging,2008,35(8):1560-1565.
[86] Hutton B F,Erlandsson K,Thielemans K.Advances in clinical molecular imaging instrumentation[J].Clinical and Translational Imaging,2018,6(1):31-45.
[87] Adak S,Bhalla R,Raj K K V,et al.Radiotracers for SPECT imaging:current scenario and future prospects[J].Radiochim Acta,2012,100(2):95-107.
[88] Srivastava S C.Paving the way to personalized medicine:production of some theragnostic radionuclides at Brookhaven national laboratory[J].Radiochim Acta,2011,99(10):635-640.
[89] De Rosales R T M,Blower P.Chapter 16 Role of99mTc in the Development of Rhenium Radiopharmaceuticals[C]∥ International Atomic Energy Agency.Thechnetium-99m Radiopharmaceuticals:Status and Trends.IAEA Radioisotopes and Radiopharmaceuticals.Series No.1.Vienna:IAEA,2009:317-346.
[90] Zhang X,Hou Y,Peng C,et al.Oligoethyleneoxy-modified99mTc-labeled β-amyloid imaging probes with improved brain pharmacokinetics for single-photon emission computed tomography[J].J Med Chem,2018,61(3):1330-1339.
[91] Wang X,Li D,Deuther-Conrad W,et al.Novel cyclopentadienyl tricarbonyl99mTc complexes containing 1-piperonylpiperazine moiety:potential imaging probes for sigma-1receptors[J].J Med Chem,2014,57(16):7 113-7 125.
[92] Alberto R.Chapter 17 Future Trends in the Development of Technetium Radiopharmaceuticals[C]∥ International Atomic Energy Agency.Thechnetium-99m Radiopharmaceuticals:Status and Trends.IAEA Radioisotopes and Radiopharmaceuticals.Series No.1.Vienna:IAEA,2009:347-358.
[93] Li D,Chen Y,Wang X,et al.99mTc-Cyclopentadienyl tricarbonyl chelate-labeled compounds as selective sigma-2 receptor ligands for tumor imaging[J].J Med Chem,2016,59(3):934-946.

