珍稀树种红豆树茎段启动培养的影响因素
桂 平,韦小丽,田雨风,苏石诚,吴高殷
(1. 贵州大学 林学院,贵州 贵阳 550025;2. 铜仁职业技术学院 农学院,贵州 铜仁 554300)
【研究意义】红豆树(OrmosiahosieiHemsl et Wils)为蝶形花科红豆树属树种,为我国特有乡土树种,国家Ⅱ级重点保护珍贵树种,被《中国物种红色名录》列为VU等级濒危树种[1-3]。由于红豆树生长缓慢,开花结实不稳定,存在严重的大小年现象且繁殖困难[4],加上无节制的砍伐,造成红豆树自然资源处于濒临灭绝状态[1]。组织培养技术是目前繁殖速度最快、繁殖系数最高的技术,较适于珍稀濒危树种的繁殖[5]。【前人研究进展】关于红豆树组织培养已有报道,范辉华等[6]以红豆树根蘖苗茎段为外植体诱导植株再生,但诱导率不高且未形成完整植株;何碧珠等[7]以红豆树种子为外植体建立了组织培养体系;何官榕等[8]采用萌发种胚中子叶胚的2/3做外植体,诱导下胚轴潜伏芽萌发并形成完整植株。【本研究切入点】关于红豆树不同外植体消毒方式和培养基营养条件、质地及pH环境等的研究未见报道,因此,筛选其组织培养的最佳消毒方式、基本培养基种类、蔗糖和琼脂浓度及pH等对加快红豆树的繁殖,提高其繁殖系数具有重要意义。【拟解决的关键问题】以红豆树幼嫩茎段为试材,采用单因素试验探讨其初代培养的影响因素,筛选最适的培养条件,为提高繁殖率,完善红豆树组织培养体系提供理论依据和技术指导。
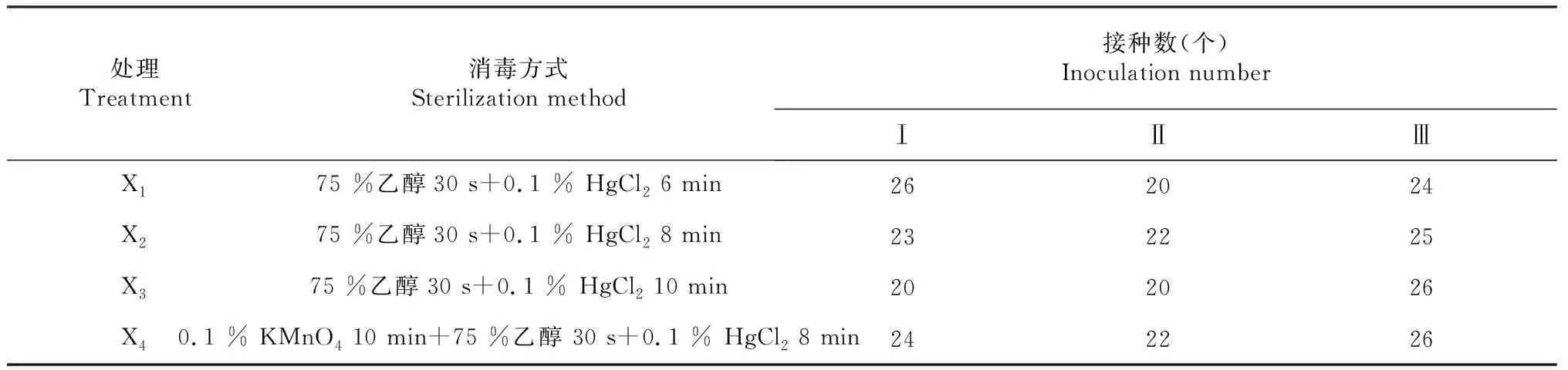
表1 红豆树茎段个植体的消毒灭菌试验设计
1 材料与方法
1.1 供试材料
1.1.1 外植体 选取苗高≥12 cm的健壮红豆树幼苗,将植株从茎基部剪下并去掉叶片和顶芽备用。红豆树幼苗由贵州大学林学院提供。
1.1.2 试剂 MS、1/2MS、WPM及B5培养基自制,其药品来源于海国药集团化学试剂有限公司;6-BA、NAA、蔗糖、琼脂来源于北京solarbio公司;乙醇来源于上海国药集团化学试剂有限公司;0.1 %HgCl2来源于贵州铜仁,KMnO4来源于成都金山化学试剂有限公司。
1.2 试验方法
1.2.1 灭菌 消毒方式设4个处理(表1),将剪下的嫩茎用自来水冲洗1 h,分别按X1~X4的方式进行消毒处理。每处理期间用无菌水冲洗3~4次,将灭菌的嫩茎用消毒的滤纸吸干水分后剪切成1.0~1.5cm长(带1~2个侧芽)的茎段(下同),接种于MS+6-BA 2.5 mg/L+NAA 0.05 mg/L+蔗糖30 g/L+琼脂8 g/L培养基中,pH调至6.0,每个处理3次重复,每个重复接种10~12瓶,每瓶接种1~2个外植体,每7 d观察记录1次外植体污染、死亡和生长情况,30 d后统计试验结果。
1.2.2 蔗糖浓度的筛选 将红豆树幼嫩茎以0.1 % KMnO410 min+75 %乙醇 30 s+0.1 % HgCl28 min方式消毒后剪切成1.0~1.5 cm长(带1~2个芽)的茎段(以下同),以MS为基本培养基,附加激素6-BA 2.5 mg/L+NAA 0.05 mg/L,琼脂8 g/L,分别添加不同浓度的蔗糖,pH调至6.0。试验设5个处理(Z1~Z5),即在上述培养基中分别添加浓度为10、20、30、40和50 g/L的蔗糖。每个处理3次重复,每个重复接种10瓶,每瓶接种2~4个外植体,每7 d观察记录1次外植体生长情况,60 d后统计试验结果。培养温度(25±2) ℃,光照强度3000 lx,光照时间为12 h/d(以下同)。
1.2.3 琼脂浓度的筛选 以MS为基本培养基,附加激素6-BA 2.5 mg/L+NAA 0.05 mg/L,蔗糖30 g/L,分别添加不同浓度的琼脂,pH调至6.0。试验设5个处理(Q1~Q5),即在上述培养基中分别添加浓度为6、7、8、9和10 g/L的琼脂。每个处理3次重复,每个重复接种10瓶,每瓶接种2个外植体,每7 d观察记录1次外植体生长情况,60 d后统计试验结果。
1.2.4 培养基pH的筛选 试验设5个处理(P1~P5),即将MS+6-BA 2.5 mg/L+NAA 0.05 mg/L+琼脂8 g/L+蔗糖30 g/L培养基pH分别调至5.6、5.8、6.0、6.2和6.5。每个处理3次重复,每个重复接种10瓶,每瓶接种2个外植体,每7 d观察记录1次外植体的生长情况,60 d后统计结果。
1.2.5 基本培养基的筛选 试验设4个处理(Y1~Y4),即依次以MS、1/2MS、WPM和B5为基本培养基,其中添加激素6-BA 2.5 mg/L+NAA 0.05 mg/L,琼脂8 g/L,蔗糖30 g/L,pH调至6.0。每个处理3次重复,每个重复接种20瓶,每瓶接种1~3个外植体,每7 d观察记录1次外植体诱导和生长情况,60 d后统计试验结果。
1.3 数据统计与分析
用Excel 2016对数据进行整理,用SPSS 18.0对数据进行方差分析和Duncan多重比较。
2 结果与分析
2.1 不同消毒方式红豆树茎段的生长情况
从表2和图1可知,0.1 % HgCl2处理时间以8 min最好,处理时间过短,污染率较高,处理时间过长,虽然没有污染,但外植体存在一定程度的损伤,死亡率达28.59 %且生长缓慢。用0.1 % KMnO4

表2 不同消毒方式红豆树茎段的污染率及成活率
注:同列不同大、小写字母分别表示差异极显著(P<0.01)和差异显著(P<0.05),下同。
Note: Different capital and lowercase letters in the same column indicate significance of difference atP<0.01 andP<0.05 level respectively. The same as below.
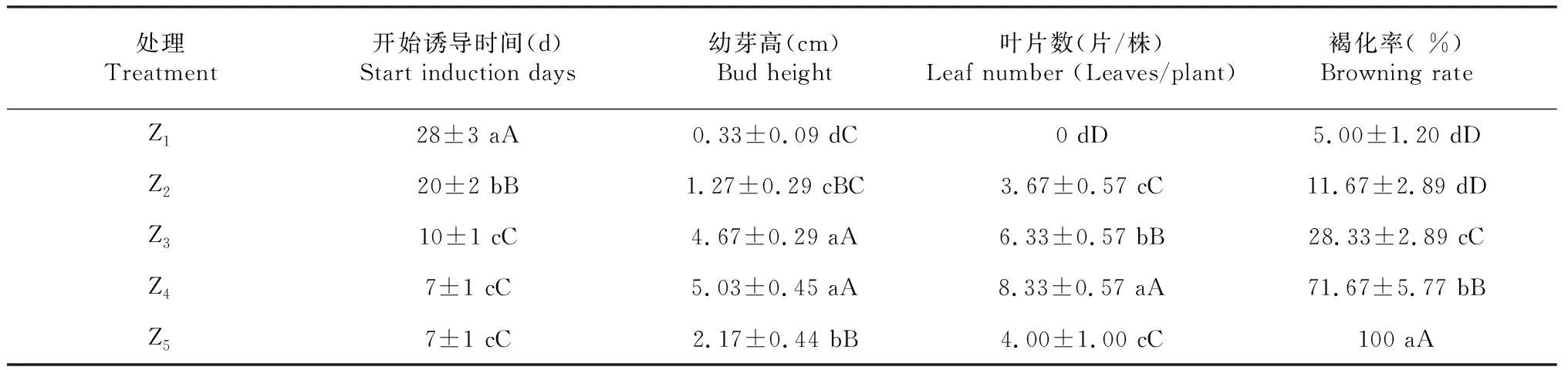
表3 不同浓度蔗糖处理红豆树茎段的启动培养状况
预处理10 min可有效地降低外植体污染率,提高成活率。4个处理中,X4的成活率最高且生长情况最好,成活率为100 %。从外植体污染情况看,主要为细菌污染,菌落小、表面呈乳脂状(图1C~D),存在少量的真菌污染,菌落表面多呈毛绒状(图1E)。经方差分析,4个处理平均污染率差异极显著(P<0.01),平均成活率差异显著(P<0.05),其中,X4的平均污染率和成活率均与其余3个处理存在极显著差异(P<0.01);X3的平均死亡率与其余3个处理存在极显著差异(P<0.01)。
2.2 不同浓度蔗糖对红豆树茎段启动培养的影响
由表3和图2可以看出,不同浓度蔗糖对红豆树茎段诱导开始时间和生长表现影响较大。随着蔗糖浓度的升高,红豆树茎段开始诱导时间逐渐提前,蔗糖浓度增至40 g/L(Z4)后开始诱导时间稳定在第7天;蔗糖浓度越高,红豆树的诱导新芽越健壮且叶片越大,但褐化率逐渐升高,当蔗糖浓度增至50 g/L(Z5)时,苗高和叶片数均呈明显下降趋势且褐化率达100 %。经方差分析,不同浓度蔗糖处理外植体诱导开始时间、平均幼芽高、叶片数和褐化率均存在极显著差异(P<0.01)。从诱导开始时间、幼芽高、叶片数和生长情况看,最佳蔗糖浓度为40 g/L,但其褐化率较高,不利于后续的生长与分化。因此,红豆树茎段启动培养最佳的蔗糖浓度以30 g/L为宜。
2.3 不同浓度琼脂对红豆树茎段启动培养的影响
从表4和图3可知,不同质地培养基中红豆树茎段诱导芽的生长存在差异,培养基太硬或太软都不适宜外植体的诱导生长,均表现生长慢或缓慢。其中,Q3(琼脂浓度为8 g/L时)的诱导芽生长健壮,其平均芽高和叶片数比Q1增加1.2 cm和3.34片,比Q5增加2.43 cm和6.34片。经方差分析,Q3与Q2的平均芽高差异不显著(P>0.05),但与Q1差异显著(P<0.05),与Q4和Q5差异极显著(P<0.01);Q3与Q2平均叶片数差异不显著(P>0.05),但与Q1、Q4和Q5差异极显著(P<0.01)。因此,红豆树茎段启动培养的最适琼脂浓度为8 g/L。
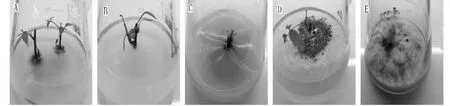
A~B为未被污染正常生长的外植体;C~D为细菌污染;E为真菌污染A-B.Uncontaminated explants;C-D.An explant contaminated with bacterial; E.An explant contaminated with fungi图1 灭菌红豆树茎段的生长状况Fig.1 Growth status of sterilized Ormosia hosiei stem segments

A、B、C、D、E分别表示蔗糖浓度为10、20、30、40和50 g/L时红豆树茎段诱导芽的生长情况A,B,C,D and E presents growth status of buds induced from Ormosia hosiei stem segments under 10,20,30,40 and 50 g/L sucrose,respectively图2 不同浓度蔗糖处理红豆树茎段诱导芽的生长Fig.2 Growth of buds induced from Ormosia hosiei stem segments under different sucrose concentration

A、B、C、D、E分别表示琼脂浓度为6、7、8、9和10 g/L时红豆树茎段诱导的芽生长状况A,B,C,D and E presents growth status of buds induced from Ormosia hosiei stem segments under 10,20,30,40 and 50 g/L agar,respectively图3 不同浓度琼脂处理红豆树丛生芽的生长状况Fig.3 Growth of cluster buds induced from Ormosia hosiei stem segments under different agar concentration
2.4 不同pH对红豆树茎段启动培养的影响
由表5和图4可见,不同pH培养基上红豆树茎段诱导丛生芽的平均芽高和叶片数差异极显著(P<0.01),生长差异也十分明显。其中,P3和P4红豆树茎段诱导丛生芽生长较好,但在后期观察到P4红豆树植株的叶片出现微黄现象;而P1和P5红豆树茎段诱导丛生芽的生长均不佳,表现生长缓慢,叶片细小,且P5还存在少量的玻璃化现象。因此,红豆树茎段启动培养的pH宜选择6.0。
2.5 不同基本培养基对红豆树茎段启动培养的影响
从表6和图5可知,通过60 d的培养各处理均能很好地诱导侧芽的发生,但对丛生芽诱导率和芽的长势存在很大差异。其中,Y2和Y3均能很好地诱导丛生芽的发生,但是Y3的丛生芽生长缓慢,60 d后平均芽高仅1.6 cm;Y1和Y4诱导的侧芽长势较好,芽苗较高,但丛生芽诱导率相对较低,存在不同程度的褐化现象。4个处理以Y2诱导的丛生芽最多、最健壮,且无褐化现象发生,为红豆树茎段启动培养最佳的基本培养基。经方差分析,Y2与Y3

表4 不同浓度琼脂处理红豆树茎段的启动培养状况

表5 不同pH处理红豆树茎段的启动培养状况

表6 不同基本培养基处理红豆树茎段的启动培养状况
的平均侧芽诱导率、丛生芽诱导率差异不显著(P>0.05),但Y2和 Y3与 Y1和Y4间均存在极显著差异(P<0.01);Y2与Y1和Y4的平均芽数差异极显著(P<0.01);Y2与Y4的平均芽高差异不显著(P>0.05),但与Y1和Y3的差异分别达显著(P<0.05)和极显著(P<0.01)水平。
3 讨 论
外植体灭菌,建立无菌体系是植物组织培养的第一步。HgCl2是一种极为有效的外植体杀菌剂,与乙醇配合使用效果更佳[9]。该研究得出,在用75 %乙醇处理30 s的前提下,随着0.1 % HgCl2处理时间的增加,红豆树茎段污染率逐渐降低,但成活率呈先升后降趋势,处理时间以8 min为宜,时间过长,外植体遭受一定程度的损伤,以致诱导受抑制。试验还得出3种(0.1 % KMnO4+75 %乙醇+0.1 % HgCl2)灭菌剂组合灭菌效果优于2种(75 %乙醇+0.1 % HgCl2)灭菌剂组合,与刘会超等[10-11]的研究结果类似。而用0.1 % KMnO4预处理10 min能有效提高外植体成活率,降低污染率,与段维兴等[12]研究结果一致。
由于植物离体组织生长所需的营养成分全部来自培养基中,所以选择合适的基本培养基是进行植株再生培养的基础[13-14]。通常情况下,对丛生芽诱导全量MS培养基效果优于1/2MS培养基[14]。本试验得出,红豆树茎段丛生芽诱导最佳的基本培养基是1/2MS培养基,与何碧珠等[7]“1/2MS培养基不适于鄂西红豆的种胚培养”的结论不一致,可能是各自采用的外植体不同,所需的培养基营养条件不同所致[15-21]。而降香黄檀茎段[22]、贯叶金丝桃嫩梢[23]、李砧木叶片[24]及山红柿休眠芽[25]等植物外植体最佳启动基本培养基均为1/2MS,与本研究红豆树茎段启动培养最佳基本培养基为1/2MS的结论一致。

A、B、C、D、E分别表示pH为5.6、5.8、6.0、6.2和6.5时红豆树茎段诱导的芽生长情况A,B,C,D and E presents growth status of buds induced from Ormosia hosiei stem segments at pH 5.6,pH 5.8,pH 6.0,pH 6.2 and pH 6.5,respectively图4 不同pH处理红豆树茎段诱导丛生芽的生长Fig.4 Growth of cluster buds induced from Ormosia hosiei stem segments at different pH value

A、B、C和D分别表示MS、1/2MS、WPM和B5基本培养基中红豆树茎段诱导芽的生长状况A,B,C and D presents growth status of buds induced from Ormosia hosiei stem segments cultured on MS,1/2MS,WPM and B5,respectively图5 不同基本培养基处理红豆树茎段诱导丛生芽的生长状况Fig.5 Growth of cluster buds induced from Ormosia hosiei stem segments cultured on different basic media
培养基的渗透压、质地和pH也是影响启动培养效果的重要因素。糖类起到调节渗透压的重要作用,是影响细胞分裂、分化和形态建成的重要因素[26-27]。该研究发现,随着蔗糖浓度增加渗透压越大,愈能促进细胞分裂及芽的诱导生长,其中,蔗糖质量浓度为30 g/L时红豆树茎段启动培养效果最好。渗透压过高,褐化越严重,导致红豆树茎段细胞分裂能力下降。培养基的琼脂浓度直接影响培养基质地和水分状况,该研究发现琼脂浓度过高与过低都不利于红豆树茎段芽的诱导和生长,其中琼脂质量浓度以8 g/L最佳,可能是因为琼脂浓度过低,培养基凝固度不够,湿度过大,不利于外植体基部进行有氧呼吸;而琼脂浓度过高,培养基变硬,培养基中的营养物质很难被吸收与利用,导致芽分化能力减弱,组培苗生长不良所致[28]。培养基的pH以6.0最适,过高和过低均显著影响红豆树幼芽高的生长与叶片的分化,均表现出生长缓慢、细弱和发黄现象,且pH过高还存在少量玻璃化现象。与胡根长等[29]的研究结果一致。
红豆树茎段在培养过程中容易发生褐化现象。主要是由于外植体的分泌物被多酚氧化酶氧化后形成,导致褐化现象的原因除了外植体本身外,与培养基成分、培养条件和培养方式有关系[30]。该研究只对外植体诱导适宜的灭菌方式、基本培养基、pH、琼脂浓度和蔗糖浓度进行了探讨,对于如何控制外植体褐化及提高增殖系数还有待进一步研究。
4 结 论
红豆树茎段以0.1 % KMnO410 min+75 %乙醇30 s+0.1 % HgCl28 min消毒最好,污染率仅6.98 %,成活率达100 %。启动培养条件以1/2MS基本培养基+蔗糖30 g/L+琼脂8 g/L+pH 6.0的效果最好,丛生芽诱导率达85.19 %。
参考文献:
[1]刘 鹏,阙生全,刘丽婷,等.红豆树研究现状及濒危保护建议[J].亚热带植物科学,2017,46(1):96-100.
[2]国家林业局,农业部.国家重点保护野生植物名录(第一批)[J].中国林业,2003(22):50-53.
[3]郑天汉,兰思仁,江希钿.红豆树研究[M].北京:中国林业出版社,2013:1.
[4]冯建国,季新良,周志春,等.特种经济高档用材红豆树培育技术[J].林业科技开发,2007(5):93-95.
[5]兰彦平,顾万春.林木无性繁殖研究进展[J].世界林业研究,2002(6):7-13.
[6]范辉华,李朝晖,张 蕊,等.红豆树的组织培养技术[J].福建林业科技,2011,38(3):100-102,120.
[7]何碧珠,郜祥雄,彭东辉,等.鄂西红豆离体培养及植株再生研究[J].西北农林科技大学学报(自然科学版),2015,43(12):49-57.
[8]何官榕,何碧珠,林 魁,等.红豆树下胚轴再生体系建立及高效微体繁殖[J].兰州大学学报(自然科学版),2017,53(3):376-383.
[9]胡 凯,张立军,白雪梅,等.植物组织培养污染原因分析及外植体的消毒[J].安徽农业科学,2007(3):680-681.
[10]刘会超,郭丽娟,贾文庆,等.不同消毒方式及生长调节剂浓度对红双喜月季组培的影响[J].贵州农业科学,2010,38(10):14-17.
[11]王大平,罗 涛. 野生泸定百合鳞片的组织培养技术[J].贵州农业科学,2017,45(1):52-54.
[12]段维兴,江翠平,盘丰平,等.水果型番木瓜外植体灭菌方法研究[J].广西农业科学,2009,40(6):621-624.
[13]孙晓敏,陈 争,王京京,等.光皮桦叶片再生体系的建立[J].西北农林科技大学学报(自然科学版),2012,40(4):61-67.
[14]唐 亮,金晓玲.杜仲组织培养的研究进展[J].贵州农业科学,2010,38(3):15-18.
[15]张明丽,李 青.木本观赏植物组织培养及植株再生的研究进展[J].河北林业科技,2004(2):23-26.
[16]梁称福.植物组织培养研究进展与应用概况[J].经济林研究,2005(4):99-105.
[17]马 燕,韩瑞超,臧德奎,等.木本观赏植物组织培养研究进展[J].安徽农业科学,2012,40(4):1956-1958,2036.
[18]李小艳,王 梅,段鹏慧,等.黑果枸杞的组织培养快速繁殖技术[J].贵州农业科学,2017,45(6):12-14.
[19]王婷婷,胡春宏,常 苹,等.苹果接穗SVM-O15的组织培养[J].贵州农业科学,2017,45(11):98-101.
[20]宋智琴,杨平飞,罗 鸣,等.不同添加物对白及组培壮苗培养的影响[J].贵州农业科学,2016,44(3):138-140.
[21]朱燕燕,罗 睿,陈海丽,等. 滴水珠组织培养体系的优化[J]. 贵州农业科学,2016,44(9):101-104.
[22]杨 峰,陈仁利,刘进平,等.降香黄檀愈伤组织培养与植株再生研究[J].中国农学通报,2012,28(13):70-75.
[23]李晓玲,张宏霞.贯叶金丝桃组培快繁中褐变问题研究[J].林业科技通讯,2017(7):17-18.
[24]周厚成,赵 霞,李 明,等.李砧木Marianna离体叶片再生体系优化研究[J].西北植物学报,2011,31(10):2113-2118.
[25]蒋振莹,闫艳秋,林志伟,等.山红柿组培快繁技术体系的建立[J].江西农业大学学报,2016,38(1):74-82.
[26]刘艺平,王 政,牛佳佳,等.不同糖源及蔗糖质量浓度对牡丹愈伤组织褐化的影响[J].河南农业科学,2013,42(3):103-106.
[27]尹利方,陈泽斌,夏体渊,等.不同培养条件对蓝莓试管苗增殖生长的影响[J].西南农业学报,2017,30(7):1642-1646.
[28]毕 云,苏 艳,张艺萍,等.蓝莓组织培养过程中玻璃化现象的防止技术研究[J].西南农业学报,2014,27(6):2539-2542.
[29]胡根长,周红敏,刘荣松,等.红豆树轻基质容器育苗试验[J].林业科技开发,2010,24(6):103-106.
[30]郭 艳,杨海玲.植物组织培养中的褐化现象及解决途径[J].山西农业科学,2009,37(7):14-16,31.

