球孢白僵菌对3种苹果病原真菌的抑制作用
索相敏,马 斌,郝 婕,刘铁铮,冯建忠,鄢新民,王献革,李学营*
(1.河北省农林科学院 石家庄果树研究所,河北 石家庄 050061; 2.河北农业大学 植物保护学院,河北 保定 071000)
中国是世界上最大的苹果生产国,苹果的种植面积和产量均居世界第一[1]。近几年我国苹果种植面积不断扩大的同时,苹果树病害也愈加严重,其中苹果腐烂病、苹果轮纹病和苹果斑点落叶病尤为严重。苹果腐烂病俗称串皮湿、烂皮病或臭皮病,是我国北方果区危害严重的苹果病害,其危害苹果树的枝干,枝干上病疤累累,枝干残缺不全,甚至全株枯死[2-3]。苹果轮纹病主要危害枝干和果实,对叶片危害较少,枝干受害,在皮孔上形成圆形或扁圆形的瘤状物,边缘龟裂与健康组织形成一道环沟,严重时生病组织翘起如马鞍状,许多病斑连在一起,使表皮粗糙;果实感染轮纹病很快形成同心轮纹状,整个果实软腐。随着易感轮纹病苹果品种富士在我国的大面积推广,苹果轮纹病在黄河故道、华北地区及四川、湖北等省份发生普遍,已成为我国当前苹果生产上较为严重的病害之一,使苹果产业遭受了巨大的经济损失[4]。苹果斑点落叶病是我国苹果产区的主要病害之一,该病主要危害新生叶片,尤其是展叶20 d内的幼嫩叶片,还可危害叶柄、1 a生枝条和果实[5]。发病严重时,果园病叶率达90%以上,不仅造成果树大量落叶,而且影响果实的正常膨大和着色,在发病后期,可以侵染果实,致使品质变劣,严重影响产量与经济效益。
化学农药是保障我国粮食生产的重要农业物资,然而,农药也是一把双刃剑,在保障人类获得丰厚农产品的同时,也给环境和生态带来了严重的污染与危害[6-7]。基于此,近年来国家提出了化肥、农药减施的“双减”目标,开发新型农药迫在眉睫[8]。近年来,昆虫病原真菌开发利用的研究越来越受到重视,并已有大量成功应用的典例,如白僵菌属、绿僵菌属、拟青霉属、被毛孢属、棒孢菌属、穗霉属、侧孢霉属、轮枝菌属等[9-14]。其中,白僵菌昆虫病原真菌在代谢类型上十分复杂,能产生多种生理功能特异的生物活性物质。这种代谢产物的多样性,为人类开发新型生物制剂及在其他领域的利用提供了重要的途径。为此,研究了球孢白僵菌(Beauveriabassiana)BD-B180以及其孢子悬浮液、发酵液对苹果腐烂病菌、苹果轮纹病菌和苹果斑点落叶病菌的抑制作用,以期更好地防治苹果主要病害,为开发新型生物农药、减少化学农药对环境的污染提供理论依据。
1 材料和方法
1.1 供试材料
1.1.1 供试菌株 球孢白僵菌菌株BD-B180,由河北农业大学植物保护学院生物防治实验室提供;苹果树皮腐烂病病原菌(ValsamaliMiyabe et Yamada)、苹果轮纹病病原菌(PhysalosporapiricolaNose)、苹果斑点落叶病病原菌(AlternariamaliRoberts)由河北农业大学植物保护学院植物病理教研室提供。
1.1.2 供试培养基 PDA培养基:马铃薯200 g、葡萄糖20 g、琼脂20 g、蒸馏水1 000 mL。PD液体培养基:配方同 PDA 培养基,不加琼脂。
1.2 试验方法
1.2.1 球孢白僵菌BD-B180与苹果病原菌的平板对峙培养 将保存的球孢白僵菌BD-B180菌株和供试苹果病原菌菌株分别转接到PDA平板上,倒置于恒温光照培养箱中,在25 ℃黑暗条件下恒温培养3~5 d后,用打孔器(7 mm)沿其菌落边缘打菌碟。采用平板对峙培养法,将苹果病原菌菌碟分别接种于PDA平板中央,在苹果病原菌菌碟周围等距离接4块球孢白僵菌菌碟,两者相距3.5 cm。同时以单独接种苹果病原菌的平板为对照(CK),每个处理重复3次。将以上培养皿倒置于恒温光照培养箱中,于25 ℃黑暗条件下恒温培养,每24 h观察各菌株的生长状况,并在两菌株接种点连线上测量病原菌接种点到菌落前缘的距离,每个处理分别从4个不同方向测量4次取平均值[15],直至单独培养的苹果病原菌菌落长满整个培养皿为止,按照下列公式计算抑制率:
T=(K1-K2)/K1×100%
其中,T为抑制率,K1为单独培养苹果病原菌菌落生长半径平均值,K2为对峙培养苹果病原菌菌落生长半径平均值。
1.2.2 球孢白僵菌BD-B180孢子悬浮液对苹果病原菌的抑制作用测定 刮取用PDA培养基培养30 d的球孢白僵菌BD-B180的分生孢子,放入加有10 mL 0.05%吐温-80溶液的玻璃匀浆器中进行研磨,研磨至无沉淀后倒入装有0.05%吐温-80溶液的锥形瓶中,用血球计数的方法确定溶液的浓度,并最终将该溶液配成2.49×107cfu/mL的孢子悬浮液母液,随后用系列稀释法稀释成2.49×106、2.49×105、2.49×104、2.49×103cfu/mL等不同浓度的孢子悬浮液。当PDA培养基温度冷却至40~45 ℃时,吸取9 mL培养基与1 mL振荡均匀的孢子悬浮液混匀,制成含有不同浓度分生孢子的PDA平板。待平板凝固后,将25 ℃黑暗条件下恒温培养3~5 d的供试苹果病原真菌的菌碟(直径7 mm)接种于平板中央,同时以9 mL培养基与1 mL无菌水混匀制成的PDA平板并接种菌碟为对照组,每个处理重复3次。将以上培养皿倒置于恒温光照培养箱中,于25 ℃黑暗条件下恒温培养,每24 h观察各菌株的生长状况,测量记录菌落直径,直至对照培养的苹果病原菌菌落长满整个培养皿为止,采用十字交叉法测量菌落生长直径,按照下列公式计算抑制率:
T=(M1-M2)/M1×100%
其中,T为抑制率,M1为无菌水处理平板中苹果病原菌菌落生长直径平均值-7 mm,M2为孢子悬浮液处理平板中苹果病原菌菌落生长直径平均值-7 mm。
1.2.3 球孢白僵菌BD-B180发酵液对苹果病原菌的抑制作用测定
1.2.3.1 球孢白僵菌BD-B180发酵液的制备 将保存的球孢白僵菌BD-B180菌株转接到PDA平板上活化5 d后,在无菌的条件下,用打孔器(7 mm)打10个菌碟,转接到装有70 mL PD液体培养基的250 mL锥形瓶中,于黑暗条件下120 r/min、25 ℃恒温摇床上振荡培养5 d。之后,以2%的接种量接入含有100 mL PD液体培养基的250 mL锥形瓶中,于黑暗条件下120 r/min、25 ℃的摇床上分别振荡培养5、10、15、20 d。然后用已灭菌的滤纸在无菌条件下进行过滤,滤去菌丝。滤液经5 000 r/min离心15 min去除沉淀[16-17],收集上清液并倒入已灭菌的旋转蒸发仪的收集瓶中进行旋转蒸发,将上清液浓缩10倍。最后经孔径为0.22 μm的细菌过滤器过滤得到球孢白僵菌BD-B180无菌发酵液,置于冰箱(4 ℃)中保存备用。
1.2.3.2 发酵液对苹果病原菌菌丝生长的抑制作用测定 吸取2 mL制备好的发酵液,加入18 mL的PDA培养基,混匀,制成发酵液平板,以加入2 mL无菌水的平板作对照。然后接种苹果病原菌(25 ℃黑暗条件下恒温培养3~5 d)菌碟于平板中央,置于恒温光照培养箱中,于25 ℃黑暗条件下恒温培养,每隔24 h观察各菌株的生长状况,测量记录菌落直径,直至对照培养的苹果病原菌菌落长满整个培养皿为止,采用十字交叉法测量菌落生长直径,按照下列公式计算抑制率:
T=(C1-C2)/C1×100%
其中,T为抑制率,C1为无菌水处理平板中苹果病原菌菌落生长直径平均值,C2为发酵液处理平板中苹果病原菌菌落生长直径平均值[18]。
1.3 数据分析
所得数据经DPS软件统计处理,用Duncan氏新复极差法进行差异显著性分析。
2 结果与分析
2.1 球孢白僵菌BD-B180对苹果病原菌的拮抗作用
球孢白僵菌BD-B180对苹果斑点落叶病菌、苹果腐烂病菌和苹果轮纹病菌均有一定的拮抗作用,其中,对苹果斑点落叶病菌的抑制效果最好,最高抑制率为45.08%,其对苹果轮纹病菌和苹果腐烂病菌的最高抑制率分别为41.35%和39.74%(表1—3)。当球孢白僵菌BD-B180与苹果斑点落叶病菌对峙培养11 d、与苹果腐烂病菌对峙培养6 d和与苹果轮纹病菌对峙培养4 d时,能够观察到球孢白僵菌BD-B180对这3种苹果病原菌菌丝生长有明显的抑制作用(图1),且在球孢白僵菌BD-B180菌株与苹果病原菌菌株沿接种点连线方向的菌丝生长极其缓慢,甚至停止生长。当苹果斑点落叶病菌对峙培养29 d、苹果腐烂病菌对峙培养25 d时,球孢白僵菌BD-B180与这2种病原菌菌株对峙培养处形成明显隔离带,而苹果轮纹病菌对峙培养到29 d时仍不明显(图1)。

表1 球孢白僵菌BD-B180平板对峙培养对苹果斑点落叶病菌生长的抑制作用
注:同列不同大、小写字母表示经Duncan氏新复极差法测验分别在0.01、0.05水平上差异显著,下同。
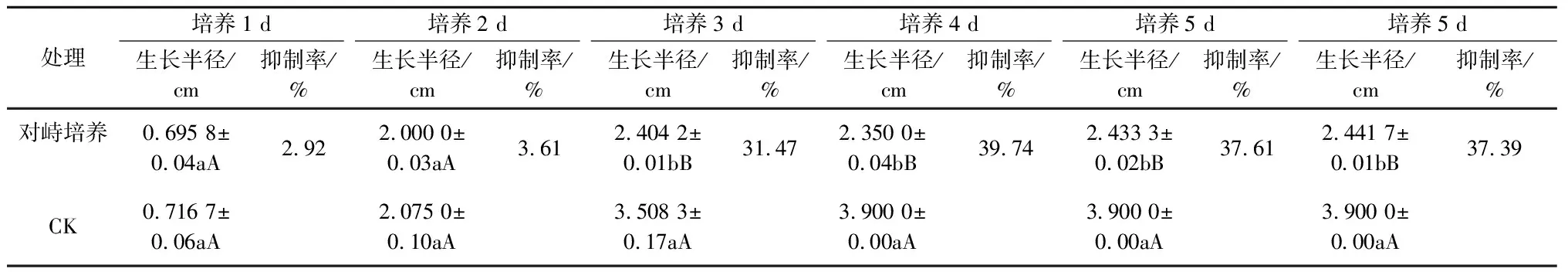
表2 球孢白僵菌BD-B180平板对峙培养对苹果腐烂病菌生长的抑制作用
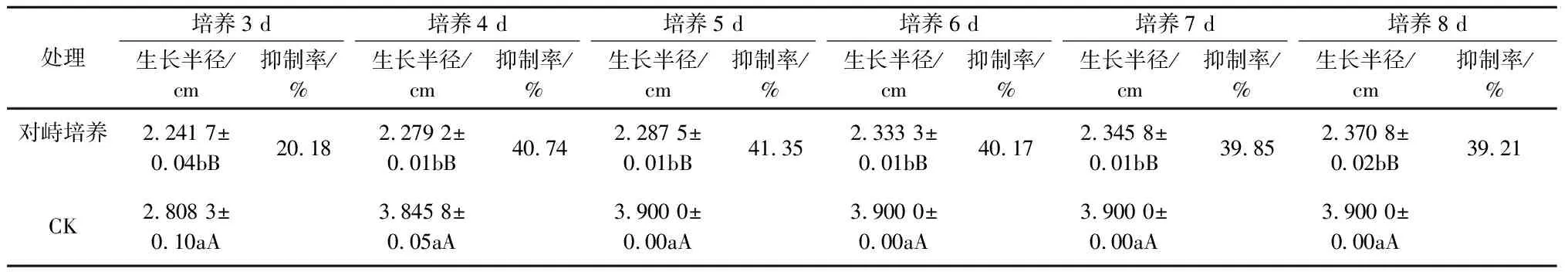
表3 球孢白僵菌BD-B180平板对峙培养对苹果轮纹病菌生长的抑制作用
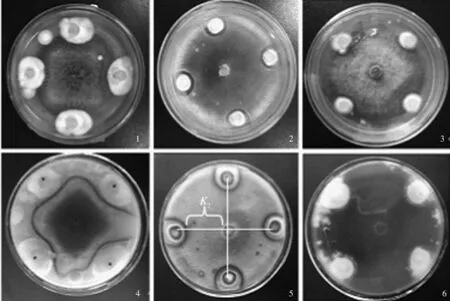
1.球孢白僵菌BD-B180与苹果斑点落叶病菌对峙培养11 d;2.球孢白僵菌BD-B180与苹果腐烂病菌对峙培养6 d;3.球孢白僵菌BD-B180与苹果轮纹病菌对峙培养4 d;4.球孢白僵菌BD-B180与苹果斑点落叶病菌对峙培养29 d(反面);5.球孢白僵菌BD-B180与苹果腐烂病菌对峙培养25 d(反面);6.球孢白僵菌BD-B180与苹果轮纹病菌对峙培养29 d(反面)图1 球孢白僵菌BD-B180与苹果病原菌的对峙培养结果
2.2 球孢白僵菌BD-B180孢子悬浮液对苹果病原菌的抑制作用
从表4可以看出,球孢白僵菌BD-B180孢子悬浮液对3种苹果病原菌均有不同程度的抑制作用。随着孢子悬浮液浓度的增加,对3种苹果病原菌的抑制程度也相应增强。浓度为2.49×107cfu/mL的孢子悬浮液对苹果轮纹病菌的抑制效果最佳,最高抑制率达90.81%,其对苹果斑点落叶病菌和苹果腐烂病菌的最高抑制率分别为77.14%和52.78%,并且在培养3 d时对3种苹果病原菌的抑制率均大于50%。观察发现,在浓度为2.49×107cfu/mL的孢子悬浮液制成的平板上,3种苹果病原菌菌落均被白僵菌包围,且菌落表现出与对照菌落不同的生长状况,苹果腐烂病菌菌落呈微黄色,苹果轮纹病菌菌落和苹果斑点落叶病菌菌落呈黑色,并且在平板上均产生不同大小的抑菌圈(图2)。这可能是病原菌与白僵菌对峙过程中双方的分泌物接触后所表现出的结果,与平板对峙培养时所表现出的对峙状态一致,是两者对空间和营养竞争的结果。
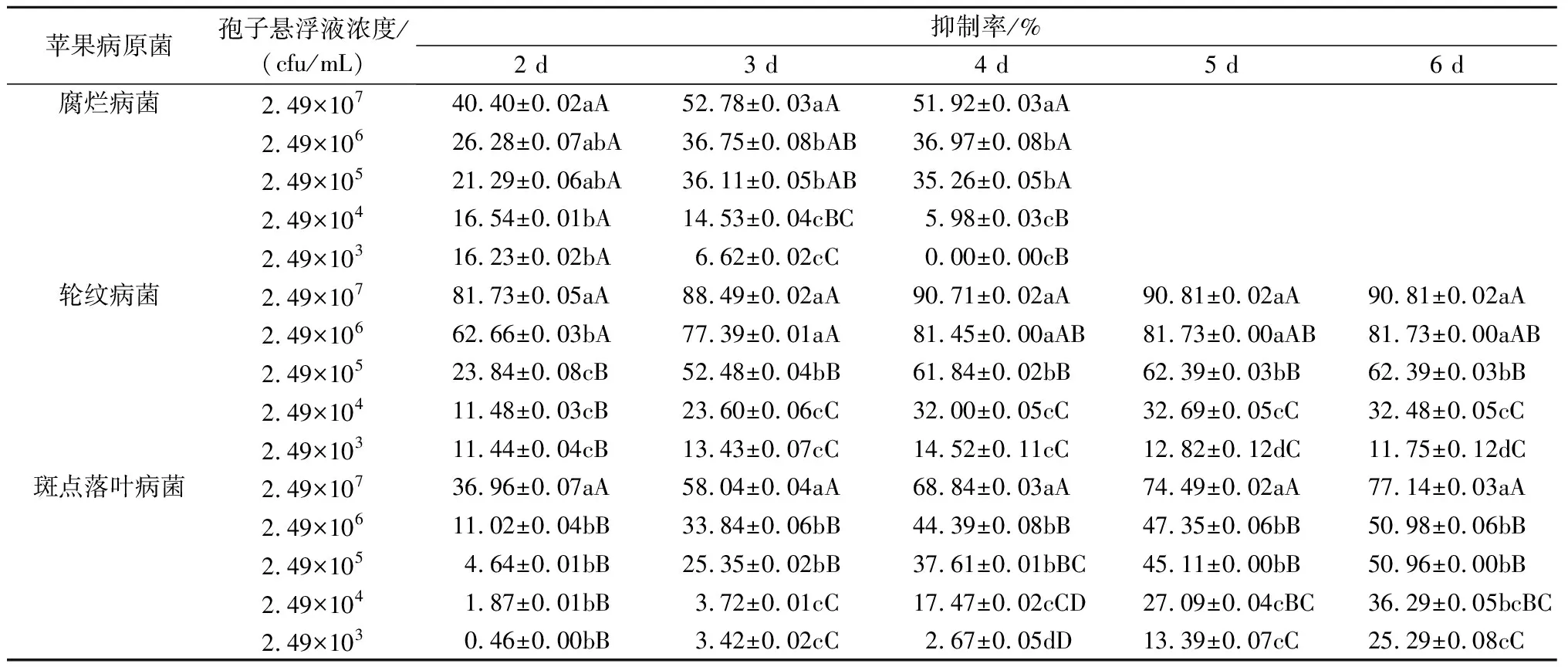
表4 球孢白僵菌BD-B180孢子悬浮液对3种苹果病原菌菌丝生长的抑制作用

1.孢子悬浮液浓度为2.49×107cfu/mL平板上的苹果腐烂病菌(反面);2.孢子悬浮液浓度为2.49×107cfu/mL平板上的苹果斑点落叶病菌(反面);3.孢子悬浮液浓度为2.49×107cfu/mL平板上的苹果轮纹病菌(反面)图2 球孢白僵菌BD-B180孢子悬浮液对苹果病原菌的抑制效果
2.3 球孢白僵菌BD-B180发酵液对苹果病原菌生长的影响
2.3.1 发酵液对苹果病原菌菌丝生长的抑制作用 从表5—7可以看出,球孢白僵菌BD-B180发酵液对苹果腐烂病菌、苹果轮纹病菌和苹果斑点落叶病菌均有不同程度的抑制作用,且随着振荡培养时间的增加,对3种苹果病原菌的抑制效果也明显增加。振荡培养20 d的球孢白僵菌BD-B180发酵液抑菌效果最好,其对苹果腐烂病菌的抑菌效果最明显,最高抑制率达68.33%,对苹果斑点落叶病菌和苹果轮纹病菌的最高抑制率分别为66.42%和59.76%。振荡培养5 d的球孢白僵菌BD-B180发酵液抑菌效果最差,对苹果斑点落叶病菌的最高抑制率仅为11.28%,对苹果轮纹病菌的最高抑制率为12.16%,对苹果腐烂病菌的抑菌效果较好,最高抑制率为40.00%。
2.3.2 发酵液对苹果病原菌菌落的影响 由图3可以看出,在培养相同时间的情况下,加入振荡培养20 d的球孢白僵菌BD-B180发酵液平板上的3种苹果病原菌菌落与对照平板上的菌落有明显的差异。苹果斑点落叶病菌对照菌落生长均匀且黑白相间,而加入发酵液平板上的菌落则较大面积为深绿色且生长不均匀;苹果轮纹病菌对照菌落生长均匀,而加入发酵液平板上的菌落则生长极其不规则,菌丝颜色也相对较深;苹果腐烂病菌对照菌落生长均匀,而加入发酵液平板上的菌落生长相对不均匀,甚至菌碟表面也长满病原菌菌丝。表明振荡培养20 d的球孢白僵菌BD-B180发酵液对3种苹果病原菌菌落均产生了明显的抑制作用,使得这3种苹果病原菌菌丝颜色、生长方式等都发生了明显变化。
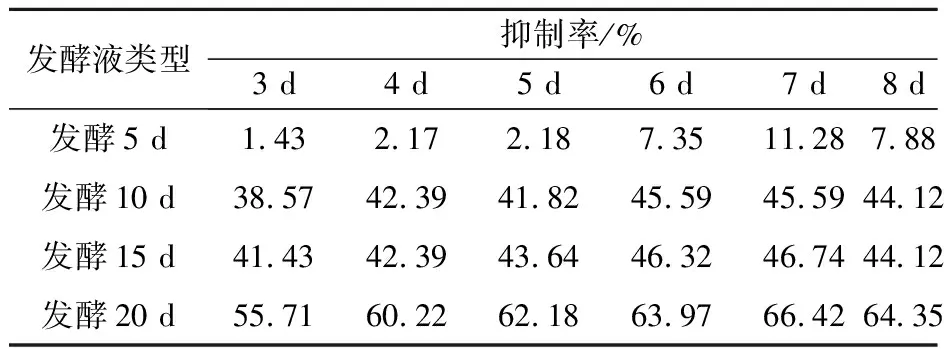
表5 球孢白僵菌BD-B180发酵液对苹果斑点落叶病菌菌丝生长的抑制作用

表6 球孢白僵菌BD-B180发酵液对苹果轮纹病菌菌丝生长的抑制作用

表7 球孢白僵菌BD-B180发酵液对苹果腐烂病菌菌丝生长的抑制作用
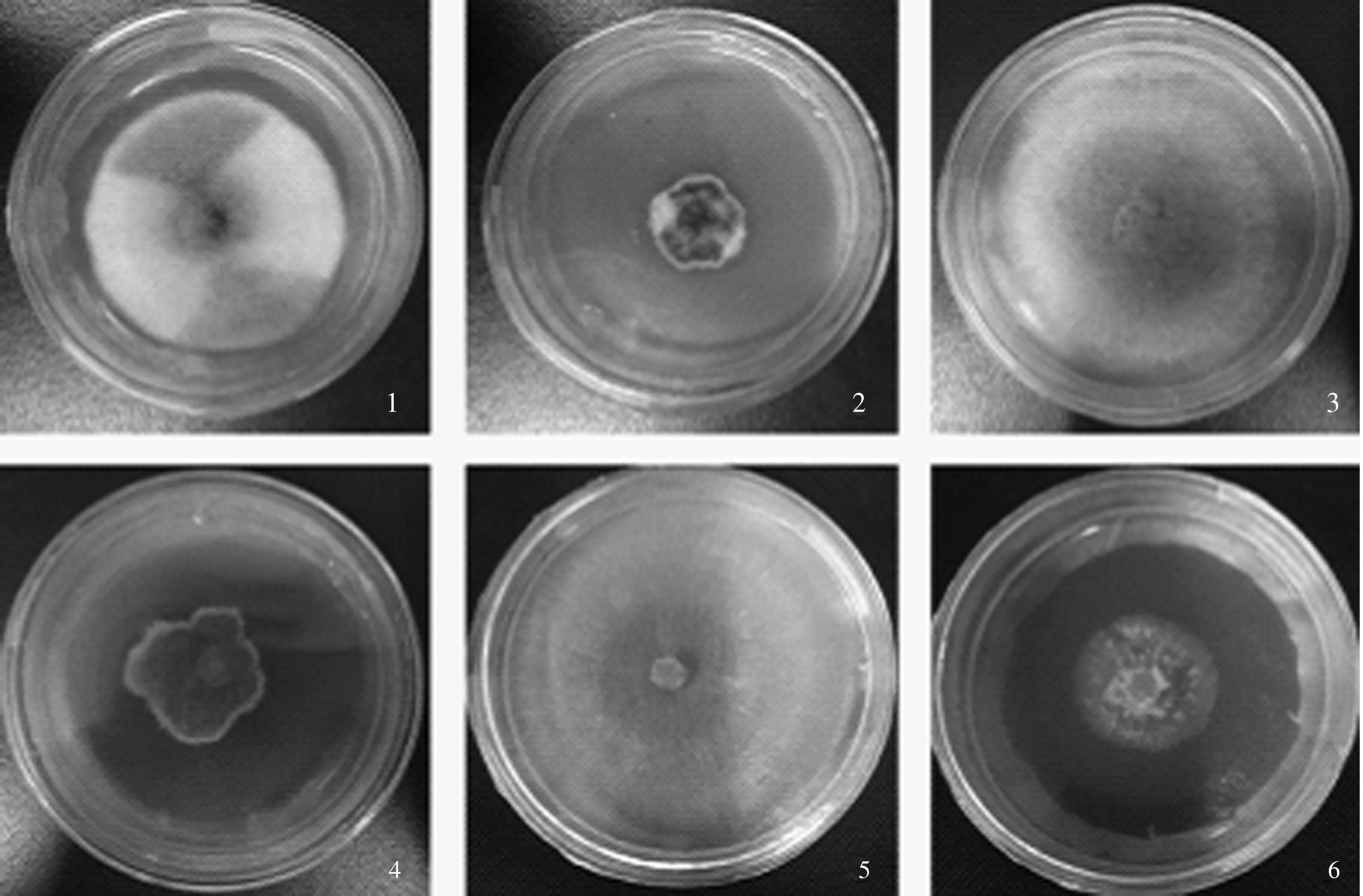
1—2.苹果斑点落叶病菌(1为对照,2为加入振荡培养20 d的球孢白僵菌BD-B180发酵液);3—4.苹果轮纹病菌(3为对照,4为加入振荡培养20 d的球孢白僵菌BD-B180发酵液);5—6.苹果腐烂病菌(5为对照,6为加入振荡培养20 d的球孢白僵菌BD-B180发酵液)
3 结论与讨论
虫生真菌种类繁多、分布广泛,是一种宝贵的生防资源,国外已经有大量成功应用的典例,但主要集中在害虫生防方面[9]。从20世纪90年代开始国外有关于利用金龟子绿僵菌和球孢白僵菌防治甜菜黑胫病的研究报道,但国内有关虫生真菌对植物病原真菌生防作用的报道较少,且主要针对蔬菜和大田作物,如:张胜利等[15]报道,球孢白僵菌对棉花枯萎病菌和棉花红腐病菌的抑制作用明显;齐永霞等[17]报道,金龟子绿僵菌3个不同菌株对小麦纹枯病菌均有较好的抑制作用;何超[19]研究表明,布氏白僵菌Bbr12、Bbr14和Bbr17对水稻稻瘟病菌、油菜菌核病菌、小麦纹枯病菌和玉米小斑病菌具有一定的拮抗作用。然而关于防治果树病害的研究未见报道。
由于绿僵菌和白僵菌具有真菌杀菌剂的诸多优点,目前被普遍认为是最有开发潜力的微生物杀菌剂,已经受到了植物病理学家的青睐。本研究测定已有的白僵菌菌株对3种苹果病原真菌的室内抑制作用,以期筛选出对果树病原真菌具有生防价值的虫生真菌菌株,为虫生真菌应用于果树病害生防以及真菌杀菌剂的开发提供理论依据。对峙培养试验结果表明,球孢白僵菌BD-B180对3种苹果病原真菌均表现出较好的抑制作用。其中,对苹果斑点落叶病菌的抑制率最高,其次是苹果轮纹病菌和苹果腐烂病菌,最高抑制率分别为45.08%、41.35%和39.74%。生防菌对植物病原菌直接的作用机制主要表现为重寄生和拮抗作用2类,而拮抗作用包括占领、抗生作用、竞争作用等方式[15]。在加入球孢白僵菌BD-B180孢子悬浮液的PDA培养基上接种苹果病原真菌,3种真菌菌丝生长均受到不同程度的抑制,抑制程度随孢子浓度增加而增强,当孢子悬浮液浓度为2.49×107cfu/mL时,对苹果轮纹病菌、苹果斑点落叶病菌和苹果腐烂病菌的最高抑制率分别为90.81%、77.14%和52.78%,并且白僵菌生长均对病原菌菌落形成了包围,有的造成病原菌停止生长,说明白僵菌在生长过程中与病原真菌竞争营养和空间,同时还产生了抗生作用,这与夏龙荪等[18]的研究结果相同。发酵液的抑菌效果随着球孢白僵菌发酵时间的增加而增强,振荡培养20 d的发酵液对苹果轮纹病菌、苹果斑点落叶病菌和苹果腐烂病菌的最高抑制率分别为59.76%、66.42%和68.33%。经过发酵后的白僵菌对苹果病原真菌的抑制作用明显增强,说明发酵增加了有效抑菌成分的浓度。有文献报道,一些食用菌发酵液的有效抑菌成分主要为一些小分子质量的蛋白质、多肽、多糖、酚和有机酸类等物质[15]。至于球孢白僵菌BD-B180发酵液的有效抑菌成分以及抑菌机制等问题,还有待进一步的深入研究。此外,还可以考虑将虫生真菌与一些高效、低毒的农药混用,以提高虫生真菌对植物病害的防治效果。
参考文献:
[1] 陈策.我国苹果病害发生和防治概况[J].农药,1996,35(7):6-9.
[2] 刘维.我国苹果种植户收入不平等研究[D].杨凌:西北农林科技大学,2013.
[3] 司秉芝.仁果类果树病害——苹果腐烂病[J].农资科技,1995(3):18-19.
[4] 康玲,郝红梅,杨振英,等.苹果轮纹病研究进展[J].中国农学通报,2009,25(9):188-191.
[5] 吕佩珂,苏慧兰,庞震,等.中国现代果树病虫原色图鉴[M].北京:蓝天出版社,2010.
[6] Kland M J.Chapter 8—Teratogenicity of pesticides and other environmental pollutants [J]. Studies in Environmental Science,1988,31:315-463.
[7] 刘顺字,曹永军.微生物农药应用现状及发展前景[J].河南农业科学,2015,44(5):22-25,30.
[8] 赵国芳.化学农药对环境的影响及其新型农药的研究进展[J].河北农业科学,2010,14(8):56-57,98.
[9] 陈青林.球孢白僵菌和金龟子绿僵菌及其代谢产物的抑菌活性研究[D].合肥:安徽农业大学,2013.
[10] 王英姿,纪明山,祁之秋,等.利用木霉菌生物防治黄瓜枯萎病研究进展[J].北方园艺,2008(10):81-82.
[11] 高智谋,曹君,潘月敏,等.哈茨木霉TH-1对棉花枯萎病菌和黄萎病菌的拮抗机制研究[J].棉花学报,2007,19(3):168-172.
[12] 金玉荣, 殷宏,罗建勋.生防绿僵菌研究进展[J].安徽农业科学,2009,37(5):2060-2062,2077.
[13] 朱薇玲,缪礼鸿,刘晓红,等.芽孢杆菌B15 及其代谢产物对棉花枯萎病菌的抑菌效果[J].湖北农业科学,2006,45(5):604-605.
[14] 夏龙荪.白僵菌和绿僵菌对几种植物病原真菌的拮抗作用研究[D].合肥:安徽农业大学,2013.
[15] 张胜利,李增智.球孢白僵菌对两种植物病原镰孢的拮抗作用[J].中国生物防治学报,2011,27(3):349-356.
[16] 路文雅,张丽,关美娟,等.10种白僵菌菌株发酵液对植物线虫和昆虫病原线虫的生物活性[J].河南农业科学,2016,45(2):349-356.
[17] 齐永霞,陈方新,李增智.绿僵菌对小麦纹枯病菌的抑制作用研究[J].激光生物学报,2011,20(6):758-764.
[18] 夏龙荪,林华峰.白僵菌对几种常见植物病原菌的拮抗作用研究[J].中国生物防治学报,2013,29(2):324-330.
[19] 何超.布氏白僵菌和黄绿绿僵菌对几种植物病原菌的拮抗作用研究[D].合肥:安徽农业大学,2015.

