家蚕抗菌肽基因BmCecropinD的克隆及重组蛋白的自诱导表达
谢 昆,谭玉婷,王 靖,赵 昱,张成桂,杨自忠
(1.红河学院生命科学与技术学院,云南蒙自 661199;2.云南省高校农作物优质高效栽培与安全控制重点实验室,云南蒙自 661199;3.云南省昆虫生物医药研发重点实验室,云南大理 671003)
昆虫体液免疫的主要方式之一是通过血淋巴中的脂肪体细胞应答微生物的感染,诱导抗菌肽(antimicrobial peptides,AMPs)的表达[1]。家蚕作为鳞翅目昆虫的模式生物,其基因组测序已经完成[2],在此基础上,Cheng T等通过BLAST搜索家蚕基因组数据库,发现了35个家蚕抗菌肽基因序列[3],后经不同研究者注释和鉴定,目前确认的结果是,在家蚕基因组中存在7个抗菌肽基因家族,即BmCecropin、BmMoricin、BmGloverin、BmAttacin、BmLebocin、BmEnbocin和BmDefensin,它们根据序列同源性的不同又可以分为不同的亚族,其中BmCecropin具有广谱的抗革兰阳性和阴性菌特性,具有12个基因,6个属于B亚家族成员(BmCecropinB1-B6),其余6个分属于A、D和E亚家族成员[4]。BmCecropinD是BmCecropin家族中一个重要的成员,具有广谱抗菌活性和强的诱导表达活性,在家蚕抵御外界病原微生物入侵方面具有重要作用[5]。自诱导表达系统是William S F于2005年发现的,该系统中含有一定比例的葡萄糖和乳糖,葡萄糖耗尽后乳糖才被利用,目的蛋白开始表达[6]。自诱导表达的最终菌体密度大,蛋白产量高,而且没有毒性,适于重组蛋白的高效表达[7]。本研究以5龄7日家蚕中肠组织为材料,设计特异性引物,通过RT-PCR技术扩增BmCecropinD基因,构建pET32a-BmCecropinD原核表达载体,采用自诱导表达系统表达BmCecropinD重组蛋白,为该蛋白的抑菌活性研究和应用奠定基础。
1 材料与方法
1.1 材料
家蚕(青松×皓月)由蒙自家蚕养殖户提供;质粒小量提取试剂盒、DNA胶回收试剂盒为爱思进生物技术(杭州)有限公司产品;RNAiso Plus为宝生物工程(大连)有限公司产品;T4 DNA链接酶,限制性核酸内切酶为赛默飞世尔科技(中国)有限公司公司产品;DNA Marker DL 2 000、RT-PCR试剂盒、高分子量预染蛋白Marker为生工生物工程(上海)股份有限公司产品。
1.2 方法
1.2.1 引物设计 根据GenBank上公布的BmCecropinD(NM-001043368.2)mRNA序列,应用Primer Primer 5.0引物设计软件设计一对特异性引物如下:F:5′- CAGTCCATGGGCAACTTCTTCAAGGATC-3′,R:5′-CCGCTCGAGTCATTGTCCGAGAGCTTTTGCTTTTG-3′;下划线部分为NcoⅠ/XhoⅠ限制性内切酶识别位点,引物由生工生物工程(上海)股份有限公司合成。
1.2.2 总RNA提取及RT-PCR扩增 取5龄7日家蚕中肠组织,应用RNAiso Plus提取总RNA,方法参考《分子克隆实验指南》。应用宝生物工程(大连)有限公司的PrimeScriptTMOne Step RT-PCR试剂盒,RT-PCR扩增出BmCecropinD抗菌肽基因,20 g/L琼脂糖凝胶电泳检测扩增结果。
1.2.3 表达载体的连接、转化及鉴定 DNA凝胶回收试剂盒回收PCR扩增产物,用NcoⅠ/XhoⅠ分别双酶切BmCecropinD基因和pET32a载体,构建pET32a-BmCecropinD原核表达载体,连接,转化,酶切鉴定,PCR鉴定等参考《分子克隆实验指南》。
1.2.4 BmCecropinD基因的序列测定和分析 将鉴定为阳性的菌液送生工生物工程(上海)股份有限公司测序,应用DNA Star软件对测定的BmCecropinD基因进行序列分析、同源性比较和进化树分析。
1.2.5 重组蛋白的IPTG诱导表达 构建的重组质粒转化BL21感受态细胞,加入终浓度为0.1 mmol/L的IPTG诱导表达重组蛋白,分别收集诱导0 h~6 h菌液,SDS-PAGE电泳检测重组蛋白表达情况。
1.2.6 重组蛋白的自诱导表达 按照William S F的方法进行自诱导表达研究[2]。挑取含有重组质粒的单菌落,接种到4 mL含有100 μg/mL Amp的LB培养基中,37℃、220 r/min培养过夜,再按1% 的接种量接种到10 mL含有100 μg/mL Amp的ZYM-5052 培养基中,37℃、220 r/min培养12、14、16、18、20、22 h,收集菌液,与IPTG诱导的菌液进行SDS-PAGE电泳分析,比较两者重组蛋白表达产率的差异。
2 结果
2.1 家蚕抗菌肽基因的RT-PCR扩增
以5龄7日(5L7D)时期家蚕的中肠组织总RNA为模板,通过RT-PCR技术扩增家蚕BmCecropinD抗菌肽基因,结果显示目的基因大小约为186 bp,与预期结果一致(图1)。

M.DNA标准DL 2 000; 1.BmCecropinD基因的RT-PCR扩增; 2.阴性对照
M.DNA Marker DL 2 000; 1.RT-PCR amplification of BmCecropinD gene; 2.Negative control
图1家蚕抗菌肽基因的RT-PCR扩增
Fig.1 RT-PCR amplification of BmCecropinD gene
2.2 表达载体的构建
构建的pET32a-BmCecropinD原核表达载体,转化BL21感受态细胞,挑取单菌落,提取重组质粒,经PCR鉴定和NcoⅠ/XhoⅠ双酶切鉴定,结果表明外源基因大小与RT-PCR结果一致,说明得到的质粒为阳性重组质粒(图2,图3)。
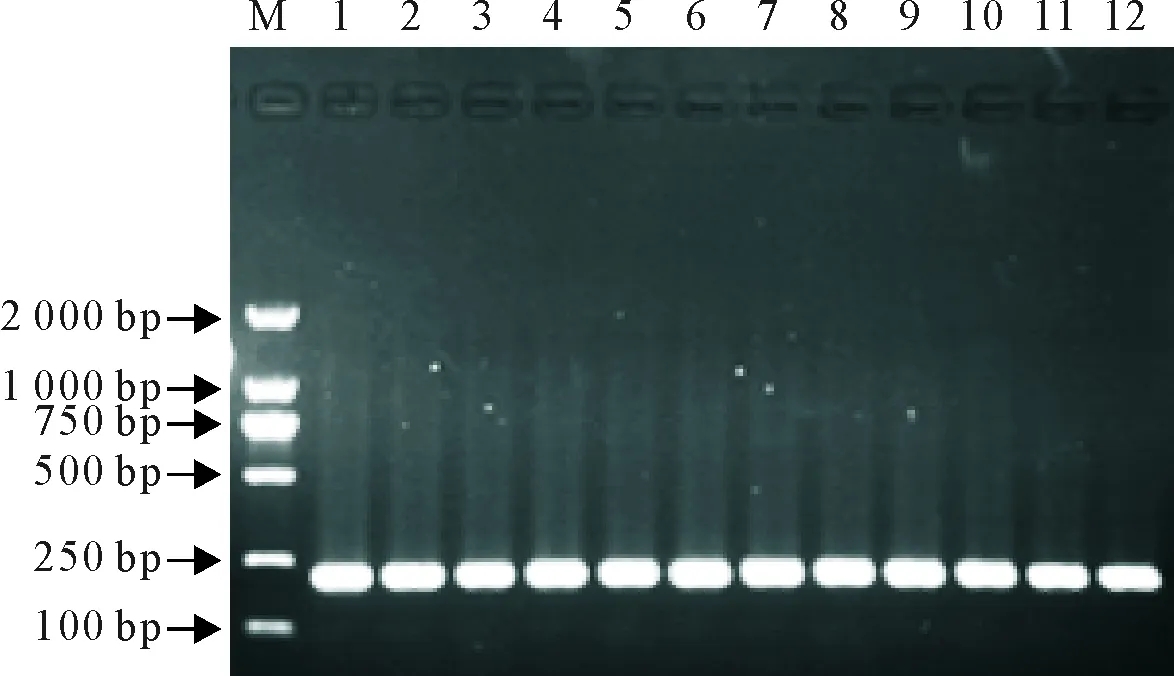
M.DNA标准DL 2 000; 1~12.含pET32a-BmCecropinD质粒的菌液PCR鉴定
M.DNA Marker DL 2 000; 1-12.PCR identification of bacterial liquid carrying pET32a-BmCecropinD plasid
图2重组质粒的PCR鉴定
Fig.2 PCR identification of recombinant plasmids

M.DNA标准DL 5 000; 1.pET32a-BmCecropinD重组质粒的NcoⅠ/XhoⅠ双酶切鉴定
M.DNA Marker DL 2 000; 1.Identification of pET32a-BmCecropinD recombinant plasmid byNcoⅠ/XhoⅠ
图3重组质粒的双酶切鉴定
Fig.3 Identification of recombinant plasmids by double enzyme digestion
2.3 BmCecropinD基因的序列测定及分析
鉴定为阳性的菌株,经大连宝生物公司测序后,得到了BmCecropinD基因的全序列(图4)。该基因全长186 bp,编码61个氨基酸。与GenBank中发表的犬BmCecropinD基因序列比较有1个位点不一致,但不影响氨基酸的编码。

图4 BmCecropinD基因序列测定结果
2.4 BmCecropinD基因编码的氨基酸序列分析
克隆的BmCecropinD基因编码61个氨基酸(图5),预测等电点为10.0,与GenBank上发表的GenBmCecropinD氨基酸序列比较,发现有1个氨基酸发生突变,由异亮氨酸(I)突变为苏氨酸(T)。
2.5 BmCecropinD抗菌肽的二级结构预测与抗原性分析
用DNAStar 对克隆BmCecropinD基因序列编码的氨基酸序列进行蛋白质二级结构预测与抗原性分析后,可以看到BmCecropinD基因推导的蛋白质空间结构具有4个α-螺旋,无β-折叠,1个β-转角和3个无规则卷曲。抗原性强的氨基酸位点在30-38位,非抗原性的氨基酸位点在6-20位点,亲水性少,说明BmCecropinD 抗菌肽疏水性强( 图6) 。
2.6 抗菌肽重组蛋白的自诱导表达
BmCecropinD抗菌肽分别经1 mmol/L浓度IPTG诱导0、1、2、3、4、5、6 h和自诱导表达12、14、16、18、20、22 h后,SDS-PAGE电泳检测显示IPTG和自诱导表达系统皆能成功表达BmCecropinD重组蛋白(图7箭头),凝胶成像扫描仪扫描结果显示自诱导系统诱导16h表达的重组蛋白产率最高达到29%(12泳道),高于IPTG诱导组(表1)。从图7中也可以看出,自诱导系统表达的重组蛋白产率明显高于IPTG诱导组。

图5 BmCecropinD基因编码的氨基酸序列分析
Fig.5 Analysis of amino acid sequence encoded by BmCecropinD gene

图6 BmCecropinD蛋白质二级结构预测与抗原性分析

泳道 Lane1234567891011121314表达产率/%Expression yield31.310.213.415.117.216.815.720.222.524.52928.428.7
3 讨论
抗菌肽存在于大量昆虫细胞中,在正常组织中含量很低,分离纯化难度大,化学合成的成本十分昂贵。因此,通过基因工程技术获得的抗菌肽成为首选方法[8]。一般pET载体系统采用非代谢性乳糖类似物异丙基-β-D-巯基半乳糖苷(IPTG)作为诱导物进行诱导,但由于IPTG 具有潜在的毒性,对菌体生长有一定的抑制作用,且价格昂贵,目前国内外已有很多研究用乳糖代替IPTG作为乳糖启动子的诱导剂[9]。当葡萄糖被耗尽后,细菌利用乳糖表达外源蛋白[6]。自诱导表达的最终菌体密度大,蛋白产量高,而且没有毒性,适于重组蛋白的高效表达。

M.蛋白分子质量标准; 1.含pET32a空质粒的菌液; 2~8.IPTG分别诱导0,1,2,3,4,5,6 h重组菌株; 9~14.自诱导12,14,16,18,20,22 h重组菌株
M.Protein molecular weight Marker; 1.Bacterial liquid carrying pET32a empty plasmid; 2-8.Recombinant bacteria induced by IPTG for 0,1,2,3,4,5 and 6 hours,respectively; 9-14.BmCecropinD expressions by auto-induction for 12,14,16,18,20,22 hours
图7 SDS-PAGE检测BmCecropinD抗菌肽表达产率
Fig.7 The detection of expressing yields of BmCecropinD antibacterial peptide by SDS-PAGE
自然界中大多数多细胞生物活在与微生物经常接触和各种逆境胁迫的环境中。这些生物的生存依赖于体内各种成分参与的宿主防御体系。在高等脊椎动物中,宿主防御依赖于两种类型的免疫反应,即天然免疫和获得性免疫,在昆虫中等无脊椎动物中,宿主防御仅仅依赖于天然免疫[10]。昆虫的免疫反应是一个非常敏感快捷的系统,因此能够有效的抵御外源物质的侵袭。免疫应答主要依赖于三种反应:①血细胞对入侵外源物质的吞噬和包被作用,称为细胞免疫;②蛋白水解级联反应,即当昆虫受到各种伤害刺激后,能够迅速引起酚氧化酶级联反应和血液凝集反应—黑化反应;③当昆虫受到感染后脂肪体或血细胞快速合成大量的抗菌肽分子,并且迅速释放到血淋巴中。后面两种反应方式构成了昆虫的体液免疫[11-12]。
家蚕的体液免疫主要依赖血液中的抗菌肽和蛋白质,抗菌肽有很强的抗菌活性,值得深入研究。在家蚕中有近40个抗菌肽基因被发现,其中BmCecropinD抗菌肽具有极强的抗菌活性[13]。通过RT-PCR技术从5龄7日家蚕中肠组织中克隆BmcecropinD抗菌肽基因,构建pET32a-BmcecropinD重组表达载体,采用自诱导表达系统在大肠埃希菌中对重组蛋白进行自诱导表达,SDS-PAGE电泳检测结果表明重组蛋白表达产率最高达到29%,明显高于IPTG诱导结果,为家蚕抗菌肽的纯化、活性鉴定奠定了基础。
参考文献:
[1] Lemaitre B,Hoffmann J.The host defense ofDrosophilamelanogaster[J].Annu Rev Immunol,2007,(25):697-743.
[2] Xia Q Y,Zhou Z Y,Lu C,et al.A draft sequence for the genome of the domesticated silkworm (Bombyxmori)[J].Science,2004,306(5703):1937-1940.
[3] Cheng T,Zhao P,Liu C,et al.Structures,regulatory regions,and inductive expression patterns of antimicrobial peptide genes in the silkwormBombyxmori[J].Genomics,2006,87(3):356-365.
[4] Tanaka H,Ishibashi J,Fujita K,et al.A genome-wide analysis of genes and gene families involved in innate immunity ofBombyxmori[J].Insect Biochem Mol Biol,2008,38(12):1087-1110.
[5] Wen H,Lan X,Cheng T,et al.Sequence structure and expression pattern of a novel anionic defensin-like gene from silkworm(Bombyxmori)[J].Biochem Biol Rep,2009,36(4):711-716.
[6] William S F.Protein protein production by auto-induction in high-density shaking cultures[J].Protein Expr Purif,2005,41(1):207-234.
[7] 冯 杉.T7 表达系统及自诱导蛋白产出策略[J].北京教育学院学报,2009,4(3):10-15.
[8] 李冠楠,夏雪娟,隆耀航,等.抗菌肽的研究进展及其应用[J].动物营养学报,2014,26(1):17-25.
[9] 陈 亮,任随周,许枚英,等.乳糖替代IPTG诱导脱色酶TpmD基因在大肠杆菌中的高效表达[J].微生物学通报,2009,36(4):551-556.
[10] Hoffmann J A.The immune response ofDrosophila[J].Nature,2003,426(6962):33-38.
[11] Hiily J F,Schmidt S L,Christensen B M.Hemocyte-mediated phagocytosis and melanization in the mosquitoArnigeressubalbatusfollowing immune challenge by bacteria[J].Cell Tissue Res,2003,313(1):117-127.
[12] Buchon N,Broderick N A,Poidevin M,et al.Drosophilaintestinal response to bacterial infection:activation of host defense and stem cell proliferation[J].Cell Host Microb,2009,5(2):200-211.
[13] Yang W Y,Cheng T C,Ye M Q,et al.Functional divergence among silkworm antimicrobial peptide paralogs by the activities of recombinant proteins and the induced expression profiles[J].PLoS One,2011,6(3):e18109.

