咪唑类物质KK-42对日本沼虾免疫功能的影响
王文锋,关建义,宁黔冀
( 1.新乡医学院 生命科学技术学院,河南 新乡 453003; 2.河南师范大学 生命科学学院,河南 新乡 453003 )
日本沼虾(Macrobrachiumnipponense)又名青虾、河虾,主要生活在江河、湖泊及池塘等淡水水域中,为我国重要的淡水养殖品种之一。但随着养殖面积的扩大化,环境污染和病害问题也日趋严重,导致青虾病害蔓延、产量降低[1]。其中,嗜水气单胞菌(Aeromonashydrophila)是淡水养殖水体中一种重要的条件致病菌,当环境条件恶化时,养殖动物免疫机能随之下降,可能会引起疾病的爆发。因此,如何提高虾的抗病能力及免疫力以达到健康养殖,逐渐受到人们的重视。
日本沼虾等甲壳动物缺乏真正的抗体,其主要依靠非特异性免疫方式实现其免疫[2],如体液免疫和细胞免疫。在机体内,诸多免疫因子参与了机体的免疫反应(抗菌肽、溶菌酶、血蓝蛋白和超氧化物歧化酶等)[2-4]。研究表明,当甲壳动物受到外界病原等刺激时,则会引起呼吸爆发以及其他多种的免疫反应,这些反应均会引起大量活性氧的产生。但由于活性氧反应缺乏特异性,一是过量产生的活性氧杀灭入侵的病原微生物的同时,也会对宿主的细胞、组织和器官造成严重伤害[5-6]。但作为机体内的一些抗氧化酶则会及时消除机体内过量的活性氧,以维持机体的正常代谢,其中,超氧化物歧化酶就是抗氧化免疫防御途径中一种极其重要的酶类[7]。超氧化物歧化酶分布广泛,几乎存在于各种需氧生物中[8]。另一种重要的免疫因子——血蓝蛋白,是存在于软体动物和节肢动物的血淋巴中的一种含铜蛋白,除基本的载氧功能外,它还是一种多功能蛋白,目前被尤为关注的是该蛋白所表现出的抗病毒、抗菌和抗血细胞凝集活性以及酚氧化物酶活性等免疫学功能[9-11]。在近年来的研究中,已将机体免疫基因的表达水平以及相应的活力大小作为衡量甲壳动物免疫水平的指标之一[7,12]。
作为一种昆虫生长调节剂,KK-42也开始在甲壳动物方面有了一些应用[13]。如用适宜剂量的KK-42溶液浸泡凡纳滨对虾(Litopenaeusvannamei)体长0.6~0.8 cm虾苗,不仅能加速虾苗的生长速率[14],还可显著提高幼虾的成活率[15],但其作用机制尚不明确。鉴于此,考虑到日本沼虾与凡纳滨对虾为不同的科属,为研究KK-42对日本沼虾是否具有同样的作用并揭示其作用机理,笔者设计了水体常见致病菌——嗜水气单胞菌的体内攻毒试验,分析了KK-42处理前后日本沼虾成活率的变化,以及免疫因子超氧化物歧化酶和血蓝蛋白基因表达水平的变化,以评估KK-42对日本沼虾免疫功能的影响,为KK-42更合理的广泛应用提供理论基础。
1 材料与方法
1.1 材料及试验用虾的养殖
KK-42由烟台大学应用化学系提供(含量≥95%);嗜水气单胞菌由该课题组分离并鉴定。
选取体长(45±0.5) cm蜕皮间期的健康虾,饲养于流水养殖水槽(直径800 mm,高1200 mm,上海海圣工贸有限公司),水温(27±1) ℃,日投喂2次,1周后用于试验。
1.2 日本沼虾超氧化物歧化酶、血蓝蛋白基因mRNA表达量的测定
取蜕皮间期的日本沼虾120尾,随机分为KK-42处理组和对照组。KK-42处理组用0.195 mmol/L的KK-42溶液浸泡处理1 min,取出后迅速控去水分,立刻投入到养殖水槽中,按正常方式饲养;对照组用不含KK-42的溶液处理,方法同上。分别提取处理后0、3、6、12、24、48 h的虾肝胰腺总RNA,用RNase-Free DNase (Promega,USA)去除总RNA中残留的基因组DNA。oligo (dT)18为引物反转录合成cDNA第一链,采用Real-time PCR进行时空表达分析。
根据日本沼虾线粒体锰超氧化物歧化酶(HQ852225)、细胞质锰超氧化物歧化酶(HQ852226)、血蓝蛋白(JF683437)和18S RNA(DQ531769.1)的cDNA序列,分别设计相对应目的基因引物mtSOD-F、mtSOD-R、 cytSOD-F、cytSOD-R、Hc-F、Hc-R和内参基因引物18S RNA-F、18S RNA-R。 Real-time PCR依照SYRB Premix Ex TaqTM(TaKaRa)试剂盒进行。20 μL体系中包括:cDNA模板2.0 μL,上、下游引物(10 μmol/L)各0.4 μL,SYRB Premix Ex TaqTM 1.0 μL, ROX Reference Dye 0.4 μL,ddH2O 6.8 μL。反应条件:95 ℃ 30 s,1 个循环;95 ℃ 5 s,60 ℃ 34 s,40个循环。每组样品设3次重复,以18S rRNA作为内参基因,用2-△△ct来表示基因的相对转录量,结果表示为3个反应的平均值±标准差,利用SPSS 10.0软件进行数据分析。
1.3 日本沼虾超氧化物歧化酶活力的测定
采用超氧化物歧化酶测试盒(南京建成生物工程研究所)测定日本沼虾肝胰腺超氧化物歧化酶活力。
1.4 日本沼虾血蓝蛋白含量的测定
血蓝蛋白含量的测定参照Nickerson等的方法[16],并稍作改进。取血浆样品100 μL,加入900 μL磷酸盐缓冲液,在334 nm下测定光密度值OD334,按下式计算血蓝蛋白质量浓度(mg/mL) :E334 nm= 2.30×OD334
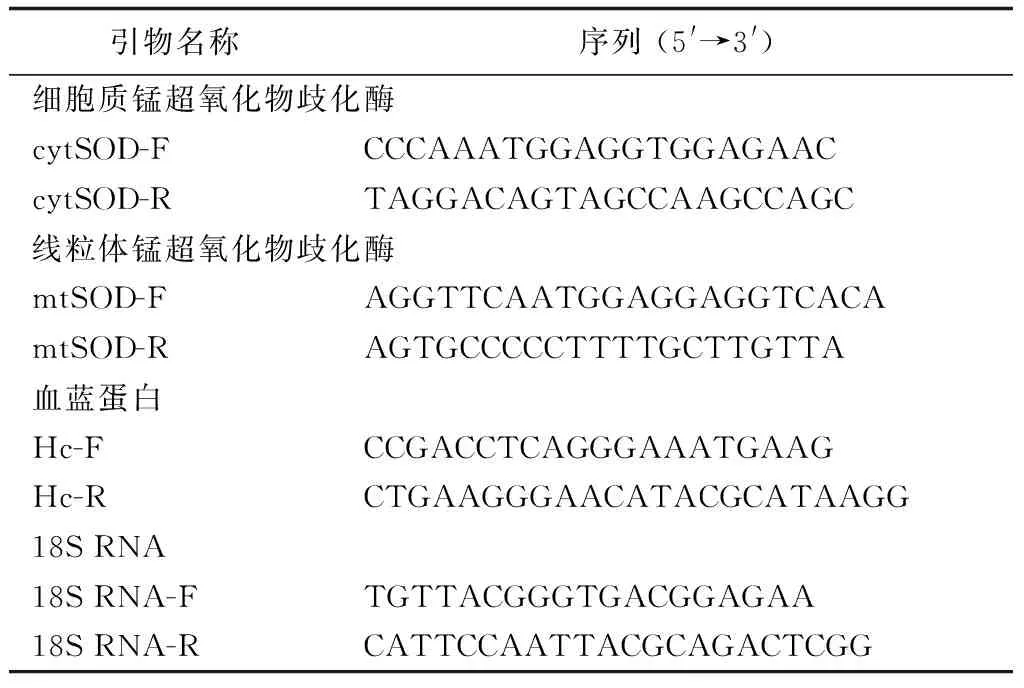
表1 试验中所用引物
1.5 嗜水气单胞菌急性感染试验
选取日本沼虾120尾,随机分为对照组和KK-42处理组(各60尾)。KK-42处理组用KK-42溶液浸泡处理1 min,对照组用不含KK-42的溶液处理,方法同上。用KK-42预处理后12 h,分别向2组虾腹部血窦注射密度为3.0×107个/mL的菌悬液20 μL,每组分别设3次重复。分别于注射后0、3、6、12、24、48 h 计算各组的死亡率。
2 结 果
2.1 KK-42对日本沼虾肝胰腺锰超氧化物歧化酶表达的影响
对照组肝胰腺细胞质锰超氧化物歧化酶和线粒体锰超氧化物歧化酶mRNA的含量变化波动不大(图1)。KK-42可明显诱导细胞质锰超氧化物歧化酶和线粒体锰超氧化物歧化酶基因的表达,在处理后3 h均开始升高,6 h达到峰值,12 h开始下降,24 h恢复到正常水平。在处理后3、6、12 h,处理组与对照组相比,均出现显著性差异(P<0.05)。
对照组中肝胰腺超氧化物歧化酶活力水平表现一定的波动性,但与0 h相比没有统计学意义的差异;试验组在KK-42处理后6 h和12 h 超氧化物歧化酶活力水平显著升高,与相应的对照组相比具有显著差异(P<0.05)(图2)。
2.2 KK-42对日本沼虾血蓝蛋白基因表达及血蓝蛋白含量的影响
KK-42处理能明显诱导肝胰腺血蓝蛋白基因的表达(图3),与对照组相比,分别在KK-42处理后3、6、12 h,血蓝蛋白基因的表达量均出现显著性差异(P<0.05)。
对照组血淋巴中血蓝蛋白含量变化波动不大。KK-42处理显著提高血淋巴中血蓝蛋白的含量,与对照组相比,处理后第3、6、12 h分别提高了60.2%(P<0.01)、54.2%(P<0.05)和76.9%(P<0.01)(图4)。
2.3 KK-42对日本沼虾感染嗜水气单胞菌后的免疫保护
试验期间,感染嗜水气单胞菌后48 h内,对照组死亡率迅速上升,在24 h时升到最高点并趋向稳定;而KK-42处理组死亡率在12 h和24 h与对照组相比呈显著性降低(图5)。
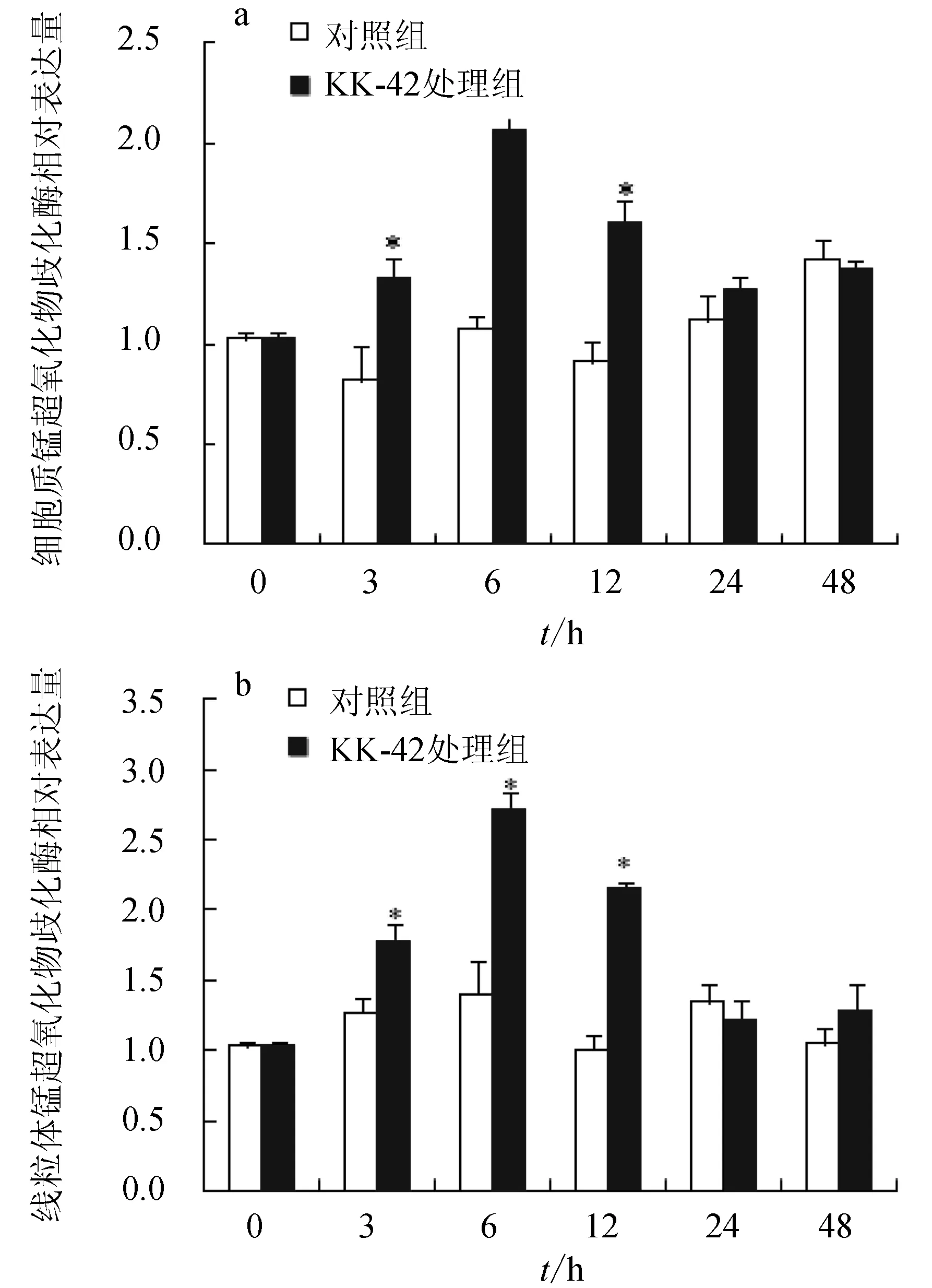
图1 KK-42处理对日本沼虾肝胰腺细胞质锰超氧化物歧化酶(a)和线粒体锰超氧化物歧化酶(b)基因表达的诱导“*”表示与相应对照组相比差异显著(P<0.05).下同.
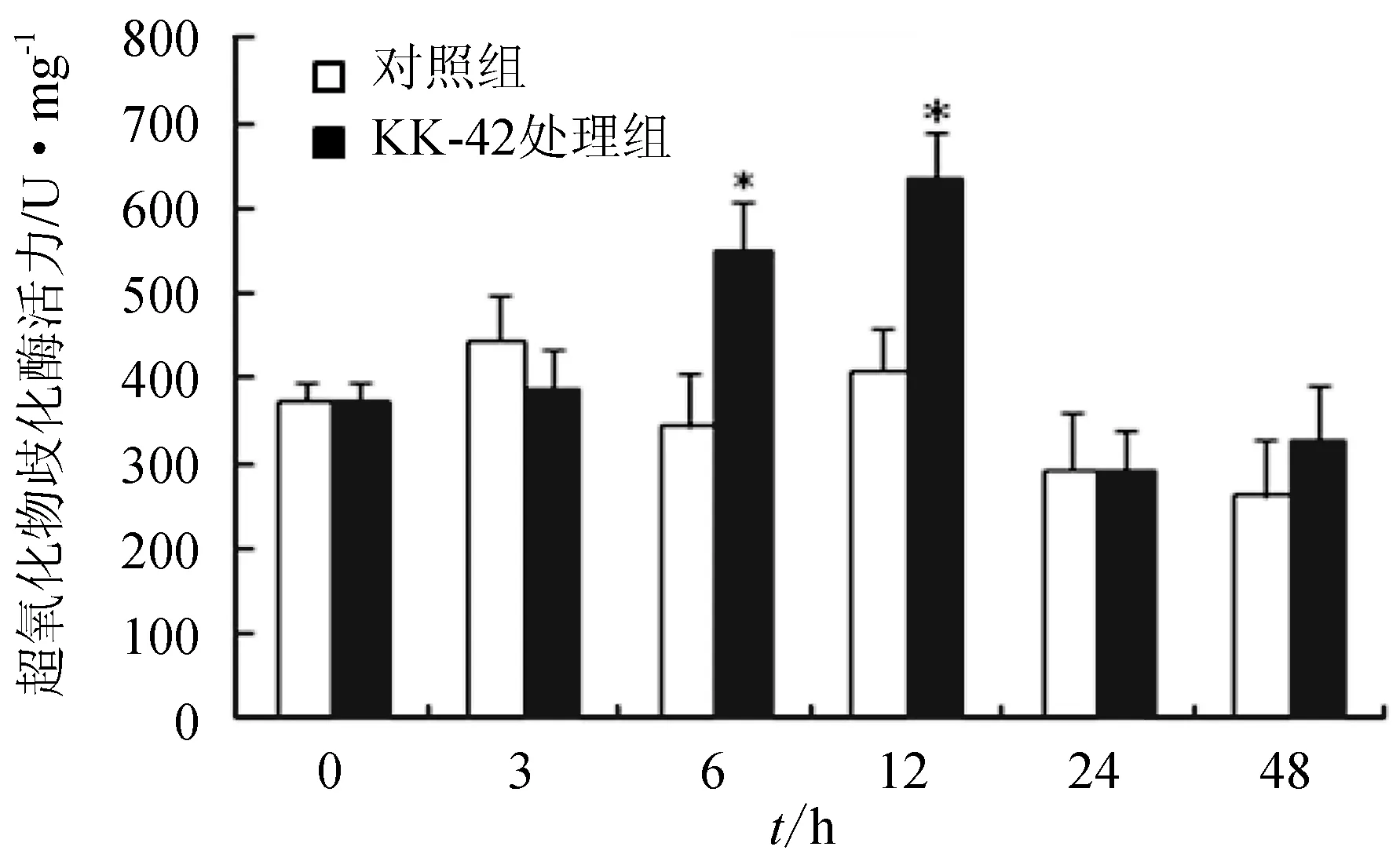
图2 KK-42处理对日本沼虾肝胰腺超氧化物歧化酶活力的影响

图3 KK-42处理对日本沼虾肝胰腺血蓝蛋白基因表达的诱导
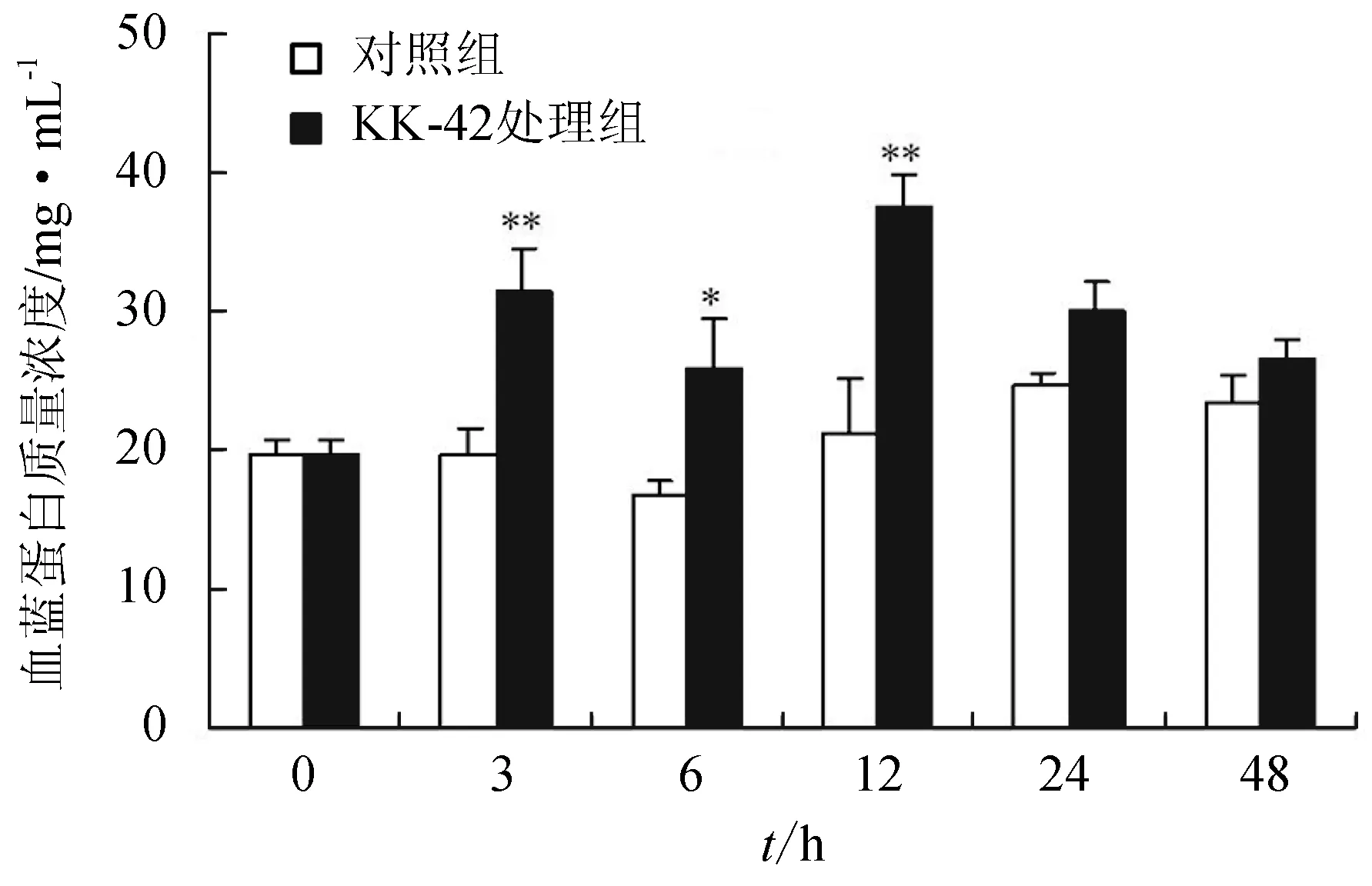
图4 KK-42处理对日本沼虾血蓝蛋白质量浓度的影响“**” 表示与相应对照组相比有极显著差异(P<0.01).下同.

图5 日本沼虾感染嗜水气单胞菌后死亡率与时间变化的关系
3 讨 论
3.1 KK-42对日本沼虾免疫相关基因表达的影响
KK-42是一种咪唑类物质,其主要是作为一种保幼激素拮抗物,如可以在蚕五龄中期适时喷施适当剂量的KK-42,可使五龄期延长,增加蚕的食桑量,也可扰乱昆虫正常变态过程,促进幼虫提前蜕皮,形成畸形小个体,使其脱水、饥饿而死,因这种杀虫方法可以有效防止环境污染,因此KK-42曾广泛用于害虫抗性综合治理[17-18]。鉴于目前KK-42在甲壳动物方面的研究进展[13-15],以及甲壳动物缺乏真正的抗体,主要靠非特异性的方式实现其免疫的特点,研究了KK-42对日本沼虾一些重要免疫因子及其抗菌机能的影响,为其进一步的合理应用打下基础。
在对甲壳动物的研究中,已将超氧化物歧化酶、酚氧化酶、溶菌酶和过氧化物酶等共同作为检测甲壳动物免疫功能的指标酶[12]。鉴于肝胰腺在甲壳动物中执行着代谢、吸收和消化等重要生理功能,同时对环境变化也非常敏感,参与机体的免疫防御反应,因此笔者以肝胰腺为研究对象。研究结果显示,KK-42处理可显著诱导肝胰腺细胞质锰超氧化物歧化酶和线粒体锰超氧化物歧化酶两个基因的表达,在处理后3 h基因表达水平明显升高,6 h达到峰值。肝胰腺中超氧化物歧化酶活力的变化和基因表达基本一致。推测基因表达上调或者相应酶活力增高可能会减轻或避免过量活性氧对机体的伤害,从而提高了机体的免疫机能。也有前期试验表明,KK-42可以诱导另一重要免疫相关基因——酚氧化酶及其活力的表达[19],推测KK-42诱导日本沼虾相关免疫基因的表达有利于动物对不良环境的适应,增强其对致病菌和病毒的免疫能力,增强了动物体的耐受力。
血蓝蛋白是构成甲壳动物免疫防御体系中重要的一员[9-11],其蛋白分子的N端可表现出酚氧化物酶活性, C末端产生的小分子具有抗菌肽的活性[9,20]。因前期试验克隆得到了日本沼虾血蓝蛋白基因的全长cDNA序列,时空表达分析表明,其主要在肝胰腺中表达[20],故本研究以日本沼虾肝胰腺中血蓝蛋白基因表达水平和血淋巴中血蓝蛋白含量的变化作为检测指标,以期探讨KK-42预处理对其表达的影响。结果表明,KK-42处理3 h后,可明显诱导血蓝蛋白基因的表达(图3),血淋巴中血蓝蛋白含量的变化趋势与其基于表达基本一致(图4),推测KK-42可以在转录和翻译水平上调节血蓝蛋白的表达,并通过某种途径刺激血蓝蛋白的释放。增加的血蓝蛋白除满足呼吸等生理需求外,有可能更多地表现出一些免疫活性,如酚氧化酶活性,提高了动物对环境的适应性和对外来病原的抵抗性。
3.2 KK-42对日本沼虾抗菌机能的影响
嗜水气单胞菌是淡水养殖水体中一种常见的条件致病菌,其产生的外毒素,毒性较强,可引发黑鳃病和红体病等,传染性强,发病率高[21]。如环境条件恶化,养殖动物免疫机能随之下降,则可能导致该疾病的爆发。为找到一种适宜的物质以提高日本沼虾的抗菌机能,本研究以日本沼虾的嗜水气单胞菌进行体内攻毒试验,结果表明,经KK-42预处理的日本沼虾感染嗜水气单胞菌后可以显著降低其死亡率,同时,以往的研究表明[19], KK-42处理组还能显著提高对嗜水气单胞菌的清除率,提示KK-42预处理可以提高日本沼虾的抗菌机能。
研究发现,KK-42处理可明显诱导细胞质锰超氧化物歧化酶、线粒体锰超氧化物歧化酶和血蓝蛋白免疫因子的表达和相应酶活力或者蛋白含量的提高,同时,体内嗜水气单胞菌感染试验表明,KK-42预处理能显著降低日本沼虾感染嗜水气单胞菌后的死亡率以及对嗜水气单胞菌的清除率。初步结果表明,KK-42预处理可以提高日本沼虾的抗菌机能。当然,甲壳动物的免疫机制非常复杂,如细胞免疫和体液免疫,对引起的其他因子的反应尚需进一步的研究。
[1] Bachère E.Shrimp immunity and disease control [J]. Aquaculture, 2000,191(1):3-11.
[2] Chang C C, Rahmawaty A, Chang Z W. Molecular and immunological responses of the giant freshwater prawn,Macrobrachiumrosenbergii, to the organophosphorus insecticide, trichlorfon[J]. Aquat Toxicol, 2013,131(2):18-26.
[3] Lin Y C, Chen J C, Chen Y Y, et al. Crowding of white shrimpLitopenaeusvananmeidepresses their immunity to and resistance againstVibrioalginolyticusand white spot syndrome virus[J]. Fish & Shellfish Immunol, 2015,45(1):104-111.
[4] 王文锋,关建义,吕黎, 等.日本沼虾cytMnSOD和mtMnSOD全长克隆及表达分析[J].水产学报, 2012,36(3):49-56.
[5] Duan Y, Zhang J, Dong H, et al. Oxidative stress response of the black tiger shrimpPenaeusmonodontoVibrioparahaemolyticuschallenge[J]. Fish & Shellfish Immunol, 2015,46(2):354-365.
[6] Sun H, Xu X Y, Tian X L, et al. Activation of NF-kappaB and respiratory burst followingAspergillusfumigatusstimulation of macrophages[J]. Immunobiology , 2014, 219(1):25-36.
[7] Duan Y, Zhang J, Dong, H, et al. Effect of desiccation and resubmersion on the oxidative stress response of the kuruma shrimpMarsupenaeusjaponicus[J]. Fish & Shellfish Immunol, 2015,49(1):91-99.
[8] Xie X Q, Li F, Ying S H, et al. Additive contributions of two manganese-cored superoxide dismutases (MnSODs) to antioxidation, UV tolerance and virulence ofBeauveriabassiana[J]. PLoS One, 2012,7(1):e30298.
[9] Yan F, Zhang Y L, Luo H Q , et al. The phenoloxidase activity of hemocyanin from white leg shrimpLitopenaeusvannamei[J]. Fish Sci, 2008, 27(1):5-8.
[10] Lei K Y, Li F, Zhang M C, et al. Difference between hemocyanin subunits from shrimpPenaeusjaponicusin anti-WSSV defense[J]. Dev Comp Immunol, 2008, 32(7):808-813.
[11] Kunlaya S, Vorrapon C, Wang H C, et al. Proteomic analysis of differentially expressed proteins inPenaeusmonodonhemocytes afterVibrioharveyiinfection [J].Proteome Science, 2010, 8(1):39-50.
[12] Liu Y T, Chang C I, Hseu J R, et al. Immune responses of prophenoloxidase and cytosolic manganese superoxide dismutase in the freshwater crayfishCheraxquadricarinatusagainst a virus and bacterium[J]. Mol Immunol, 2013,56(1):72-80.
[13] 王佩,吕艳杰,吕黎,等. 咪唑类物质KK-42对日本沼虾几丁质酶基因表达的影响[J].水产科学,2014,33(12):777-781.
[14] Ning Q J, Fu S G, Xu X J, et al. A new and practical application of JH antagonist KK-42 to promoting growth of shrimpPenaeusschmitti[J]. Aquaculture, 2007, 270(1):422-426.
[15] 宁黔冀, 杨洪,程鸿轩. 保幼激素拮抗物溶液及其提高水产养殖甲壳动物成活率方法:中国,ZL200510017350.X [P]. 2008.
[16] Nickerson K W, Van Hold K E. A comparison of molluscan and arthopod hemocyanin in circular dichroism and absorption spectra[J]. Com Biochem Physiol, 1971, 39(4):855-872.
[17] Liu Y, Zhang Q, Denlinger D L. Imidazole derivative KK-42 boosts pupal diapause incidence and delays diapause termination in several insect species[J]. J Insect Physiol, 2015, 74(1):38.
[18] Kirane-Amrani L, Touiker S Y, Soltani-Mazouni N. Effect of imidazole derivative KK-42 on in vivo development and ecdysteroid levels in pupal stage of meal-worms[J]. Fresenius Environmental Bulletin, 2015,24(5):1856-1861.
[19] 王文锋,关建义, 郭爱莲, 等. 咪唑类物质KK-42提高日本沼虾成活率机制的研究[J].中国免疫学杂志,2014,30(2):162-166.
[20] Fernando L, Garcia C, Keni C,et al. Phenoloxidase activity of hemocyanin in whiteleg shrimpPenaeusvannamei: conversion, characterization of catalytic properties, and role inPostmortemmelanosis[J]. Agric Food Chem, 2008, 56(15):6454-6459.
[21] 王文锋, 夏西超, 王雪参, 等. 日本沼虾血蓝蛋白全长克隆及表达分析[J]. 解剖学报,2012,43(2):90-96.
[22] Sen K, Rodgers M. Distribution of six virulence factors inAeromonasspecies isolated from US drinking water utilities: a PCR identification [J]. J Appl Microbiol, 2004, 97(5):1077-1086.

