临床大样本肝病患者隐匿性HBV感染检出情况及其HBV S基因免疫逃逸突变特点分析
张凯,徐东平,陈容娟,赵丽,刘璐洁,林亚云,李奇,思兰兰,李晓东,李进,蔺淑梅,刘妍
我国约有9 300万慢性乙型肝炎病毒(hepatitis B virus,HBV)感染者,每年有近30万人死于HBV感染所致的肝衰竭、肝硬化(LC)和肝细胞癌(HCC)[1-2]。乙肝表面抗原(hepatitis B surface antigen,HBsAg)是诊断HBV感染、判断抗HBV疗效的重要指标,但有部分HBV感染者血清HBsAg阴性,而血清和(或)肝组织中可以检测到HBV DNA,被称为隐匿性HBV感染(occult hepatitis B virus infection,OBI)[3]。OBI与HBV漏诊、输血传播、乙肝再激活等密切相关。既往研究显示HBV S基因突变与一部分OBI发生密切相关[4-5]。HBsAg由HBV S基因编码,其主要亲水区(major hydrophilic region,MHR)是中和抗体作用的主要靶区域,对HBsAg抗原性具有重要意义,已发现的OBI相关免疫逃逸突变多位于MHR[6-7],目前国内外已报道的主要OBI相关MHR免疫逃逸突变达数10种。本课题组前期从1例OBI患者、3例OBI献血员血清中鉴定了9种代表性MHR免疫逃逸突变株,体外实验研究发现这9种突变HBsAg的抗原性较野生型HBsAg的抗原性明显降低,是引起OBI表现的主要原因之一,并证实突变HBsAg影响当前HBsAg临床诊断试剂的检出能力[8-9]。OBI呈全球性分布,目前已报道的OBI主要见于献血员、HCV或HIV等共感染、免疫受抑制者及健康人群等,大样本研究主要集中于献血员,关于大样本临床肝病患者中OBI检出率少见报道。本研究回顾性分析11 650例肝病患者,探讨肝病患者OBI的检出率以及其HBV S基因MHR免疫逃逸突变特点,并与低滴度、中高滴度HBsAg的慢性乙型肝炎(CHB)患者中检出的MHR免疫逃逸突变进行对比分析。
1 资料与方法
1.1 研究对象 借助本课题组建立的涵盖多种肝脏疾病的HBV基因数据库,回顾性分析于2007年7月-2011年8月在解放军302医院就诊并进行HBV DNA直接测序的11 650例肝病患者样本,调取所有样本对应的临床诊疗资料及HBV直接测序信息。OBI诊断标准依据2008年欧洲肝脏研究学会(EASL)在意大利发布的专家共识[3],即指通过现有技术检测血清HBsAg阴性,但血清和(或)肝组织HBV DNA阳性,由于缺乏肝组织HBV DNA检测,该回顾性研究只分析了血清HBsAg阴性、血清HBV DNA阳性的OBI患者。CHB、HCV感染、LC、HCC等诊断按照我国相关最新指南和诊疗规范的诊断标准执行[2,10-11]。
1.2 筛选方法 本研究从HBV基因数据库筛选有血清HBsAg检测结果的患者,调取血清HBsAg阴性、HBV DNA阳性人群即OBI患者的基本临床资料以及HBV血清学检测结果,并查找已成功测序的HBV S基因序列,鉴定基因型;同时筛选具有低滴度(5IU/ml≤HBsAg≤50IU/ml)、中高滴度(HBsAg ≥400IU/ml)HBsAg并已成功测序的患者,排除合并LC、HCC、HCV感染等疾病的患者,鉴定基因型,选择年龄、性别、基因型与OBI组相匹配的CHB患者作为对照组,对比OBI组与两组不同HBsAg滴度的CHB患者MHR突变检出情况。
1.3 基因型鉴定 根据所测定的HBV S基因序列,应用MEGA4软件构建系统进化树并进行遗传距离分析,鉴定基因型。
1.4 HBV S基因MHR序列分析 用MegAlign软件分析直接测序获得的HBV S基因核酸序列,比对并鉴定MHR免疫逃逸突变,目前国内外已报道的主要OBI相关MHR免疫逃逸突变见表1。HBV标准序列(序列号:AY217378C1、AF458664C2、X75656C3、AB048704C4、D00329B1、AB073823B2、AB033554B3、AB073835B4)来自于NCBI网站(http://www.ncbi.nlm.nih.gov/projects/genotyping/formpagex.cgi)。

表1 文献报道的主要OBI相关HBV S基因MHR免疫逃逸突变[8,12]Tab.1 Previously reported major HBV S-gene MHR immune-escape mutations associated with OBI[8,12]
1.5 血清HBV标志物定性及HBsAg与HBV DNA定量检测 均送往我院检验科完成。采用Roche公司Elecsys定性试剂检测血清HBV标志物,采用HBsAg Elecsys定量试剂检测血清HBsAg(检测下限为0.05IU/ml);采用实时荧光定量PCR检测血清HBV DNA(检测下限为40IU/ml)。
1.6 统计学处理 采用SPSS 18.0软件进行统计分析。计量资料以±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 临床大样本肝病患者中OBI的检出率 11 650例肝病患者中共计6996例患者进行血清HBsAg定量检测,其中5752例血清HBV DNA阳性,从中筛出血清HBsAg阴性且HBV DNA阳性的OBI患者12例,因此OBI检出率为0.172%(12/6996)。同时分别筛选出年龄、性别、基因型与OBI组相匹配的低滴度和中高滴度HBsAg并有直接测序结果的CHB患者32例和50例作为对照组。详细筛选流程见图1。
2.2 OBI患者基本特征 12例OBI患者的血清抗-HBc均为阳性,其中8例伴抗-HBs阳性,3例伴抗-HBe阳性。有1例患者(P9)为HCV感染相关LC患者,该患者于30年前患急性乙肝;11例既往为CHB患者。有7例患者既往服用包括阿德福韦酯和拉米夫定在内的NAs进行抗病毒治疗。12例OBI患者基本资料见表2。
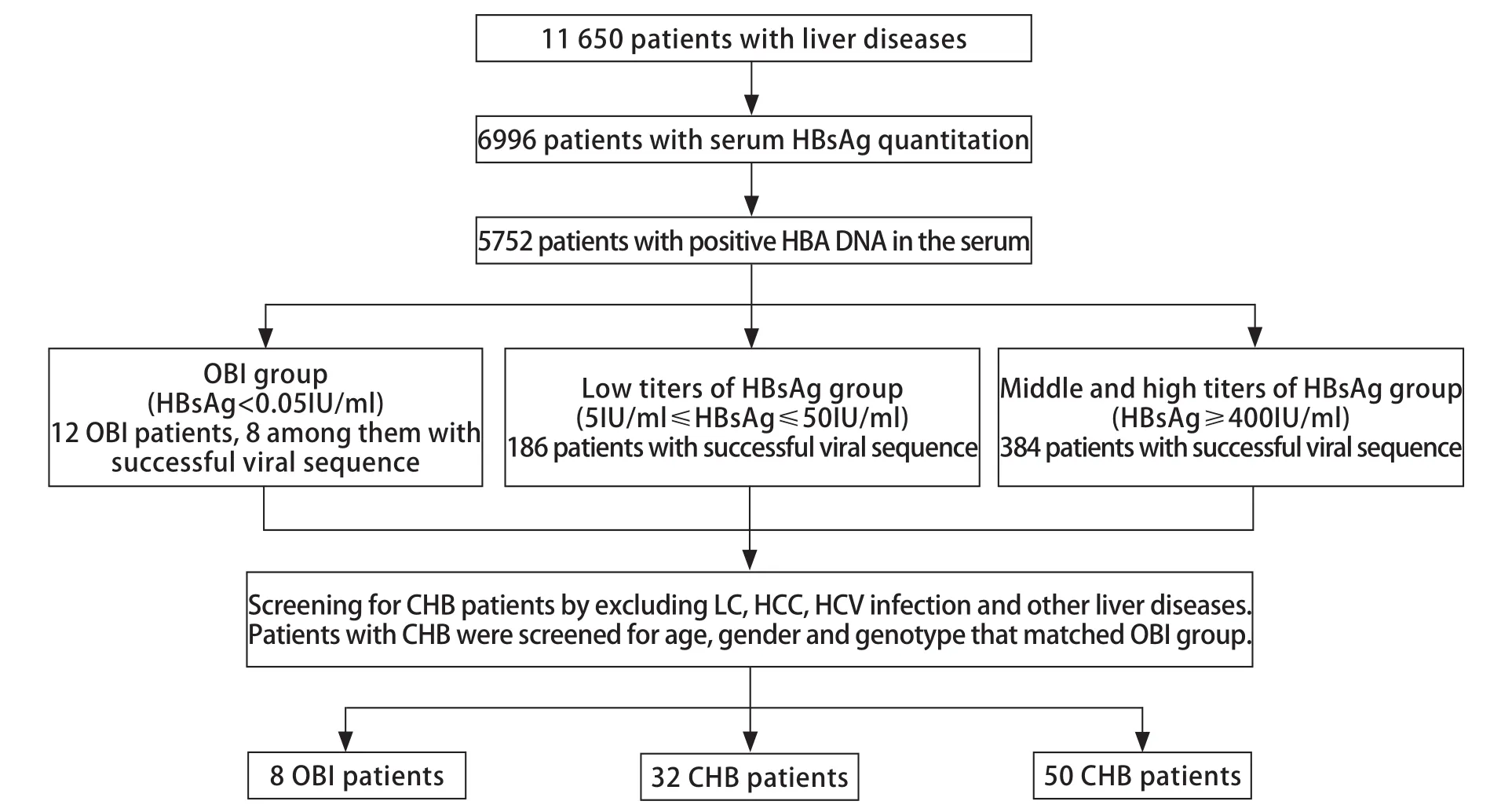
图1 OBI患者筛选流程图Fig.1 Flow chart of OBI patient selection
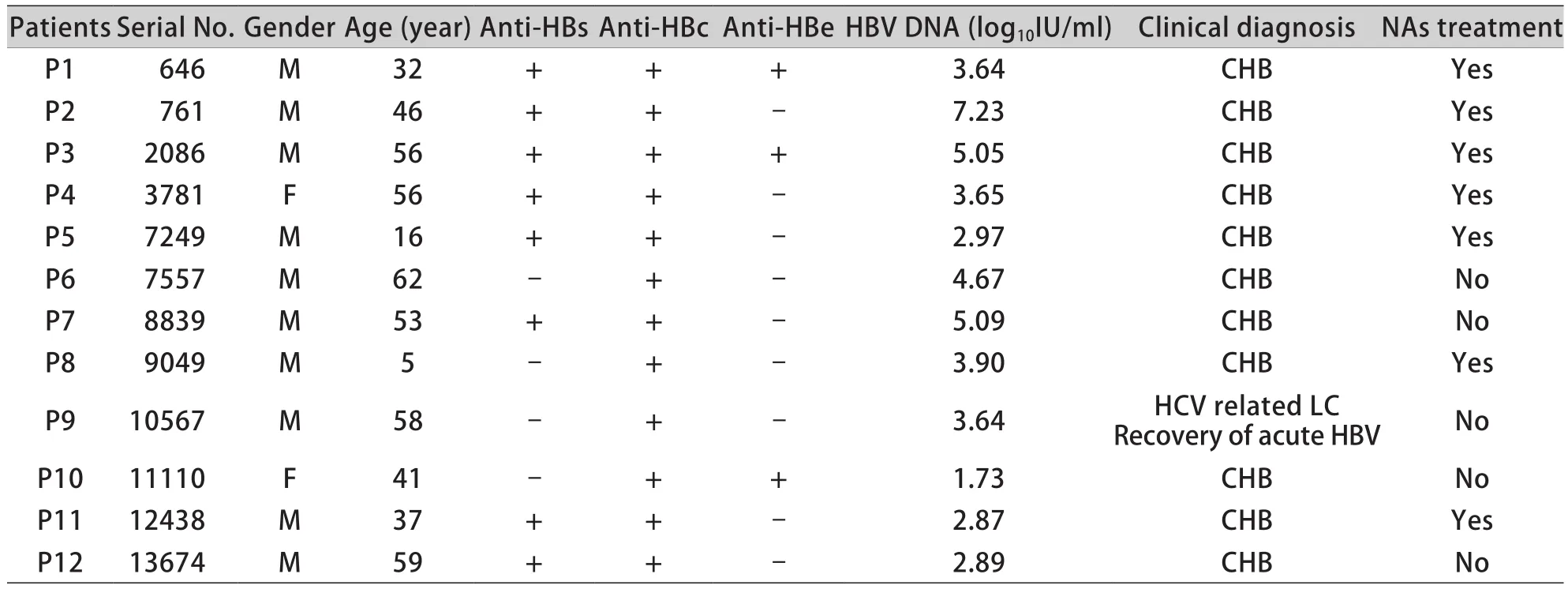
表2 12例OBI患者基本资料Tab.2 Basic information of 12 OBI patients
2.3 OBI患者与CHB患者MHR免疫逃逸突变对比
12例OBI患者中有8例直接测序成功,且此8例既往均被诊断为CHB,其中6例检出存在HBV S基因MHR免疫逃逸突变(75%,6/8);低滴度HBsAg组共有8例检测出MHR突变(25%,8/32),结合表1显示包括经典突变sG145R在内的9种是已报道的OBI相关MHR突变;中高滴度HBsAg组共有20例存在MHR突变(40%,20/50),主要突变包括sL110I、sT113S、sS143T、sR160K和sF161Y,除sS143T外均不是已报道且公认的OBI相关突变。将8例(P2-P8、P12)已成功测序的OBI患者与低滴度HBsAg组和中高滴度HBsAg组的CHB患者临床资料及MHR突变信息进行对比分析,OBI组均为C基因型,低滴度HBsAg组B、C基因型分别为4例(4/32)和28例(28/32),中高滴度HBsAg组B、C基因型分别为9例(9/50)和41例(41/50)。3组患者服用NAs抗HBV治疗人数比例分别为62.50%、56.25%和70.00%(P=0.453),MHR突变率分别为75.00%、25.00%和40.00%(P=0.029,表3)。
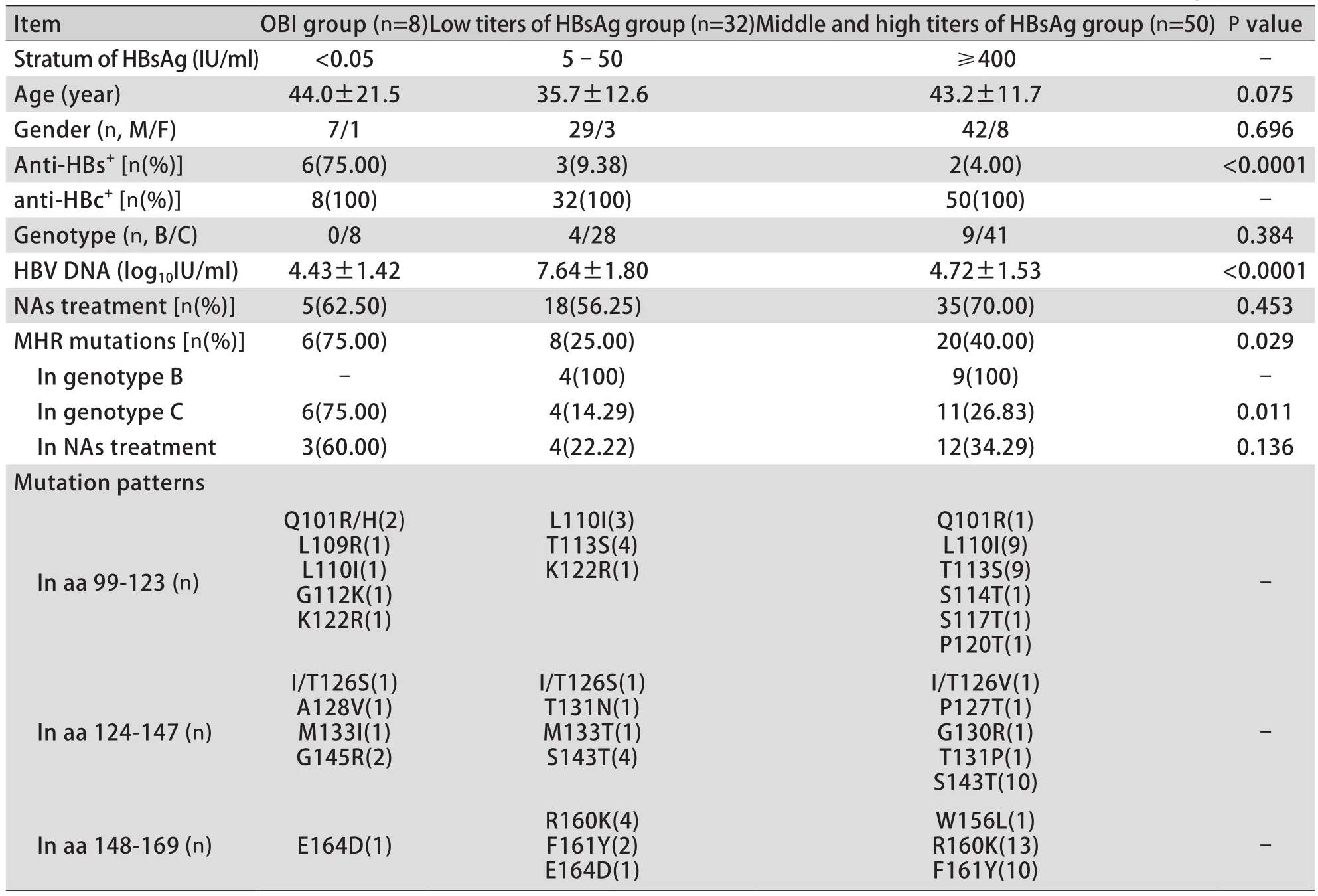
表3 OBI与不同滴度HBsAg的CHB患者MHR免疫逃逸突变检出情况Tab.3 Detection of MHR immune-escape mutations in OBI and CHB patients with different HBsAg levels
3 讨 论
OBI呈全球性分布[4,7,13],截至目前HBV高、低流行区域均报道有OBI检出,但其流行情况报道差异较大,这与HBV流行地区、检测方法、调查人群及调查时间段等有关。有研究报道OBI检出率在献血员中为0.002%~18.670%[7,14-18],在HCV感染人群中为8.6%~39.2%[19-21],还有HIV共感染、血液透析、接受经免疫抑制剂或化疗药物治疗及健康人群等也多检出OBI。但目前缺乏关于肝病人群中OBI流行情况及与HBV S基因MHR免疫逃逸突变相关性等方面的临床大样本研究。
本研究在6996例肝病患者中检出12例OBI患者,检出率(0.172%,12/6996)明显高于我国2015年以来献血员人群的OBI发生率(0.015%~0.097%)[17,22-24]。如表2所示,本研究筛选出的OBI患者均与HBV感染相关。研究结果显示数据库中大样本筛选出的OBI患者多数(7例,58.33%)是接受NAs药物抗病毒治疗后HBsAg转阴或发生血清学转换的患者,病毒多呈低、中水平复制。从结果可以看出肝病患者OBI与献血员OBI具有不同的特点,本研究中OBI患者的血清抗-HBc均为阳性,HBV DNA复制水平高于献血员OBI,具有明确的HBV感染史,且多数经历过抗病毒等干预治疗。需要注意的是,本研究纳入的均为血清HBV DNA阳性样本,已知血清HBV DNA呈间歇性出现,并且临床上还存在一部分血清HBV DNA阴性但肝组织中HBV DNA阳性的OBI,因此整体肝病人群中的OBI检出率可能会高于本研究结果。
近年来HBsAg清除或消失成为判断HBV临床治愈的主要指标之一,HBV临床治愈指持续病毒学应答且HBsAg阴转或伴有抗-HBs阳转、ALT正常、肝组织学病变轻微或无病变[2]。本研究提示一部分“临床治愈”的患者血清HBsAg阴性或低于检测下限是一种假象,可能处于OBI状态,病毒继续复制,肝脏炎症活动仍继续,有不断进展甚至发生HCC的风险,另外如果接受免疫抑制剂等治疗或罹患其他疾病使免疫系统受到强烈抑制,HBV可再次被激活,因此建议对于治疗后血清HBsAg阴性患者仍应定期复查病毒学及肝脏炎症活动相关指标。
本研究中8例OBI患者HBV DNA测序成功,其中有6例发生MHR突变,涉及10个氨基酸(aa)位点,包括经典免疫逃逸突变sG145R,由于该组样本例数少,不能据此判定哪些突变与OBI相关,但结合表1汇总的已报道的主要OBI相关HBV S基因突变,认为MHR突变sQ101R/H、sL109R、sG112K、sK122R、sI/T126S、sA128V、sM133I/T、sG145R和sE164D均可能与OBI发生相关。低滴度HBsAg组CHB患者中有8例检出MHR突变,其中sL110I、sT113S、sS143T、sR160K和sF161Y最为多见;中高滴度HBsAg组CHB患者中有20例检出MHR突变,主要的突变为与低滴度HBsAg组突变检出情况一致,除sS143T突变外,其余4种突变均不是目前已报道的主要OBI相关MHR免疫逃逸突变,提示并非所有MHR突变均与OBI发生相关,推测不同MHR突变的机制及作用方向不同。
我国传染病诊断试剂与疫苗工程技术研究中心对38 499例HBsAg阴性献血员进行的大样本回顾性分析研究显示,在OBI组、低滴度HBsAg组(0.05~100IU/ml)、高滴度HBsAg组(>100IU/ml)MHR突变率分别为55.7%(34/61)、34.0%(52/153)和13.0%(7/54),即随着HBsAg滴度越高,突变率越低[7]。本研究中OBI与低滴度、中高滴度HBsAg的CHB患者MHR突变率分别为75.00%、25.00%和40.00%,OBI组的MHR突变率明显高于其他两组(P=0.029),而中高滴度HBsAg组MHR突变检出率反而高于低滴度HBsAg组,与上述研究结果不完全一致。分析两项研究结果不一致的原因除研究人群、HBsAg分层方法及样本数量等因素外,其中一个重要的原因可能在于NAs抗病毒药物的使用。
本研究中3组NAs药物服用率分别为62.50%、56.25%、70.00%(P=0.453),即3组中多数患者均进行抗病毒治疗。HBV S基因突变主要在自然条件、预防接种或抗病毒治疗等条件下产生[4]。近期一项研究显示NAs治疗组免疫逃逸突变率明显高于未治疗组(24.4% vs. 10.9%,P<0.05),且11种联合突变仅出现在NAs治疗组,其中9种不伴随耐药突变,即免疫逃逸突变的出现不是因为耐药突变所引起[25]。Lacombe等[26]学者在抗HBV治疗随访过程中发现,HBV S基因相关疫苗逃逸突变株随时间不断稳定增加。结合诸多学者的研究结论,我们考虑本研究中的HBV S基因MHR突变应该主要是在NAs治疗压力条件下产生,因此CHB患者组也有较高的MHR突变检出率。目前强效、高耐药基因屏障的NAs仍是抗HBV的一线用药,所以在抗病毒治疗过程中尤其进行长期NAs治疗时应关注HBV S基因突变及OBI的发生。
值得注意的是,OBI组的血清抗-HBs阳性率高达75.00%,明显高于其他两组CHB患者。这可能与突变HBsAg诱导产生低结合力的抗-HBs抗体,进而产生位阻效应干扰HBsAg检测试剂检测有关。近期我国一项研究纳入两组CHB患者,组Ⅰ为145例抗-HBs阳性的患者,组Ⅱ为141例血清抗-HBs阴性的患者,研究显示组Ⅰ的“a”决定簇突变率明显高于组Ⅱ(4.05% vs. 1.22%,P<0.05),进一步分析发现组Ⅰ中包括sG145R在内的突变削弱了源于疫苗接种人群的抗-HBs抗体的中和能力[27]。
综上所述,本研究中肝病患者OBI发生率高于近几年报道的我国献血人员的OBI发生率;多数OBI中检出的MHR突变是已报道的OBI相关MHR免疫逃逸突变,其产生与NAs抗病毒药物治疗压力关系密切,应引起重视;OBI中检出的MHR突变是已报道的OBI相关MHR免疫逃逸突变,而在不同HBsAg滴度的CHB患者中检出的MHR突变大多不是已报道且公认的OBI相关突变,提示并非所有的MHR突变均能引起OBI表现。
[1]Wang FS, Fan JG, Zhang Z, et al. The global burden of liver disease: the major impact of China[J]. Hepatology, 2014, 60(6):2099-2108.
[2]Wang GQ, Wang FS, Cheng J, et al. The guideline of prevention and treatment for chronic hepatitis B: a 2015 update[J]. Chin J Exp Clin Infect Dis (Electron Ed), 2015, 9(5): 570-589. [王贵强, 王福生, 成军, 等. 慢性乙型肝炎防治指南(2015年版)[J].中华实验和临床感染病杂志(电子版), 2015, 9(5): 570-589.]
[3]Raimondo G, Allain JP, Brunetto MR, et al. Statements from the Taormina expert meeting on occult hepatitis B virus infection[J]. J Hepatol, 2008, 49(4): 652-657.
[4]Pollicino T, Cacciola I, Saffioti F, et al. Hepatitis B virus PreS/S gene variants: pathobiology and clinical implications[J]. J Hepatol, 2014, 61(2): 408-417.
[5]Zhang K, Liu Y, Chen RJ, et al. Analysis of the influence of nine occult HBV infection-related S-gene mutations on HBsAg detection[J]. Med J Chin PLA, 2017, 42(10): 865-869. [张凯,刘妍, 陈容娟, 等. 隐匿性HBV感染相关S基因突变对HBsAg检测的影响及其机制[J]. 解放军医学杂志, 2017, 42(10):865-869.]
[6]Samal J, Kandpal M, Vivekanandan P. Molecular mechanisms underlying occult hepatitis B virus infection[J]. Clin Microbiol Rev, 2012, 25(1): 142-163.
[7]Huang CH, Yuan Q, Chen PJ, et al. Influence of mutations in hepatitis B virus surface protein on viral antigenicity and phenotype in occult HBV strains from blood donors[J]. J Hepatol, 2012, 57(4): 720-729.
[8]Zhang K, Liu Y, Chen R, et al. Antigenicity reduction contributes mostly to poor detectability of HBsAg by hepatitis B virus (HBV)S-gene mutants isolated from individuals with occult HBV infection[J]. J Med Virol, 2018, 90(2): 263-270.
[9]Zhang K, Liu Y, Chen RJ, et al. Analysis of the influence of nine occult HBV infection-related S-gene mutations on HBsAg detection[J]. Med J Chin PLA, 2017, 42(10): 865-869. [张凯,刘妍, 陈容娟, 等. 隐匿性HBV感染相关S基因突变对HBsAg检测的影响及其机制[J]. 解放军医学杂志, 2017, 42(10):865-869.]
[10]Chinese Society of Hepatology and Chinese Society of Infectious Diseases, Chinese Medical Association. The guideline of prevention and treatment for chronic hepatitis C: a 2015 update[J]. Chin Hepatol, 2015, 20(12): 933-949. [中华医学会肝病学分会, 中华医学会感染病学分会. 丙型肝炎防治指南(2015年更新版)[J]. 肝脏, 2015, 20(12): 933-949.]
[11]Health and Family Planning Commission of the People's Republic of China. Diagnosis, management, and treatment of hepatocellular carcinoma (V2017)[J]. Infect Dis Info, 2017,30(3): 705-720. [中华人民共和国卫生和计划生育委员会医政医管局. 原发性肝癌诊疗规范(2017年版)[J]. 传染病信息, 2017, 30(3): 705-720.]
[12]Chen J, Liu Y, Zhao J, et al. Characterization of novel hepatitis B virus preS/S-gene mutations in a patient with occult hepatitis B virus infection[J]. PLoS One, 2016, 11(5): e0155654.
[13]Minuk GY, Sun DF, Uhanova J, et al. Occult hepatitis B virus infection in a North American community-based population[J].J Hepatol, 2005, 42(4): 480-485.
[14]Seo DH, Whang DH, Song EY, et al. Prevalence of antibodies to hepatitis B core antigen and occult hepatitis B virus infections in Korean blood donors[J]. Transfusion, 2011, 51(8): 1840-1846.
[15]Thedja MD, Roni M, Harahap AR, et al. Occult hepatitis B in blood donors in Indonesia: altered antigenicity of the hepatitis B virus surface protein[J]. Hepatol Int, 2010, 4(3): 608-614.
[16]Yuen MF, Lee CK, Wong DK, et al. Prevalence of occult hepatitis B infection in a highly endemic area for chronic hepatitis B: a study of a large blood donor population[J]. Gut, 2010, 59(10):1389-1393.
[17]Wang Z, Zeng J, Li T, et al. Prevalence of hepatitis B surface antigen (HBsAg) in a blood donor population born prior to and after implementation of universal HBV vaccination in Shenzhen,China[J]. BMC Infect Dis, 2016, 16(1): 498.
[18]Kiely P, Margaritis AR, Seed CR, et al. Hepatitis B virus nucleic acid amplification testing of Australian blood donors highlights the complexity of confirming occult hepatitis B virus infection[J]. Transfusion, 2014, 54(8): 2084-2091.
[19]Chen HY, Su TH, Tseng TC, et al. Impact of occult hepatitis B on the clinical outcomes of patients with chronic hepatitis C virus infection: a 10-year follow-up[J]. J Formos Med Assoc, 2016,116(9): 697-704.
[20]Vakili Ghartavol Z, Alavian SM, Amini S, et al. Prevalence of occult hepatitis B virus in plasma and peripheral blood mononuclear cell compartments of patients with chronic hepatitis C infection in tehran-iran[J]. Hepat Mon, 2013, 13(5):e10134.
[21]Squadrito G, Cacciola I, Alibrandi A, et al. Impact of occult hepatitis B virus infection on the outcome of chronic hepatitis C[J]. J Hepatol, 2013, 59(4): 696-700.
[22]Lin H, Zhao H, Tang X, et al. Serological patterns and molecular characterization of occult hepatitis B virus infection among blood donors[J]. Hepat Mon, 2016, 16(10): e40492.
[23]Kuang JP. Application of nucleic acid to detect hepatitis B virus in blood donors[J]. Mod Diagn Treat, 2015, 1(10): 2344-2345.[旷洁平. 应用核酸检测献血者乙型肝炎病毒的效果分析[J]. 现代诊断与治疗, 2015, 1(10): 2344-2345.]
[24]Zhang T, Liao HM, Zhang CH, et al. Characterization of occult hepatitis B virus infection in Chongqing unpaid blood donors[J]. Infect Dis Info, 2017, 30(1): 44-47. [张涛, 廖红梅,张春红, 等. 重庆地区无偿献血人群隐匿性乙型肝炎病毒感染的特征[J]. 传染病信息, 2017, 30(1): 44-47.]
[25]Shan M, Shen Z, Sun H, et al. The enrichment of HBV immuneescape mutations during nucleoside/nucleotide analogue therapy[J]. Antivir Ther, 2017, 22(8): 717-720.
[26]Lacombe K, Boyd A, Lavocat F, et al. High incidence of treatment-induced and vaccine-escape hepatitis B virus mutants among human immunodeficiency virus/hepatitis B-infected patients[J]. Hepatology, 2013, 58(3): 912-922.
[27]Fu X, Chen J, Chen H, et al. Mutation in the S gene of hepatitis B virus and anti-HBs subtype-nonspecificity contributed to the co-existence of HBsAg and anti-HBs in patients with chronic hepatitis B virus infection[J]. J Med Virol, 2017, 89(8): 1419-1426.

