自拟补脾泻火方联合西药治疗溃疡性结肠炎近期疗效观察
刘学成 孙 慧 张宏国 睢 勇
(山东省聊城市中医医院,山东 聊城 252300)
溃疡性结肠炎病变患者主要局限于结肠黏膜及黏膜下层组织,多因腹泻腹痛、里急后重及黏液血便等就诊;如未及时有效控制病情可导致症状迁延加重,进而严重影响日常生活质量[1]。现代医学对于溃疡性结肠炎并无特效治疗手段,多依靠激素、氨基水杨酸类及免疫调节制剂缓解症状,但难以有效控制病情进展,长期用药还可导致严重毒副作用,且停药复发风险居高不下,无法满足临床治疗需要[2-3]。近年来中医药开始被广泛用于溃疡性结肠炎治疗,且较西医单用可更有效提高病情控制效果和改善生存质量[4]。本研究以我院收治溃疡性结肠炎患者共120例作为研究对象给予奥沙拉嗪钠单用和在此基础上加用自拟补脾泻火方辅助治疗,观察中西医结合治疗溃疡性结肠炎临床疗效。现报告如下。
1 资料与方法
1.1 病例选择 1)纳入标准:(1)符合《炎症性肠病诊断与治疗的共识意见(2012年广州)》西医诊断标准[5];(2)符合《溃疡性结肠炎中西医结合诊治方案(草案)》大肠湿热证中医诊断标准[6];(3)年龄 18~75 岁;(4)方案经医院伦理委员会批准,且患者及家属知情同意。2)排除标准:入组前8周服用研究相关药物;肠外并发症;其他原因导致结肠炎症;免疫系统疾病;心脑肝肾功能障碍;精神系统疾病;过敏体质。
1.2 临床资料 选择本院2015年5月至2017年5月收治溃疡性结肠炎患者共120例,以随机抽签法分为对照组与中西医组各60例;对照组男性26例,女性34 例;年龄 32~74 岁,平均(42.79±6.50)岁;病程 1~7年,平均(3.44±0.92)年;平均急性病程(1.97±0.51) d。中西医组男性24例,女性36例;年龄34~71岁,平均(42.60±6.43)岁;病程 1~6 年,平均病程为(3.27±0.89)年;平均急性病程(1.89±0.48)d。两组患者临床资料比较差异无统计学意义(P>0.05)。
1.3 治疗方法 对照组患者采用奥沙拉嗪钠(德国Dr.Falk Pharma GmbH生产,注册证号H20100110,规格0.5 g)口服,每次1 g,每日3次;中西医组患者则在此基础上加用自拟补脾泻火方辅助治疗,组方:生黄芪30 g,柴胡 15 g,炙甘草 10 g,苍术 10 g,党参 10 g,羌活10 g,黄芩 9 g,黄连6 g,升麻 5 g,石膏5 g。 每日 1剂,加水400 mL煎至150 mL,早晚分服。两组患者治疗时间均为14 d。
1.4 观察指标 1)主要证候积分计算依据《中医病证诊断疗效标准》[7],包括黏液脓血便、腹泻腹痛、乏力口干、痞闷、舌尖红舌根白及脉细,分值0~6分,分值越高提示病情越严重;2)依据炎症性肠病Baron评分和黏膜组织学Geboes指数评分进行黏膜病损程度评价[5];3)生存质量评价依据炎症性肠病生存质量问卷进行[8];4)采用ELISA法对超敏C反应蛋白(hs-CRP)、白细胞介素-6(IL-6)及肿瘤坏死因子-α(TNF-α)水平进行检测,检测仪器为瑞士Roche公司生产Cobas C312型全自动生化分析仪;5)记录患者治疗过程中腹部痉挛、失眠、消化不良及头痛例数,计算百分比。
1.5 疗效标准 参考文献[7]拟定。显效:临床症状和肠道黏膜病变均明显减轻,主要证候积分减分率>70%。有效:临床症状和肠道黏膜病变均有所减轻,主要证候积分减分率为>40%且≤70%。无效:未达上述标准。
1.6 统计学处理 应用SPSS18.0统计软件。计量资料以(±s)表示,采用 t检验;计数资料采用 χ2检验或确切概率法,以百分比(%)表示。P<0.05为差异有统计学意义。
2 结 果
2.1 两组近期疗效比较 见表1。中西医组患者近期治疗总有效率显著高于对照组(P<0.05)。

表1 两组近期疗效比较(n)
2.2 两组治疗前后主要证候积分比较 见表2。中西医组患者治疗后黏液脓血便、腹泻腹痛、舌苔黄腻积分均显著低于对照组和本组治疗前(均P<0.05)。
表2 两组治疗前后主要证候积分比较(分,±s)
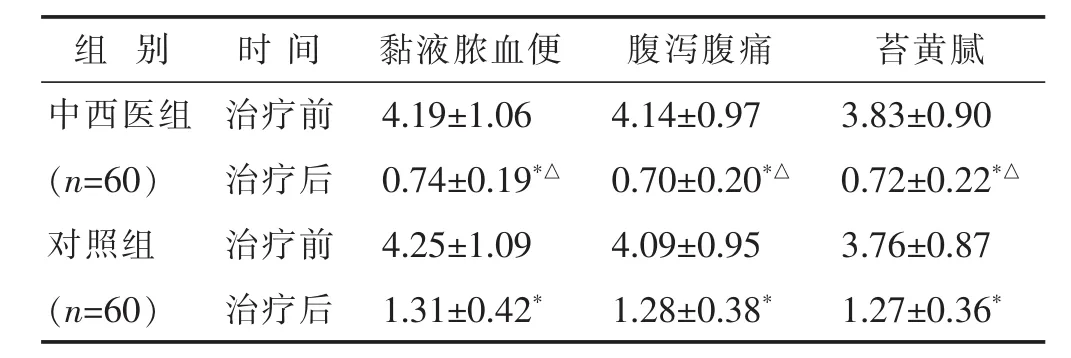
表2 两组治疗前后主要证候积分比较(分,±s)
与本组治疗前比较,*P<0.05;与对照组治疗后比较,△P<0.05。下同。
组 别 时 间 苔黄腻黏液脓血便 腹泻腹痛中西医组 治疗前 3.83±0.90(n=60) 治疗后 0.72±0.22*△对照组 治疗前 3.76±0.87 4.19±1.06 4.14±0.97 0.74±0.19*△ 0.70±0.20*△4.25±1.09 4.09±0.95(n=60) 治疗后 1.27±0.36*1.31±0.42* 1.28±0.38*
2.3 两组治疗前后炎症性肠病Baron评分和黏膜组织学Geboes指数评分比较 见表3。中西医组患者治疗后炎症性肠病Baron评分、黏膜组织学Geboes指数评分均显著低于对照组和本组治疗前(均P<0.05)。
表3 两组治疗前后炎症性肠病Baron评分、黏膜组织学Geboes指数评分、IBDQ 评分比较(分,±s)
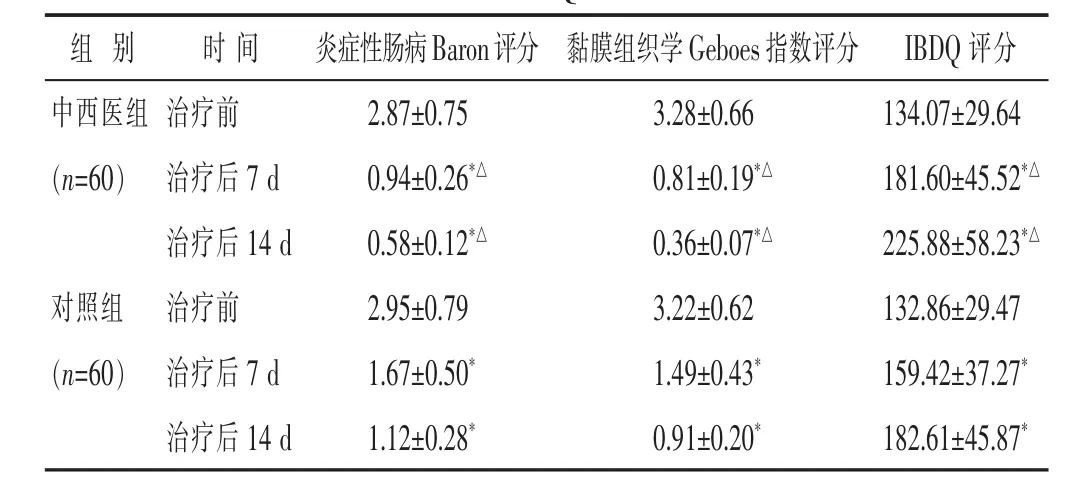
表3 两组治疗前后炎症性肠病Baron评分、黏膜组织学Geboes指数评分、IBDQ 评分比较(分,±s)
组 别 时 间 炎症性肠病Baron评分 黏膜组织学Geboes指数评分2.87±0.75 3.28±0.66 0.94±0.26*△ 0.81±0.19*△0.58±0.12*△ 0.36±0.07*△对照组 治疗前IBDQ评分中西医组 治疗前 134.07±29.64(n=60) 治疗后 7 d 181.60±45.52*△治疗后 14 d 225.88±58.23*△2.95±0.79 3.22±0.62(n=60) 治疗后 7 d 1.67±0.50* 1.49±0.43* 159.42±37.27*治疗后 14 d 1.12±0.28* 0.91±0.20* 182.61±45.87*132.86±29.47
2.4 两组治疗前后IBDQ评分比较 见表3。中西医组患者治疗后IBDQ评分显著高于对照组和本组治疗前(P<0.05)。
2.5 两组治疗前后实验室指标水平比较 见表4。中西医组患者治疗后hs-CRP、IL-6及TNF-α水平均显著低于对照组和本组治疗前(均P<0.05)。
表4 两组治疗前后实验室指标水平比较(±s)
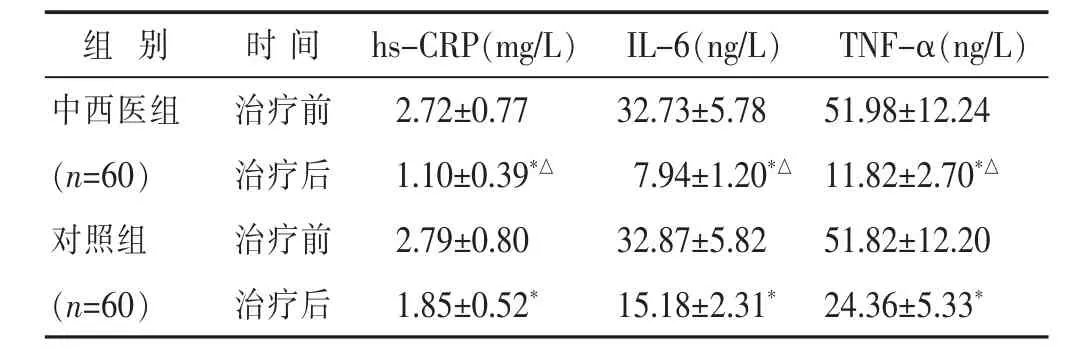
表4 两组治疗前后实验室指标水平比较(±s)
组 别 时 间 TNF-α(ng/L)hs-CRP(mg/L) IL-6(ng/L)中西医组 治疗前 51.98±12.24(n=60) 治疗后 11.82±2.70*△对照组 治疗前 51.82±12.20 2.72±0.77 32.73±5.78 1.10±0.39*△ 7.94±1.20*△2.79±0.80 32.87±5.82(n=60) 治疗后 24.36±5.33*1.85±0.52* 15.18±2.31*
2.6 两组不良反应发生率比较 中西医组发生腹部痉挛2例,失眠2例,消化不良1例,头痛1例,不良反应发生率为10.00%;对照组发生腹部痉挛2例,失眠1例,头痛1例,不良反应发生率为6.67%。两组患者不良反应发生率比较差异无统计学意义(P>0.05)。
3 讨 论
溃疡性结肠炎发病机制尚未彻底阐明,大部分学者认为遗传因素是该病发生机制,同时在外界环境污染、饮食、感染及精神压力等因素诱导下进展[8]。该病患者主要临床特征为黏液脓血便和里急后重,故临床易误诊为痢疾;如病情迁延可进展形成肠道多发息肉甚至癌变[9]。美沙拉嗪是目前溃疡性结肠炎治疗常用药物之一,属于氨基水杨酸类制剂,具有pH依赖性定位特点,口服后可定位于回肠末端和结肠位置,快速释放药物活性成分,继而提高病变区域抗炎效应;但大量随访报道显示,美沙拉嗪单独用于溃疡性结肠炎,治疗症状总控制率不足70%,而增加用量或长期给药均可能导致不良反应发生风险上升,不利于患者依从性和耐受性改善[10]。在此情况下,中西医相结合治疗方案逐渐成为临床关注的热点领域。
溃疡性结肠炎属中医学“痢疾”“肠澼”范畴,基本病机为湿邪内阻、阳气不足、络脉不通。三者相互影响,互为因果[11]。古代方家在治疗脾胃肠疾病过程中发现恢复脾升胃降功能至关重要,同时“风药”应用有助于益气除湿、通络和血、益阳止泻作用发挥。本文所用自拟补脾泻火方源自李东垣《脾胃论》,多用于劳倦、饮食伤脾所致脾虚湿热证治疗,符合溃疡性结肠炎的中医基本病机[12];故中医治疗溃疡性结肠炎当以益气健脾,燥湿泻火为主;本次研究所用自拟补脾泻火方中,党参大补元气,黄芪益气健脾,柴胡疏肝升阳,炙甘草补气温阳,苍术燥湿健脾,羌活行气祛瘀,黄连泻火利湿,黄芩清热燥湿,而石膏则泄热解毒,诸药合用可共奏补脾气、泻阴火之功效。现代药理学研究显示,党参皂苷成分能够显著促进损伤肠道黏膜修复,加快溃疡面愈合进程[13];苍术可有效提高模型动物肠黏膜相关蛋白表达,拮抗上皮细胞凋亡,有助于减轻肠道黏膜炎症水平[14];黄连则具有增强结肠黏膜连接蛋白活性,刺激受损黏膜修复及改善局部黏膜防御功能等多种作用[15]。
本次研究结果中,中西医组患者近期治疗总有效率,治疗后黏液脓血便、腹泻腹痛、乏力口干、痞闷、舌尖红舌根白及脉细积分,炎症性肠病Baron评分,黏膜组织学Geboes指数评分及IBDQ评分均显著优于对照组,证实中药方剂辅助用于溃疡性结肠炎临床治疗有助于缓解相关症状体征,促进肠黏膜病变消退及提高日常生活质量;中西医组患者治疗后hs-CRP、IL-6及TNF-α水平均显著低于对照组、治疗前,提示中西医结合疗法治疗溃疡性结肠炎能够有效下调机体炎性细胞因子水平,而这一优势可能是该方案应用后疗效更佳关键原因所在。相关基础及临床研究证实,炎性细胞因子水平异常是溃疡性结肠炎病情发生发展重要危险因素;其中hs-CRP可激活体内补体和吞噬细胞功能,水平与肠道黏膜损伤程度呈正相关[16];IL-6属于多效性炎性细胞因子,具有高效促炎和刺激急性反应蛋白形成双重作用,在溃疡性结肠炎早期及活动期可见血清浓度显著上升[17];而TNF-α则能够趋化肠道黏膜中性粒细胞聚集,调节花生四烯酸代谢,促进补体片段吞噬[18];而两组患者不良反应发生率相当,则表明溃疡性结肠炎加用中药口服安全性值得认可。
综上所述,自拟补脾泻火方联合西药治疗溃疡性结肠炎可有效减轻肠道症状,促进受损黏膜修复,改善生存质量,下调hs-CRP、IL-6及TNF-α水平,且未加重药物毒副作用。
[1]董卫国,徐曼,李军华.回顾性分析82例溃疡性结肠炎的临床特征[J].脾胃病学和肝病学杂志,2015,24(9):1079-1082.
[2]钱家鸣,杨红.中国炎症性肠病研究的历史回顾现状和展望[J].中国实用内科杂志,2015,35(9):727-730.
[3]杨宏辉,冯春古,祝志岳,等.莫西沙星联合氢化可的松与柳氮磺吡啶灌肠治疗溃疡性结肠炎近期疗效观察[J].江西医药,2014,49(4):331-333.
[4]谢晶日,孙涛,张冰.溃疡性结肠炎的中医药治疗进展及相关优势探讨[J].辽宁中医杂志,2016,43(2):425-427.
[5]中华医学会消化病学分会炎症性肠病学组.炎症性肠病诊断与治疗的共识意见(2012年·广州)[J].中华内科杂志,2012,51(10):818-831.
[6]陈治水,危北海,张万岱,等.溃疡性结肠炎中西医结合诊治方案(草案)[J].中国中西医结合消化杂志,2005,13(2):133-136.
[7]国家中医药管理局.中医病证诊断疗效标准[M].南京:南京大学出版社,1994:48-49.
[8]郑发鹃,张苏闽.《炎症性肠病生存质量问卷》评估活动期溃疡性结肠炎患者生存质量[J].中医学报,2015,30(8):1211-1214.
[9]樊慧丽,陈玉梅.溃疡性结肠炎的发病机制和治疗进展[J].中国全科医学,2012,15(2):228-230.
[10]韩柯,胡丽庆.益生菌联合康复新液治疗活动期轻中度溃疡性结肠炎的疗效及安全性分析[J].中国生化药物杂志,2014,34(4):98-105.
[11]沈洪,朱磊.重视溃疡性结肠炎的中西医结合治疗[J].中国中西医结合消化杂志,2016,24(8):571-574..
[12]陈文杰,杨勤.溃疡性结肠炎中西医治疗进展[J].辽宁中医药大学学报,2013,15(3):151-154.
[13]冯佩佩,李忠祥,原忠.党参属药用植物化学成分和药理研究进展[J].沈阳药科大学学报, 2012,30(4):11-13.
[14]赵爱梅.苍术的药理作用研究[J].光明中医,2009,24(1):181-182.
[15]余园媛,王伯初,彭亮,等.黄连的药理研究进展[J].重庆大学学报:自然科学版,2006,29(2):107-111.
[16]解春静,庄彦华,栾雨茏.溃疡性结肠炎发病机制中免疫因素的研究进展[J].细胞与分子免疫学杂志,2013,29(8):889-892.
[17]张倩倩,杜斌.炎症性肠病的免疫学机制及中药对其免疫学影响的综述[J].中医药导报,2015,21(24):91-94.
[18]陈文华,黄国栋,方承康,等.溃疡性结肠炎现代医学研究进展[J].中国医药科学,2011,1(7):51-53.

