黄芩苷对急性胰腺炎大鼠胰腺细胞自噬及Akt/mTOR通路的影响
汤建军 林晶晶 韩小乐 李恒平△
(1.湖北医药学院附属襄阳市第一人民医院,湖北 襄阳 441000;2.湖北中医药大学附属襄阳市中医医院,湖北 襄阳 441000)
急性胰腺炎(AP)是胰酶在胰腺内被过早激活引起胰腺自身消化的急性炎症反应,轻者病情呈自限性且预后良好,约20%~30%患者可发展为重症AP(SAP)[1-3]。 SAP 病情危重,进展迅速,易造成患者多器官功能衰竭,经积极治疗病死率仍高达36%~50%。有研究显示[4]AP期间胰腺细胞会发生自噬现象,调控自噬可能控制AP严重程度。Akt/mTOR(protein kinase B/mammalian target of rapamycin)通路是机体重要的信号转导通路,研究发现[5]Akt/mTOR通路在炎症反应如脓毒血症过程中发挥关键调节作用,抑制Akt/mTOR通路可减轻炎症反应。黄芩苷是从黄芩根中提取的黄酮类复合物,具有抗炎、利尿、抗变态等作用[6]。研究表明[7]黄芩苷可保护SAP时胰腺及其他脏器,但其具体保护机制尚未阐明。故本研究通过建立SAP大鼠模型,探究黄芩苷对SAP大鼠胰腺细胞自噬及Akt/mTOR通路的影响,以期为黄芩苷临床应用提供指导。
1 材料与方法
1.1 实验动物 SPF级SD健康雄性大鼠80只,体质量250~300 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2017-0008,于 20~25 ℃室温、30%~70%相对湿度、自然光照下分笼饲养1周,自由饮水、进食。
1.2 试药与仪器 自噬双标腺病毒mRFP-GFP-LC3(汉恒生物科技上海有限公司),善宁注射液(醋酸奥曲肽注射液,北京百奥药业有限责任公司),黄芩苷标准品(北京索莱宝科技有限公司),α-淀粉酶测定试剂盒(上海晶抗生物工程有限公司),胰蛋白酶原激活肽(TAP)ELISA试剂盒(美国R△D公司),一抗羊抗鼠Akt、p-Akt单克隆抗体(美国 Santa Cruz公司),一抗兔抗鼠LC3-Ⅱ、mTOR、p-mTOR单克隆抗体(美国Abgent公司),二抗山羊抗兔IgG溶液(美国Sigma公司)。Biofuge 22R型高速低温离心机(德国11ERAEUS公司),Leica-CM1950型恒冷切片机、Leica EG1160组织包埋机(德国徕卡公司)。
1.3 分组与造模 将大鼠随机分为假手术组、模型组、善宁组和黄芩苷组各20只;每组又随机分为3、6、12 h 3个亚组。所有大鼠均给予尾静脉注射约2×109个自噬双标腺病毒(mRFP-GFP-LC3),于动物房(室温22~28℃,相对湿度40%~70%)中饲养1周。大鼠术前禁食12 h。先用3%戊巴比妥钠(0.2 mL/100 g)腹腔麻醉,仰卧固定于手术台,备皮消毒,于右后肢腹股沟内下方切开皮肤,游离右股静脉,创建静脉输液通道。于大鼠腹部正中切口,暴露十二指肠乳头处,用24号静脉留置针穿透十二指肠外侧壁,斜行进入肠管,并经十二指肠乳头开口进入胆胰管0.5~1.0 cm,退出针芯,同时用显微血管镊夹闭胆管出肝门处,以防药物返流肝脏。将微量输液泵与留置针末端相连,以0.2 mL/min逆行注入3.5%牛磺胆酸钠(0.1 mL/100 g)。最后将显微血管镊与留置针移去,常规缝合伤口。假手术组大鼠仅开腹翻动十二指肠与胰腺。造模后12 h,模型组、黄芩苷组大鼠各死亡1只,假手术组、善宁组大鼠均无死亡。
1.4 给药方法 造模成功后10 min,善宁组大鼠向右股静脉一次性推入善宁注射液2.5 μg/100 g,接着用微量输液泵以速度 2.5 μg/(100 g·h) 连续静脉输入善宁注射液。黄芩苷组大鼠向右股静脉一次性推入5%黄芩苷0.2 mL/100 g,接着用微量输液泵以速度0.2 mL/(100 g·h)连续静脉输入5%黄芩苷。其余两组大鼠给予等量生理盐水。
1.5 标本采集与检测 1)血清淀粉酶和TAP含量测定。大鼠静脉给药3、6、12 h后开胸,在心脏中快速抽血2 mL,静止1 h后,于4℃、3000 r/min条件下离心10 min,取上清液,保存于-80℃冰箱。用α-淀粉酶测定试剂盒测定血清淀粉酶含量,用TAP ELISA试剂盒测定血清TAP含量。操作步骤参照试剂盒说明书。2)胰腺组织病理变化HE检测。造模后于相应时间点处死各组大鼠,收集胰腺组织,固定于4%多聚甲醛溶液中24~48 h;脱水后石蜡包埋;用组织切片机以5 μm厚度切片,60℃恒温箱中烤片3~5 h;切片用二甲苯脱蜡、梯度乙醇水化;苏木精液染色5 min;水冲洗后75%盐酸乙醇分化30 s;水冲洗、乙醇处理后酸化伊红溶液染色2 min;乙醇脱水、二甲苯透明;用中性树胶封片、烘烤过夜。用倒置相差显微镜观察并拍照。由2位资深病理医师用双盲法阅片,根据Schmidt评分标准[7],对胰腺水肿、坏死、出血、炎症程度进行综合评分。3)胰腺腺泡细胞自噬免疫荧光观察。将大鼠胰腺组织石蜡标本用30%蔗糖脱水48 h,浸没于适量OCT包埋剂中,液氮迅冻成块,注意切勿浸入液氮内。组织冰块取出后用恒冷切片机以4~8 mm厚度冰冻切片。用0.5 mol/L Na2CO3-50%甘油封片,置于荧光显微镜下观察并拍照。4)Western blot检测 LC3-Ⅱ、Akt、p-Akt、mTOR、p-mTOR蛋白表达。将大鼠胰腺组织剪成碎片,加入适量蛋白缓冲液,按常规方法提取蛋白,BCA法进行蛋白定量,调好蛋白浓度。每组取50 μg蛋白样品,与上样缓冲液等体积混合;80V恒压10%SDS-PAGE电泳30 min,100 V恒压电泳至溴酚蓝刚出玻璃板底部时停止;转至NC膜,于含5%脱脂奶粉TBST溶液中避光封闭1 h;将膜TBST漂洗后置于一抗稀释液(Akt、p-Akt为 1∶200,LC3-Ⅱ、mTOR、p-mTOR 为 1∶300)中,4℃孵育过夜;次晨将膜TBST漂洗后置于二抗稀释液(1∶3000)中,在摇床上室温孵育 1 h;TBST 漂洗后滴加ECL发光液,曝光3次,选取重叠值。蛋白条带灰度值用Image J软件进行分析。用β-actin作为内参蛋白。
1.6 统计学处理 应用SPSS20.0统计软件。计量资料以(±s)表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验;计数资料用“率”描述,用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠各时间点血清淀粉酶和TAP水平比较见表1。造模后3、6、12 h时间点,模型组、善宁组、黄芩苷组大鼠血清淀粉酶和TAP水平均显著高于假手术组(P<0.05),善宁组、黄芩苷组大鼠血清淀粉酶和TAP水平均显著低于模型组(P<0.05),黄芩苷组大鼠血清淀粉酶和TAP水平均显著低于善宁组(P<0.05)。
表1 各组大鼠各时间点血清淀粉酶和TAP水平比较(±s)
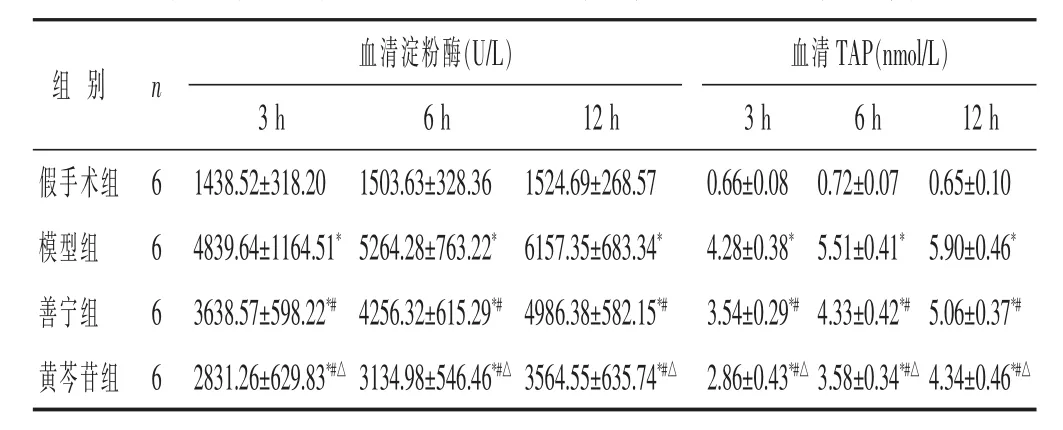
表1 各组大鼠各时间点血清淀粉酶和TAP水平比较(±s)
与假手术组比较,*P<0.05;与模型组比较,#P<0.05;与善宁组比较,△P<0.05。 下同。
血清淀粉酶(U/L) 血清 TAP(nmol/L)组 别 n 3 h 6 h 12 h 3 h 6 h 12 h假手术组 6 1438.52±318.20 1503.63±328.36 1524.69±268.57 0.66±0.08 0.72±0.07 0.65±0.10模型组 6 4839.64±1164.51*5264.28±763.22* 6157.35±683.34* 4.28±0.38*5.51±0.41*5.90±0.46*善宁组 6 3638.57±598.22*#4256.32±615.29*#4986.38±582.15*# 3.54±0.29*#4.33±0.42*#5.06±0.37*#黄芩苷组 6 2831.26±629.83*#△ 3134.98±546.46*#△ 3564.55±635.74*#△ 2.86±0.43*#△ 3.58±0.34*#△ 4.34±0.46*#△
2.2 各组胰腺组织病理学检测 见图1,表2。HE染色结果发现,假手术组大鼠胰腺腺泡细胞结构完整;模型组可观察到腺泡水肿,腺泡结构遭受破坏,小叶间隔变宽,胰腺组织不同程度坏死、出血,病情随时间的延长而加重;黄芩苷干预后大鼠胰腺组织损伤程度显著降低。参照Schmidt评分标准,与假手术组相比,模型组、善宁组和黄芩苷组大鼠在各时间点胰腺组织损伤病理学评分均显著升高(P<0.05)。与模型组相比,善宁、黄芩苷干预后大鼠在各时间点胰腺组织损伤病理学评分显著降低(P<0.05)。与善宁组相比,黄芩苷干预后大鼠在各时间点胰腺组织损伤病理学评分显著较低(P<0.05)。
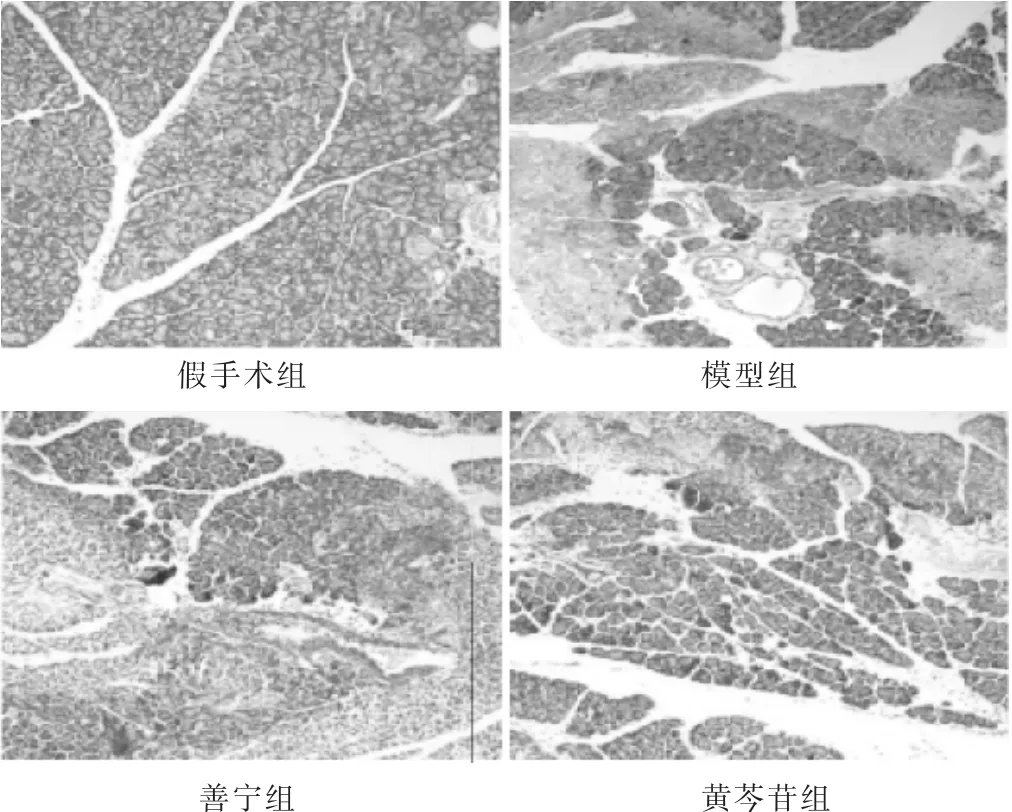
图1 造模后12 h各组胰腺组织(HE染色,100倍)
表2 各组不同时间点胰腺组织损伤病理学评分比较(分,±s)
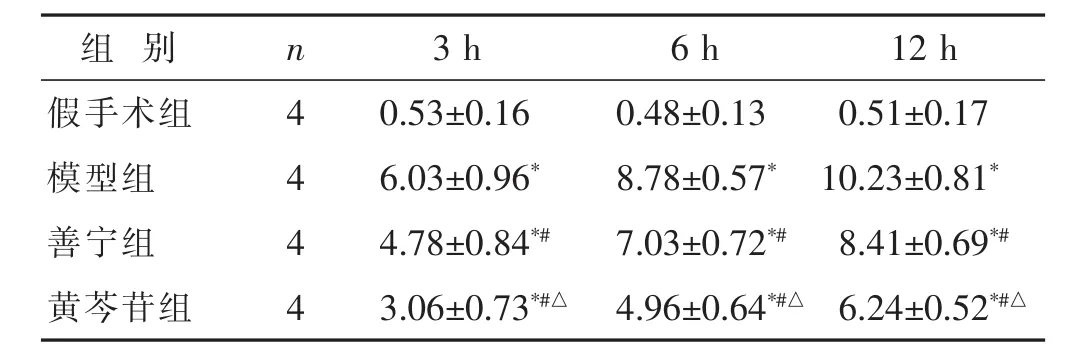
表2 各组不同时间点胰腺组织损伤病理学评分比较(分,±s)
组 别 n 12 h 3 h 6 h假手术组 4 0.51±0.17模型组 4 10.23±0.81*善宁组 4 8.41±0.69*#0.53±0.16 0.48±0.13 6.03±0.96* 8.78±0.57*4.78±0.84*# 7.03±0.72*#黄芩苷组 4 6.24±0.52*#△3.06±0.73*#△ 4.96±0.64*#△
2.3 各组大鼠胰腺腺泡细胞自噬免疫荧光观察 图2荧光显微镜结果显示,与假手术组相比,模型组大鼠造模后3、6、12 h自噬流明显增加,且随着时间的延长自噬流越来越强。图3显示造模后12 h,模型组、善宁组和黄芩苷组大鼠胰腺自噬流绿色荧光显著强于假手术组;善宁、黄芩苷干预后大鼠胰腺自噬流绿色荧光显著低于模型组;黄芩苷干预后大鼠胰腺自噬流绿色荧光显著低于善宁组。
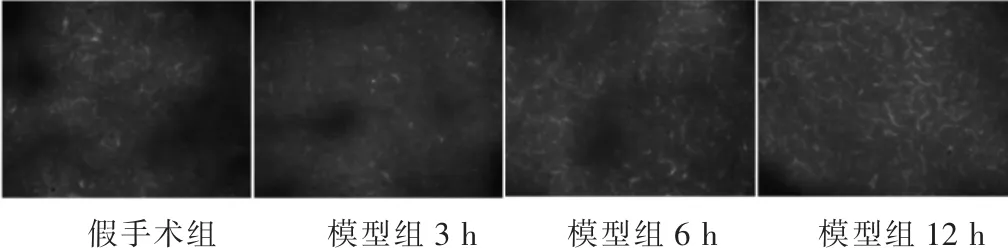
图2 模型组造模后胰腺组织自噬流变化(100倍)
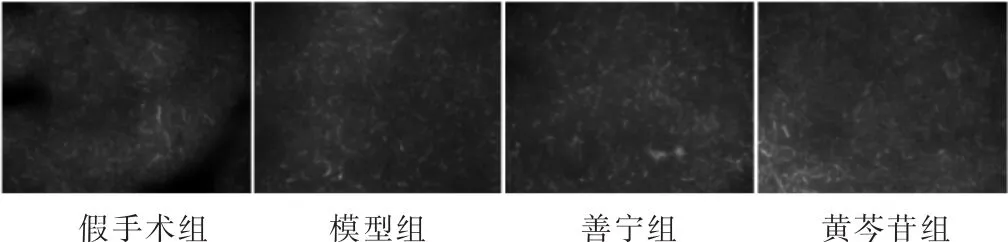
图3 造模后12 h各组大鼠胰腺组织自噬流变化(100倍)
2.4 各组大鼠胰腺组织自噬相关蛋白LC3-Ⅱ表达比较 见图4,表3。Western blot结果显示,造模后12 h,与假手术组相比,模型组大鼠胰腺组织LC3-Ⅱ蛋白表达水平显著升高(P<0.05);善宁、黄芩苷干预后大鼠LC3-Ⅱ蛋白表达水平显著低于模型组和假手术组(P<0.05);黄芩苷干预后大鼠LC3-Ⅱ蛋白表达水平显著低于善宁组(P<0.05)。
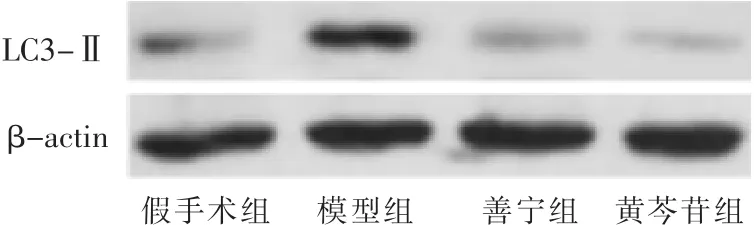
图4 Westernblot检测造模后12h大鼠胰腺组织LC3-Ⅱ蛋白表达
表3 造模后12 h各组大鼠胰腺组织LC3-Ⅱ蛋白相对表达灰度值(±s)
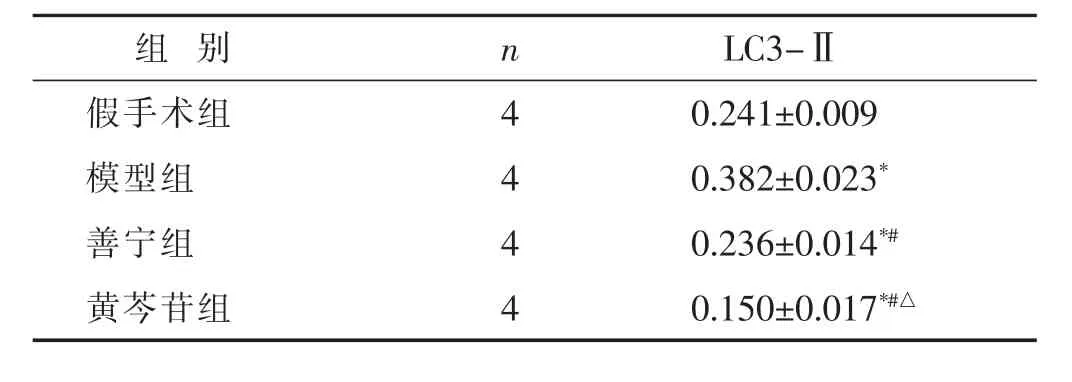
表3 造模后12 h各组大鼠胰腺组织LC3-Ⅱ蛋白相对表达灰度值(±s)
组 别 n LC3-Ⅱ假手术组 4模型组 4善宁组 4 0.241±0.009 0.382±0.023*0.236±0.014*#黄芩苷组 40.150±0.017*#△
2.5 各组大鼠胰腺组织 Akt、p-Akt、mTOR、p-mTOR蛋白表达比较 见图5、表4。造模后12 h各组Akt、mTOR蛋白表达水平的差异无统计学意义(P>0.05),与假手术组相比,模型组大鼠胰腺组织p-Akt、pmTOR蛋白表达水平显著升高(P<0.05);善宁组、黄芩苷组大鼠p-Akt、p-mTOR蛋白表达水平显著低于模型组(P<0.05);黄芩苷组大鼠 p-Akt、p-mTOR 蛋白表达水平显著低于善宁组(P<0.05)。
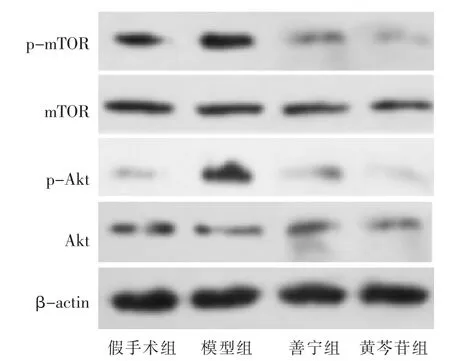
图 5 Western blot检测大鼠胰腺组织 Akt、p-Akt、mTOR、p-mTOR蛋白表达
3 讨 论
牛黄胆酸钠是胆汁的主要组分,向胰胆管注入该药物后,可造成胰管胆汁返流,胰管上皮细胞遭受破坏,胰酶被诱导激活,导致SAP的发生[8-9]。本研究通过胰胆管逆行注射3.5%牛黄胆酸钠的方法制备SAP模型,发现大鼠血清淀粉酶和TAP水平均显著升高,且观察到胰腺腺泡水肿、坏死、出血,说明SAP大鼠模型制备成功。
表4 各组大鼠胰腺组织Akt、p-Akt、mTOR、p-mTOR蛋白相对表达灰度值(±s)
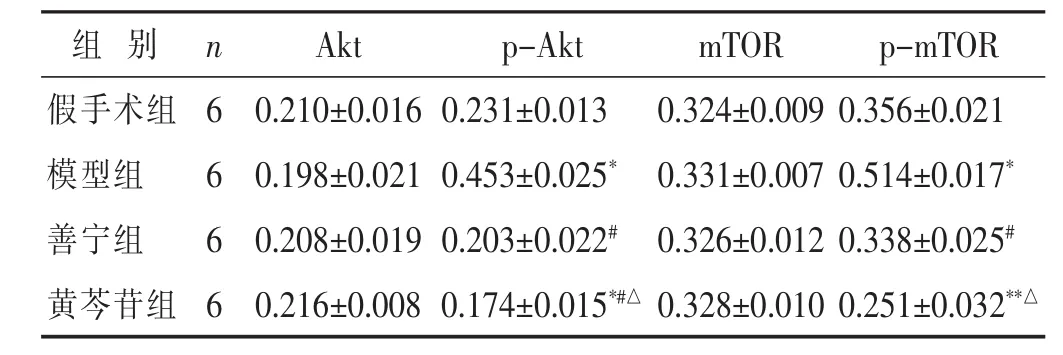
表4 各组大鼠胰腺组织Akt、p-Akt、mTOR、p-mTOR蛋白相对表达灰度值(±s)
组别 n Akt p-Akt mTOR p-mTOR假手术组 6模型组 6善宁组 6 0.210±0.016 0.231±0.013 0.198±0.021 0.453±0.025*0.208±0.019 0.203±0.022#0.324±0.009 0.356±0.021 0.331±0.007 0.514±0.017*0.326±0.012 0.338±0.025#黄芩苷组 60.216±0.008 0.174±0.015*#△0.328±0.010 0.251±0.032**△
自噬是真核细胞特有的一种保护机制,可消化构型异常的蛋白质、多余或受损的细胞器,在细胞饥饿、损伤或其他不良环境下,生物体消化自身成分为细胞提供养分与能量[10-12]。自噬相关蛋白LC3在进化中高度保守,为自噬体产生的标志。LC3包括Ⅰ型与Ⅱ型,LC3-Ⅱ定位在自噬体膜的表面,参与自噬体的形成,常被用于衡量细胞自噬的程度[13-14]。本研究在造模前各组大鼠均给予尾静脉注射自噬双标腺病毒,结果发现造模后12 h模型组大鼠胰腺自噬流绿色荧光较假手术组显著增强,胰腺组织LC3-Ⅱ表达水平较假手术组显著升高。这反映出SAP时胰腺腺泡细胞的自噬情况加重,表明自噬在AP发病过程中发挥一定作用。
全身炎症反应失控是引起SAP患者出现并发症和死亡的重要原因[15]。中医治疗SAP主要汤药有清胰汤、柴芩承气汤,黄芩是其主要有效成分之一[16]。黄芩具有抗自由基、抗氧化以及抑制过氧化脂质产生的功能。黄芪苷是黄芪根中的重要活性成分,黄芪苷可用于治疗 SAP,以减轻胰腺炎症反应[17]。 研究发现[18-19]Akt/mTOR信号通路参与机体的炎症反应过程,Akt作为一种丝苏氨酸蛋白激酶,可协同磷脂酰肌醇依赖性蛋白激酶1/2促进三磷酸磷脂酰肌醇与其自身结合,Akt由胞浆转移至质膜并发生磷酸化,被激活的Akt可活化下游蛋白mTOR。Akt/mTOR信号通路在细胞生长、增殖、分化、凋亡、自噬等生理过程中发挥重要作用[20]。本研究结果发现,黄芩苷组大鼠血清淀粉酶和TAP水平较模型组、善宁组均显著降低,胰腺组织损伤程度明显减轻,说明黄芩苷比善宁更能减轻SAP大鼠的病情;黄芩苷治疗后大鼠胰腺自噬流绿色荧光较弱、胰腺组织LC3-Ⅱ表达水平显著降低,表明黄芩苷治疗比善宁更能缓解SAP大鼠胰腺细胞自噬程度;黄芩苷组大鼠胰腺组织p-Akt、p-mTOR表达水平较善宁组显著降低,表明黄芩苷比善宁更能抑制Akt/mTOR信号通路。这些结果暗示黄芩苷可能通过抑制Akt/mTOR信号通路来减轻胰腺细胞自噬程度,且疗效比善宁更好。
本研究结果发现SAP大鼠胰腺损伤组织中LC3-Ⅱ、p-Akt与p-mTOR表达水平显著增加,黄芩苷治疗后SAP大鼠胰腺水肿、坏死、出血程度明显减轻,且大鼠胰腺损伤组织中LC3-Ⅱ、p-Akt与p-mTOR表达水平显著降低,表明黄芩苷可能通过抑制Akt/mTOR信号通路来减轻胰腺细胞自噬程度,从而缓解SAP大鼠病情。
[1]中华医学会外科学分会胰腺外科学组.急性胰腺炎诊治指南(2014)[J].中华消化外科杂志,2015,53(1):50-53.
[2]Afghani E,Pandol SJ,Shimosegawa T,et al.Acute pancreatitis-progress and challenges:a report on an international symposium[J].Pancreas,2015,44(8):1195-1210.
[3]苏晓琳,陈苏宁.大承气汤合大柴胡汤加减辅助治疗急性中重症胰腺炎的临床观察[J].实用药物与临床,2017,20(5):560-562.
[4]Ji L,Li L,Qu F,et al.Hydrogen sulphide exacerbates acute pancreatitis by over-activating autophagy viaAMPK/mTOR pathway[J].Journal of Cellular Molecular Medicine,2016, 20(12):2349-2361.
[5]Kim H,Banerjee N,Barnes RC,et al.Mango polyphenolics reduce inflammation in intestinal colitis-involvement of the miR-126/PI3K/AKT/mTOR axis in vitro and in vivo [J].Molecular Carcinogenesis,2017,56(1):197-207.
[6]金琦,蔡天蕊,黄朔,等.黄芩对急性重症胰腺炎大鼠肝损伤的预防及治疗作用研究[J].中国现代医学杂志,2016,26(1):18-23.
[7]李丹,郑高明.黄芩苷对大鼠重症急性胰腺炎肾损伤保护作用的研究[J].中华中医药学刊,2015,33(10):2476-2478.
[8]吕宾.中医药在重度急性胰腺炎治疗中的应用[J].中国医师杂志,2015,33(2):743-745.
[9]郑晓博,陈光宇,黎鹏武,等.微量输液泵应用于逆行胰胆管注射牛黄胆酸钠大鼠重症急性胰腺炎造模的效果研究[J].西南军医,2013,15(3):241-243.
[10]Pankiv S,Clausen TH,Lamark T,et al.p62/SQSTM1 binds directly to Atg8/LC3 to facilitate degradation of ubiquitinated protein aggregates by autophagy[J].Journal of Biological Chemistry,2015,282(33):24131-24145.
[11]徐建,宿冬远,刘绍田,等.施他宁联合乌司他丁治疗重症急性胰腺炎的疗效及其对免疫功能、sTREM-1和sB7-H2水平的影响[J].实用药物与临床,2016,19(4):442-446.
[12]Mari?o G,Niso-Santano M,Baehrecke EH,et al.Self-consumption: the interplay of autophagy and apoptosis[J].Nature Reviews Molecular Cell Biology,2014,15(2):81-94.
[13]Noda NN,Inagaki F.Mechanisms of autophagy[J].Annual Review of Biophysics,2015,44(1):101-122.
[14]Jiang P,Mizushima N.LC3-and p62-based biochemical methods for the analysis of autophagy progression in mammalian cells[J].Methods,2015,15(75):13-18.
[15]秦敏.经鼻空肠管早期肠内营养在急性重症胰腺炎中的研究进展[J].中外医疗,2015,34(14):197-198.
[16]岳小红,廖莉.中西医结合治疗急性胰腺炎28例观察[J].实用中医药杂志,2015,31(4):299-300.
[17]朱渊红,王真,蔡宛如.黄芪注射液对大鼠重症急性胰腺炎肺损伤的影响[J].中华中医药学刊,2012,30(4):758-759.
[18]Neri LM,Cani A,Martelli AM,et al.Targeting the PI3K/Akt/mTOR signaling pathway in B-precursor acute lymphoblastic leukemia and its therapeutic potential[J].Leukemia,2014,28(4):739-748.
[19]Wang F,Li H,Yan XG,et al.Alisertib induces cell cycle arrest and autophagy and suppresses epithelial-to-mesenchymal transition involving PI3K/Akt/mTOR and sirtuin 1-mediated signaling pathways in human pancreatic cancer cells[J].Drug Design Development Therapy,2015,17(9):575-601.
[20]欧阳军,周跃鲜,李玺,等.PI3K/Akt/mTI3K/Akt/mOR信号通路在重症急性胰腺炎致肝脏损伤中的作用[J].中国普外基础与临床杂志,2015,22(5):555-559.

