管灸对面神经损伤家兔面神经核内BDNF及其受体TrkB表达的影响*
肖 雪 宋 军 田丰玮 黄靖云 赵金发 杨金蓉△
(1.成都中医药大学,四川 成都 610072;2.四川省中医药科学院,四川 成都 610041;3.重庆市中医研究院,重庆 400021)
面神经炎又称为面瘫。导致面神经炎发生的原因有多种,其中以病毒感染为多见,但由于面神经解剖位置表浅,外伤性或医源性损伤(如桥小脑角肿瘤、腮腺肿瘤手术等)也可导致面瘫[1]。目前,对于面瘫的治疗方法有很多[2],比如神经封闭、抗病毒、激素治疗等,而管灸作为灸法之一,治疗面神经炎的历史悠久,同时疗效确切、操作方便、患者痛苦少、不良反应小,具有独特的优势。因此,本研究制备家兔面神经损伤模型,用免疫组织化学法观察管灸对模型家兔面神经核内脑源性神经营养因子(BDNF)及其受体蛋白激酶B受体(TrkB)蛋白表达的影响,以期从神经生长促进因素的角度揭示管灸的分子生物学机制。
1 材料与方法
1.1 实验动物 32只健康日本大耳白兔,雌雄各半,年龄6~8个月,体质量2~2.5 kg,由四川省实验动物专委会养殖场提供,合格证号:SCXY(川)2013-14。动物单笼饲养于四川省中医药科学院实验动物房内,室温约25℃,保持室内通风换气,明暗交替。对实验用家兔观察1周,全身无明显畸形,无面瘫则纳入实验。所有实验动物的饲养、管理及实验过程均符合卫生部发布的《医学实验动物管理实施细则》。
1.2 试药与仪器 试药:BDNF抗体试剂盒、TrkB抗体试剂盒(BA0623)、免疫组化检测试剂盒(SA2002)、SABC 试剂盒(SA2002)、DAB 显色试剂盒(AR1022)皆由武汉博士德公司生产;多聚甲醛由成都市科龙化工试剂厂生产。仪器:管灸器(自制);石蜡切片机(德国徕卡仪器有限公司 );孵育箱(北京中兴伟业仪器有限公司);Olympus显微镜(日本);Image-Pro Plus AMS 图像分析系统。
1.3 分组与造模 将32只家兔随机分为假手术组、模型组、管灸组、热疗组,每组8只。采用神经夹持损伤法制造面神经损伤模型[3],方法如下:所有动物在术前禁食 12 h、禁水 4 h,用 0.7%戊巴比妥钠[4]以 6 mL/kg的剂量沿家兔耳缘静脉注射麻醉,固定后双侧面部手术区剃毛、碘伏消毒局部皮肤、铺无菌孔巾,用手术剪于耳前至下颌角逐层切开皮肤、皮下组织及肌肉层,切口约3 cm,钝性分离腮腺筋膜,充分暴露面神经,用弯钩镊确认面神经颊支后钝性分离2.5 cm左右。用同一特定钳于瞳孔下正对神经干处以压榨30 s、松开30 s、再压榨30 s的节律满扣夹持面神经,假手术组钝性分离面神经后,不予压榨即行缝合术。其余各组同上法压榨面神经并用缝线标记损伤段,缝合皮下及皮肤层。术后常规抗感染治疗,每天肌注青霉素40万U,连续注射5 d。
1.4 干预方法 各组均在造模后第6日开始治疗,每日1次,治疗6次后休息1 d,再治疗6次。管灸组取2 g艾绒置入特制的管灸器中,点燃后将软管插入家兔双侧外耳道约2 cm,施以熏灸,每次约18 min;热疗组易艾绒为燃烧的木炭同法施灸。空白组和模型组不治疗,常规喂养。
1.5 标本采集与检测 家兔以4%多聚甲醛全身灌注固定并处死,取动物面神经核,再经4%多聚甲醛溶液固定,石蜡包埋、切片,切片常规脱蜡至水,热修复抗原,滴加 5%BSA 封闭液,加 BDNF(稀释度为 1∶50)、TrkB(稀释度为 1∶100)兔抗血清 4℃过夜,SABC 法染色,DAB显色,苏木素复染,脱水、透明、封片、镜检,观察蛋白表达,并用Image-Pro Plus AMS图像分析软件,测量积分光密度。
1.6 统计学处理 应用PEMS3.1统计软件。计量资料以(±s)表示,采用单因素方差分析进行比较。P<0.05为差异有统计学意义。
2 结 果
2.1 各组面神经损伤家兔面神经核内BDNF蛋白表达比较 见表1。假手术组BDNF积分光密度明显高于模型组,有显著差异(P<0.05);与模型组相比,管灸组BDNF积分光密度明显高于模型组,有显著差异(P<0.05);热疗组与模型组相比,其差异无统计学意义。结果提示,面神经损伤使家兔面神经核中BDNF蛋白表达降低,管灸可增强面神经核中BDNF的蛋白表达,而热疗组对增强面神经核中BDNF的蛋白表达没有明显作用。
表1 各组面神经损伤家兔面神经核BDNF、TrkB蛋白表达比较(IOD,±s)
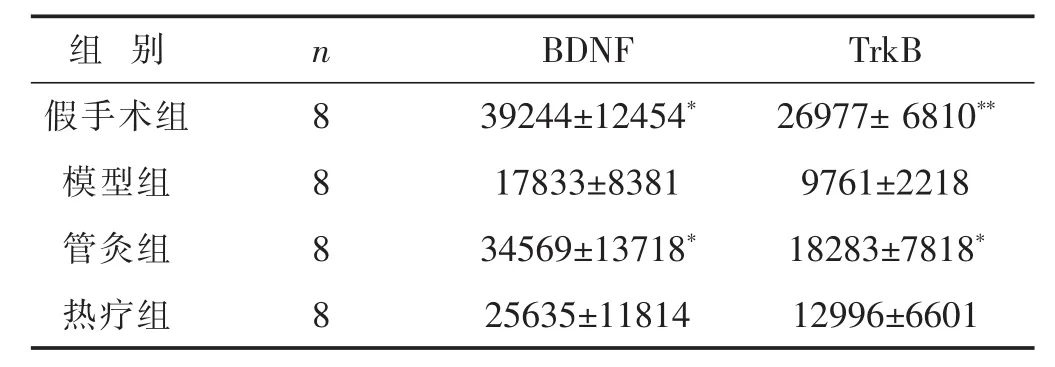
表1 各组面神经损伤家兔面神经核BDNF、TrkB蛋白表达比较(IOD,±s)
与模型组比较,*P<0.05,**P<0.01。
组别 n BDNF TrkB假手术组 8 39244±12454* 26977± 6810**模型组 8 17833±8381 9761±2218管灸组 8 34569±13718* 18283±7818*热疗组 8 25635±11814 12996±6601
2.2 管灸对面神经损伤模型家兔TrkB蛋白表达的影响 见表1。假手术组TrkB积分光密度明显高于模型组(P<0.01);管灸组与模型组相比,管灸组TrkB积分光密度高于模型组,有明显差异(P<0.05);热疗组与模型组相比,其差异无统计学意义。结果提示:面神经损伤使家兔面神经核中TrkB表达降低,管灸能增强面神经核中TrkB的表达,炭灸热疗对增强面神经核中TrkB的表达无明显作用。
3 讨 论
面神经炎,中医称为“口僻”。以口眼歪斜,前额皱纹消失,鼻唇沟变浅,抬眉、闭眼、鼓腮等动作障碍为主要临床表现。中医认为,手、足阳经均上头面部,当外邪入中面部经脉时,可致经脉凝滞,气血不通,肌肉缓纵不收。《灵枢.刺节真邪》曰“脉中之血,凝而留止,弗之火调,弗能取之”。管灸,是用苇管作为灸器向耳内施灸的一种方法。因耳窍位居头面,与手、足三阳经的循行联系密切,故管灸治疗可使燃艾产生的温热效应直接作用于耳窍,温通经脉、活血散凝,从而达到治疗面神经炎的目的[5]。
早在60年前,神经营养因子已率先由Viktor Hamburge[6]在鸡的神经生物学实验中研究。神经营养因子可诱导神经前体细胞分化为神经元,调控神经元的存活及维持它们的神经元表型,对神经退行性疾病、中枢神经系统创伤、脑缺血损害等诸多方面都发挥着重要的生物学作用。神经营养因子家族成员包括BDNF、神经生长因子(NGF)、神经营养素-3(NT-3)、神经营养素-4/5(NT-4/5)等[7]。 其中,BDNF 在中枢神经系统的表达最高、分布最广,并对多种神经元都有广泛作用[8-11]。BDNF几乎能调控神经元发育和功能的所有方面[12],比如前体细胞增殖与分化、轴突和树突发育、膜运输、突触形成和功能、神经胶质细胞分化以及神经元的相互作用。蒋常文等[13]认为,星形胶质细胞可支持神经细胞存活并营养神经元以及修复神经损伤,BDNF可通过促进脑星形胶质细胞的增殖而维持神经元结构。有研究表明[14]在神经发育过程中,BDNF由靶组织产生并经神经细胞轴突逆向转运至胞体,可维持神经元存活、生长、分化,阻止自然诱发的、神经传导阻滞所致的神经元死亡。
神经营养因子的生物效应是通过其在神经元膜上的受体介导的。在神经营养因子家族中每个成员都有两种受体即低亲和力和高亲和力受体。高亲和力受体是由原癌基因编码的酪氨酸蛋白激酶,属于Trk受体家族,包括TrkA、TrkB、TrkC 3种亚型,TrkA优先和NGF结合,TrkB优先和BDNF、NT4/5结合,TrkC优先和NT-3结合[15]。其中蛋白激酶B受体(TrkB)是相对分子量为145000,存在于神经元表面的单跨膜糖蛋白,被公认为是BDNF的功能受体。与BDNF特异性结合后,激活自身受体酪氨酸激酶活性,使受体TrkB发生自身磷酸化,激发下游相关信号通路,包括磷脂酰肌醇 3激酶/丝氨酶/苏氨酶蛋白激酶(PI3K/AKT)、丝裂原活化蛋白酶(MAPK)等,最终介导神经营养因子的生物效应[16]。
基于BDNF-TrkB信号轴在面神经损伤后神经保护与神经修复过程中均发挥广泛而重要的作用,本研究观察了管灸对BDNF及其受体TrkB蛋白表达的影响,以了解管灸治疗面神经炎的分子生物学机制。结果发现,面神经损伤后面神经核内BDNF及其受体TrkB的表达均明显降低。然而,面神经损伤模型家兔通过管灸治疗后,面神经核内BDNF及其受体TrkB的表达明显增强,而热疗组无明显作用,说明管灸可能通过上调面神经损伤家兔面神经核内BDNF及其受体TrkB的表达,促进损伤神经元的再生和修复,从而发挥其对面神经炎的治疗作用。至于管灸促进神经元修复再生的BDNF-TrkB信号转导机制值得进一步研究。
[1]Tang J, Wang X.Autogenous standard versus inside-outvein graft to repair facial in rabbits[J].Chin J Traumatol,2008,11(2):104-109.
[2]刘有限,李黄彤.周围性面瘫治疗研究[J].亚太传统医药,2016,12(15):90-92.
[3]牙祖蒙,王建华,周渝,等.穴位针刺对面神经再生影响的动物模型制作[J].实验动物科学与管理,1999,16(1):15-17.
[4]刘为萍,白梅.戊巴比妥钠麻醉家兔的浓度探讨[J].华夏医学,2013,26(1):11-13.
[5]黄永腾,杨金蓉.管灸治疗面瘫临床研究与运用[J].亚太传统医药,2016,12(8):61.
[6]Hamburger V.The journey of a neuroembryologist[J].Ann Rev Neurosci,1989,12:1-12.
[7]Thoenen H.Neurotrophins and neuronal plasticity[J].Science,1995,270:593-598.
[8]Murer MG,Yan Q.Brain-derived neurotrophic factor in the control human brain, and in Alzheimer′s disease and parkinson′s disease[J].Prog Neurobiol,2001,63(1):71-124.
[9]Alderson RF,Alterman AL,Barde YA,et al.Brain-derived neurotrophic factor increases survival and differentiated functions of rat septal cholinergic neurons in culture[J].Neuron,1990(5):297-306.
[10]Hyman C,Hofer M,Barde YA,et al.BDNF is a neurotrophic factor for dopaminergic neurons of the substantia nigra [J].Nature,1991(350):230-232.
[11]Hyman C,Juhasz M,.Overlapping and distinct actions of the neurotrophinsBDNF,NT-3,and NT-4/5 on cultured dopaminergic andGABAergic neurons of the ventral mesencephalon[J].Neurosci,1994(14):335-347.
[12]Davies AM.The role of neurotrophins in the developing nervous system[J].Neurobiol,1994,25(11):1334-1348.
[13]蒋常文,陈森州,李鸿文,等.BDNF对星形胶质细胞的促增殖效应及其ERK信号转导[J].中国老年学杂志,2007(14):1358-1360.
[14]Conner B,Dragunow M.The role of neurotrophic growth factors in neurodegenerative disorders of the human[J].Brain Res Rev,1998(27):1-39.
[15]Barbacid M.Life and death in the nervous system:role of neurotrophic factors and theirreceptors[J].New York:Elsevier,1995:37-53.
[16]Zhou X,Xiao H,Wang H.Developmental change of TrkB signaling in response to exogenous brain-derived neurotrophic factor in primary cortical neurons[J].Journal of human brain.Neuron,2010,65(6):852-858.

