对甲砜基甲苯的合成研究进展
陆光杰,余志群
(浙江工业大学,浙江 杭州 310014)
0 前言
对甲砜基甲苯是生产对甲砜基苯丝氨酸乙酯的主要原料,而对甲砜基苯丝氨酸乙酯又是生产医用抗生素甲砜霉[1]、兽药抗菌药氟洛芬[2]的主要原料。氟洛芬和甲砜霉素是国家二类新药,也是国家重点鼓励发展的产品。同时对甲砜基甲苯又是农用除草剂磺草酮[3]以及有机合成的重要中间体,属于国际紧缺的医药中间体。因此合成对甲砜基甲苯的文献报道有许多,根据起始原料不同主要分为三类。
1 合成方法
1.1 以对甲基硫甲苯为原料直接氧化法
2010年,Jain[4]小组利用固定在二氧化硅上的schiff碱配合物为催化剂,叔丁基过氧化氢(TBHP)为氧化剂,于60℃乙腈体系中氧化对甲基硫甲苯。
反应2.5 h后,对甲砜基甲苯的收率达到98%。催化剂使用6次后活性没有明显的改变依旧可以使用。但由于双氧水有着清洁绿色、含氧量高、贮存和操作安全以及低成本的生产运输等优点,许多研究团队更多选择双氧水作为氧化剂。反应通式为:
根据溶剂的不同可分为四类。
1.1.1 以乙腈为溶剂双氧水为氧化剂氧化对甲基硫甲苯
2007年,Shaabani[5]小组利用硅胶硫酸(SSA)为催化剂,在3 eq的30%双氧水下,于室温乙腈体系下氧化原料对甲基硫甲苯制备对甲砜基甲苯。反应1 h后经过后处理得到目标产物,最终收率为92%。
2011年,Romanelli[6]小组采用凯金结构的多酸类为催化剂,用大大过量的35%双氧水作为氧化剂,于40℃乙腈体系下氧化对甲基硫甲苯。在3 h的反应时间后,对甲砜基甲苯的收率达到93%。
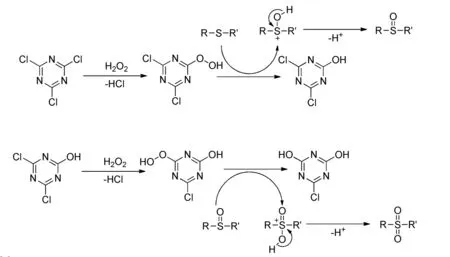
Bahrami[7]小组采用三聚氯氰(TCT)为催化剂在乙腈体系下用双氧水直接氧化对甲基硫甲苯制备对甲砜基甲苯。反应15 min后,对甲砜基甲苯的收率为96%。该反应的具体的反应机理如下:
2015年,Frenzel[8]小组利用炭负载的多孔改性金属氧酸盐作为催化剂,35%双氧水为氧化剂,在乙腈作为溶剂下氧化原料对甲基硫甲苯制备对甲砜基甲苯。在50℃下反应3 h,对甲砜基甲苯的收率近乎定量。催化剂经过后处理可以重复使用。随后,他们研究团队[9]又以钨磷酸的杂化材料为催化剂,反应10 h后,对甲基硫甲苯几乎定量合成对甲砜基甲苯。
2016年,叶津欣[10]小组以咪唑或者吡啶钼酸盐为催化剂,以3.0 eq的30%双氧水为氧化剂,于60℃,乙腈溶剂的体系下氧化对甲基硫甲苯。在1 h的反应时间后,近乎定量得到对甲砜基甲苯。催化剂在使用多次之后,活性没有明显的下降。
1.1.2 以离子液体为溶剂双氧水为氧化剂氧化对甲基硫甲苯
2013年,Zhang Bo[11]小组以对甲基硫甲苯为原料,采用35%双氧水为氧化剂,1-丁基-3-甲基咪唑四氟硼酸盐为催化剂,5 mol%咪唑类酸性离子液体为溶剂下一步合成对甲砜基甲苯。该反应体系是一个均相体系,在2.5 h的反应时间下,选择性达到96%,反应收率高达95%。所使用的催化剂催化性能稳定,溶解度好,不但容易制备而且能重复利用。
同样以离子液体为溶剂的还有胡玉林[12]小组,他们用五氧化二钒为催化剂在离子液体中进行一步氧化反应,经过4 h的室温反应,对甲砜基甲苯的收率达到93%。
1.1.3 以其他有机试剂为溶剂双氧水为氧化剂氧化对甲基硫甲苯
2008年,周贤太[13]小组以四苯基卟啉锰(Mn(TPP))为催化剂,2 eq的30%双氧水为氧化剂下,于室温乙醇体系中,氧化对甲基硫甲苯。反应1.5 h后,对甲砜基甲苯的收率达到89%。
2012年,薛晓玲[14]小组利用相转移催化剂作为催化剂,2.5 eq的30%双氧水为氧化剂,于60℃,1,4-二氧六环体系中氧化对甲基硫甲苯。反应30 min后,近乎定量得到对甲砜基甲苯。但催化剂在使用4次之后,活性下降明显,反应收率下降。
1.1.4 以水为溶剂双氧水为氧化剂氧化对甲基硫甲苯
2009年,Maity[15]小组利用凯金结构的多金属氧酸盐为催化剂,在4 eq的30%的双氧水为氧化剂下,于80℃水溶液中氧化对甲基硫甲苯。反应4 h后,对甲砜基甲苯的收率近乎定量。催化剂循环使用几次后活性没有明显的下降。
2010年,Shokrolahi[16]小组以磺化多孔炭(SPC)为催化剂,以4.0 eq的30%双氧水为氧化剂,于室温下氧化对甲基硫甲苯。反应45 min后,收率为87%。并且催化剂可通过过滤重复使用,催化剂的活性也没有明显的下降。
2012年,Sharma[17]小组采用负载有钼配合物的硅胶为催化剂,在3.6 eq的30%双氧水下,加入对甲基硫甲苯于室温下反应得到对甲砜基甲苯。反应30 min后,该反应的收率为95%。催化剂重复使用7次后活性依旧没有改变。
2014年,Kon[18]小组采用钛型分子筛为催化剂,用35%双氧水直接氧化对甲基硫甲苯制备对甲砜基甲苯。在3 h,50℃反应条件下,反应选择性高至87%,转化率近乎定量。催化剂经过5次循环使用后活性也没有明显地下降。
2017年,Abdi[19]小组采用酸性氧化石墨烯(AGO)为催化剂,用30%双氧水直接氧化对甲基硫甲苯制备对甲砜基甲苯。反应2 h后,反应收率达到98%,而且催化剂可以循环使用,使用4次后催化活性只有略微的下降。
除了双氧水外,还有用过硫酸氢钾为氧化剂制备对甲砜基甲苯。2012年,于冰[20]小组用1.5 eq的过硫酸氢钾为氧化剂,在60℃的水溶液中氧化对甲基硫甲苯。在12 h的反应时间后,对甲砜基甲苯的收率为95%。
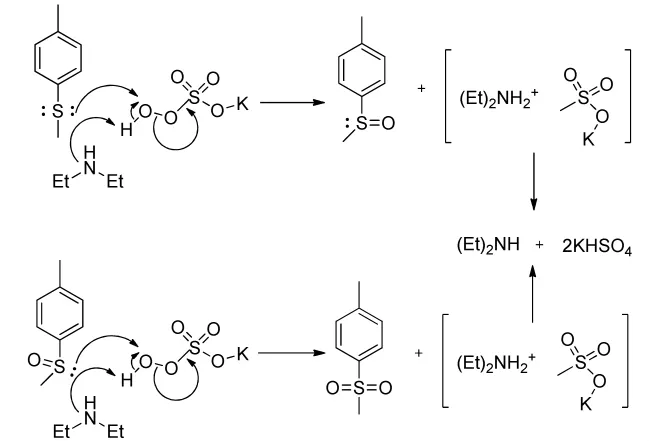
2017年Kupwade[21]小组用二乙胺为催化剂,过硫酸氢钾为氧化剂,在室温下于乙腈和水的体系中氧化对甲基硫甲苯,反应5 min后,收率为98%。该反应的反应机理如下:
以对甲基硫甲苯为原料,在催化剂作用下经氧化剂一步制备对甲砜基甲苯的方法在收率上是很高的,选用合适的催化剂是研究内容的关键。但由于原料和催化剂的成本使得工业化生产有一定的局限。
1.2 甲苯直接甲磺化法
该类反应直接以甲苯为原料,在催化剂作用下,直接经甲磺化试剂甲磺化后得到目标产物对甲砜基甲苯。反应通式为:

1973年,Olah[22]小组用三氯化铝为催化剂,甲磺酰氯为甲磺化试剂选择性磺化甲苯合成对甲砜基甲苯。反应2 h后,对甲砜基甲苯的收率只有17%。
1999年,Répichet[23]团队以三氟甲磺酸铋盐与氯化铋为催化剂,甲磺酰氯为磺化试剂选择性甲磺化甲苯生成对甲砜基甲苯。反应5 h后,对甲砜基甲苯的收率为20%。改用甲磺酸酐为磺化试剂后,在同样的条件下反应4 h,对甲砜基甲苯的收率只为33%。
2000年,Choudary[24]小组则用固体酸为催化剂,甲磺酸酐为甲磺化试剂甲磺化甲苯。反应6 h后,对甲砜基甲苯的收率最高为29%。
2001年,Frosta[25]团队改用三氟磺酸铟为催化剂,甲磺酰氯或者甲磺酸酐为甲磺化试剂合成对甲砜基甲苯。回流反应1 h后反应收率最高为35%。
2004年,Peyronneau[26]团队利用三氟甲磺酸与氯化铋的协同作用,采用甲磺酰氯为磺化试剂,来合成对甲砜基甲苯。在120℃下反应36 h后反应收率只有31%。
Smith[27]小组用沸石为催化剂,甲磺酸酐为甲磺化试剂选择性磺化甲苯。回流反应18 h,虽然对甲砜基甲苯的选择性极高,但是由于转化率极低,收率只为26%。
2010年,Boroujeni[28]小组用负载在聚苯乙烯上的三氟甲磺酸铝为催化剂,甲磺酸为甲磺化试剂,在40℃下反应2.7 h后,对甲砜基甲苯的收率达到81%。
以甲苯为原料,在催化剂作用下经甲磺化制备对甲砜基甲苯的方法,反应收率都很低,首先反应会有异构体产生,反应选择性差。再者反应活性比较低原料转化率不高,使得最终的收率都较小,加上混合物的分离较困难,使得该方法难以实现工业化生产,因此寻找合适的催化剂高选择性合成对甲砜基甲苯至关重要。
1.3 以对甲苯磺酰氯为原料合成法
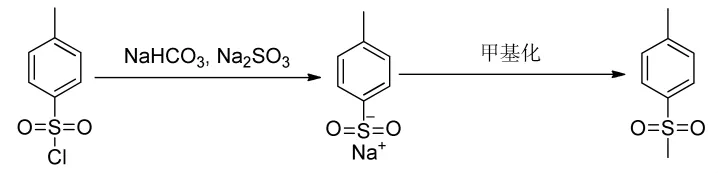
以对甲苯磺酰氯为原料,与亚硫酸钠和碳酸氢钠反应生成对甲苯亚磺酸钠溶液,接着用氯甲烷或者硫酸二甲酯将对甲基亚磺酸钠甲基化生成对甲砜基甲苯[29],收率为80%~90%。该方法虽然收率较高,但是需要多步操作,处理繁琐,原子经济性差,可能使用到的硫酸二甲酯是剧毒物品,反应过程需要大量的碱破坏,废水量大。
2 总结
研究热度较高的对甲基硫甲苯直接氧化法虽然收率高,但是毕竟原料较贵,不适合工业化生产。甲苯直接甲磺化法原料廉价易得,但是收率很低,寻找合适的催化剂是反应的关键,因此有一定的应用开发前景。目前,工业上生产对甲砜基甲苯的方法还是以对甲苯磺酰氯为原料,经成盐、甲基化后制备得到。但是该方法需要两步操作才能完成,工业生产操作路线较长,原子经济性差,三废较多。总的来说,对甲砜基甲苯的最佳工业生产路线还有待进一步的研究。
[1] 徐勤丰.甲砜霉素合成路线概述[J].中国医药工业杂志,1994, 25 (2): 88-90.
[2] 吴春丽,王胜强,丁书超,等.氟苯尼考的合成工艺研究[J].中国药物化学杂志,2007,17(3):160-162.
[3] 陆阳,陶京朝,周志莲,等.新型除草剂甲基磺草酮的绿色合成[J].Pesticide Science and Administration,2017,38 (3): 29-33.
[4] Jain S L, Rana B S, Singh B,et al.An improved high yielding immobilization of vanadium Schiff base complexes on mesoporous silica via azide-alkyne cycloaddition for the oxidation of sulfides[J].Green Chem,2010,121:374-377.
[5] Shaabani A,Rezayan A H.Silica sulfuric acid promoted selective oxidation of sulfides to sulfoxides or sulfones in the presence of aqueous H2O2[J].Catal.Commun., 2007,8:1112-1116.
[6]Romanelli G P, Villabrille P I, Cáceres C V,et al.Keggin heteropolycompounds as catalysts for liquid-phase oxidation of sulfides to Sulfoxides/sulfones by hydrogen peroxide[J].Catal.Commun., 2011, 12: 726-730.
[7]Bahrami K,Khodaei M M,Sohrabnezhad S.Cyanuric chloride as promoter for the oxidation of sulfides and deoxygenation of sulfoxides[J].Tetrahedron Lett., 2011, 52:6420-6423.
[8] Frenzel R,Sathicq A G,Blanco M N,et al.Carbon-supported metal-modified lacunary tungstosilicic polyoxometallates used as catalysts in the selective oxidation of sulfides[J].J.Mol.Catal.A: Chem.,2015,403: 27-36.
[9] Frenzel R, Morales D, Romanelli G, et al.Synthesis,characterization and catalytic evaluation of H3PW12O40 included in acrylic acid/acrylamide polymer for the selective oxidation of sulfides[J].J.Mol.Catal.A: Chem.,2016,420: 124-133.
[10]Ye J X, Wang, J.Y., et al.Alkylimidazolium/alkylpyridinium octamolybdates catalyzed oxidation of sulfides to sulfoxides/sulfones with hydrogen peroxide[J].Catal.Commun., 2016, 81: 1-3.
[11]Zhang B, Li S, Yue S,et al.Imidazolium perrhenate ionic liquids as efficient catalysts for the selective oxidation of sulfides to sulfones[J].J.Organomet.Chem.2013, 744:108-112.
[12]Hu Y L,Liu X B,Fang D.Efficient and convenient oxidation of sulfides to sulfones using H2O2catalyzed by V2O5 in ionic liquid[C12mim][HSO4][J].Catal.Sci.Technol., 2014, 4: 38-42.
[13]Zhou X T, Ji H B, Yuan Q L, et al.Highly Efficient Biomimetic Oxidation of Sulfide to Sulfone by Hydrogen Peroxide in the Presence of Manganese meso-Tetraphenylporphyrin[J].Chin.J.chem., 2008, 26: 1114-1118.
[14]Xue X L, Zhao W, Ma B C,et al.Efficient oxidation of sulfides catalyzed by a temperature-responsive phase transfer catalyst[(C18H37)2(CH3)2N]7PW11O39with hydrogen peroxide[J].Catal.Commun., 2012, 29: 73-76.
[15]Maity P, Mukesh D, Bhaduri S,et al.A water soluble heteropolyoxotungstate as a selective,efficient and environment friendly oxidation catalyst[J].J.Chem.Sci., 2009,121:377-385.
[16]Shokrolahi A,Zall A,Keshavarz M H.Oxidation of organic compounds by sulfonated porous carbon and hydrogen peroxide[J].Chin.J.Catal., 2010, 31: 1427-1432.
[17]Sharma R K, Pandey A, Gulati S.Silica-supported molybdenum complex: A novel, selective and reusable organic-inorganic hybrid catalyst for ecofriendly oxidation of sulfides and olefins[J].polyhedron,2012,45:86-93.
[18]Kon Y, Yokoi T, Yoshioka M,et al.Selective hydrogen peroxide oxidation of sulfides to sulfoxides or sulfones with MWW-type titanosilicate zeolite catalyst under organic solvent-free conditions[J].Tetrahedron, 2014, 70: 7584-7592.
[19]Abdi G,Alizadeh A,Khodaei M M.Highly carboxyl-decorated graphene oxide sheets as metal-free catalytic system for chemoselective oxidation of sulfides to sulfones[J].Mater.Chem.Phys., 2017, 201: 323-330.
[20]Yu B,Liu A H,He L N,et al.Catalyst-free approach for solvent-dependent selective oxidation of organic sulfides with oxone[J].Green Chem., 2012, 14: 957-962.
[21]Kupwade R V, Khot S S, Lad U P,et al.Catalyst-free oxidation of sulfides to sulfoxides and diethylamine catalyzed oxidation of sulfides to sulfones using Oxone as an oxidant[J].Res.Chem.Intermed., 2017, 43: 6875-6888.
[22]Olah G A,Kobayashi S,Nishimura J.Aromatic Substitution.XXXI.Friedel-Crafts Sulfonylation of Benzene and Toluene with Alkyl-and Arylsulfonyl Halides and Anhydrides[J].J.Am.Chem.Soc., 1973, 95: 564-569.
[23]Répichet S, Roux C L, Hernandez P,et al.Bismuth (III)Trifluoromethanesulfonate:An Efficient Catalyst for the Sulfonylation of Arenes[J].J.Org.Chem., 1999, 64:6479-6482.
[24]Choudary B M,Chowdari N S,Kantam M L.Friedel-Crafts sulfonylation of aromatics catalysed by solid acids:An eco-friendly route for sulfone synthesis[J].J.Chem.Soc.,perkin Trans.1,2000 ,2689-2693.
[25]Frost C G,Hartley J P,Whittle A J.Indium-Catalysed Aryl and Alkyl Sulfonylation of Aromatics[J].Synlett,2001,6: 830-832.
[26]Peyronneau M,Boisdom M T,Roques N,et al.Total Synergistic Effect between Triflic Acid and Bismuth (III) or Antimony (III) Chlorides in Catalysis of the Methanesulfonylation of Arenes[J].Eur.J.Org.Chem., 2004, 4636-4640.
[27]Smith K, Ewart G M,Ei-Hiti G A,et al.Study of regioselective methanesulfonylation ofsimple aromaticswith methanesulfonic anhydride in the presence of zeolite catalysts[J].Org.Biomol.chem.,2004 ,2:3150-3154.
[28]Boroujeni K P.Polystyrene Supported Al(OTf)3: a Stable,Efficient, Selective, and Reusable Catalyst for Sulfonylation of Arenes with Sulfonic Acids[J].Bull.Korean Chem.Soc., 2010, 31: 1887-1890.
[29](a) 何成红.对甲砜基甲苯的生产工艺:CN,10162619.7[P].2008-12-04.(b) 杨梅洲,吴志刚,崔明亮,等.一种对甲砜基甲苯的制备方法:CN,10018223.X[P].2009-08-31.(c) 王宏亮,赵丽丰,沈高庆,等.对甲砜基甲苯的工业化生产方法:CN,201110291274.7[P].2011-09-28.(d)樊彬,王玲,陶明,等.4-甲磺酰基甲苯的合成方法: CN 201610132938.8[P].2016-03-09.(e)徐国想,贺鹏飞,周家林,等.一种对甲砜基甲苯的制备方法:CN 201710369523.7[P].2017-05-23.

