雌孕激素复合制剂对薄型子宫内膜行胚胎移植患者妊娠结局的影响
张惠娟,韩宝生,樊桂玲,周巧兰,金 晔,李 娟,耿 女
薄型子宫内膜是指子宫内膜厚度低于可实现妊娠的最低厚度,即在人绒毛膜促性腺激素(HCG)或黄体生成素(LH)峰日内膜厚度<8 mm者[1]。该类患者在行冻融胚胎移植前需常规给予人工周期法干预以进行内膜准备。戊酸雌二醇是最常用药物之一,但其在子宫内膜状态改善方面效果欠佳[2]。近年来,以雌二醇或雌二醇地屈孕酮为代表的雌孕激素序贯复合制剂逐渐成为激素补充干预的主要药物,该药又称为 (Femoston,芬吗通),由17β-雌二醇(2 mg)(红片)和17β-雌二醇 (2 mg)与地屈孕酮(10 mg)复方制剂(黄片)组成,主要活性成分雌二醇片为微粒化雌二醇,与人体内源性雌二醇相同,在子宫内膜准备方面效果优于戊酸雌二醇,但口服给药时,因用药剂量较大,可能增加患远期乳腺癌和子宫内膜癌的风险[3]。史红珍等[4]报道,阴道给药具有起效迅速、有效血药浓度维持时间更长等优势,但能否使患者获得更佳临床收益尚缺乏相关资料证实。本研究以唐山市妇幼保健院2015年3月—2017年3月收治行胚胎移植薄型子宫内膜160例作为研究对象,观察雌二醇/雌二醇地屈孕酮不同给药方案对子宫内膜厚度及妊娠结局的影响。现报告如下。
1 资料与方法
1.1临床资料 本组160例,按治疗方法分为对照组和观察组,每组80例。对照组年龄(32.14±4.30)岁;不孕时间(4.39±1.02)年;体重指数(BMI)为(22.74±1.27)kg/m2;基础促卵泡生成激素(FSH)为(6.61±1.34)U/L,基础促黄体生成素(LH)为(5.83±0.94)U/L,基础雌二醇为(41.06±7.61)pmol/L。观察组年龄(32.30±4.35)岁;不孕时间(4.46±1.05)年;BMI为(22.90±1.31)kg/m2,FSH为(6.56±1.31)U/L,LH为(5.90±0.97)U/L,基础雌二醇为(41.40±7.67)pmol/L。两组年龄、BMI、不孕时间、基础FSH、基础LH、基础雌二醇比较差异无统计学意义(P>0.05),具有可比性。
1.2病例选择标准
1.2.1纳入标准:①促排周期HCG日或自然周期尿LH峰日子宫内膜厚度<8 mm;②因输卵管盆腔或配偶因素不孕;③年龄24~40岁;④子宫形态正常;⑤方案经医院伦理委员会批准,且患者及家属签署知情同意书。
1.2.2排除标准:①子宫肌瘤或腺肌症;②乳腺增生严重;③宫腔回声异常;④卵巢囊肿;⑤基础内分泌异常;⑥恶性肿瘤;⑦精神系统疾病;⑧心脑肝肾功能障碍;⑨临床资料不全者。
1.3治疗方法 对照组给予雌二醇/雌二醇地屈孕酮(荷兰 Abbott Healthcare Products B.V.,注册证号H20110208,其中雌二醇片含雌二醇2 mg;雌二醇地屈孕酮片含雌二醇2 mg和地屈孕酮10 mg)单纯口服治疗,即月经第2天给予雌二醇片口服,2 mg/次,2/d;雌二醇用药5 d后监测子宫内膜厚度,酌情增加剂量最大至8 mg/d;待子宫内膜厚度≥8 mm,用药12~16 d后行子宫内膜转化;观察组在对照组基础上加用阴道放置方案治疗,即月经干净当日加用雌二醇阴道放置2 mg,用药7 d后监测子宫内膜厚度,酌情增加阴道用药剂量最大至4 mg,待子宫内膜厚度≥8 mm,用药12~16 d行子宫内膜转化。两组均于转化后第4天行冻融囊胚移植。
1.4观察指标及方法
1.4.1子宫内膜厚度、子宫内膜容积及子宫内膜下血流类型:采用西门子公司生产S2000型彩色多普勒超声诊断仪进行检测。以子宫体正中矢状面子宫内膜强回声与声晕交界区间最大距离计为子宫内膜厚度;以三维超声检测软件进行子宫内膜容积计算;依据文献[4]将子宫内膜下血流类型分为Ⅰ、Ⅱ及Ⅲ型,其中Ⅲ型判定标准为血管位于内膜低回声区。
1.4.2用药剂量:记录两组患者的累积用药剂量并计算平均值。
1.4.3雌二醇水平:采用酶联免疫法转检测化日单个卵子内雌二醇水平(试剂盒由北京中杉金桥生物技术有限公司提供)。
1.4.4胚胎情况:记录胚胎移植例数、优质胚胎例数和胚胎种植例数,计算平均值和百分比;其中取卵后72 h胚胎属Ⅱ/6以上胚胎判定为优质胚胎[4]。
1.4.5妊娠情况:记录两组生化妊娠例数和临床妊娠例数,计算百分比;以移植后14 d检测血β-HCG阳性判定为生化妊娠;以移植4~5周B超提示宫内妊娠囊判定为临床妊娠[4]。
1.4.6不良反应:观察治疗期间药物不良反应发生情况。

2 结果
2.1子宫内膜厚度、容积及血流类型 观察组治疗后子宫内膜厚度、子宫内膜容积及子宫内膜下血流类型均优于治疗前和对照组(P<0.05)。见表1。
2.2用药剂量和转化日雌二醇水平 观察组用药剂量低于对照组,转化日雌二醇水平显著高于对照组(P<0.05)。见表2。

表1 两组行冻融胚胎移植薄型子宫内膜患者治疗前后子宫内膜厚度、容积及血流类型比较
注:对照组给予雌二醇/雌二醇地屈孕酮口服,观察组在对照组基础上加用阴道放置方案;与本组治疗前比较,aP<0.05;与对照组比较,cP<0.05
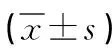
表2 两组行冻融胚胎移植薄型子宫内膜患者用药剂量和转化日单个卵子内雌二醇水平比较
注:对照组给予雌二醇/雌二醇地屈孕酮,观察组在对照组基础上加用阴道放置方案;与对照组比较,aP<0.05
2.3胚胎移植效果 观察组胚胎移植数、优质胚胎率与对照组比较差异无统计学意义(P>0.05)。观察组胚胎种植率高于对照组(P<0.05)。见表3。

表3 两组行冻融胚胎移植薄型子宫内膜患者胚胎移植效果比较
注:对照组给予雌二醇/雌二醇地屈孕酮,观察组在对照组基础上加用阴道放置方案;与对照组比较,aP<0.05
2.4妊娠结局 观察组生化妊娠率和临床妊娠率均高于对照组(P<0.05)。见表4。

表4 两组行冻融胚胎移植薄型子宫内膜患者妊娠结局比较[例(%)]
注:对照组给予雌二醇/雌二醇地屈孕酮,观察组在对照组基础上加用阴道放置方案;与对照组比较,aP<0.05
2.5不良反应 两组治疗过程中均无明显不良反应发生。
3 讨论
辅助生殖技术近年胚胎总体种植率<30%,导致胚胎种植失败的原因,除与胚胎自身和子宫内膜因素有关外,还受年龄、内分泌激素水平等影响,其中子宫内膜容受性是最为关键制约因素之一[5]。目前临床评价子宫内膜容受性的主要指标包括子宫内膜厚度、子宫内膜类型、子宫内膜下血流、胞饮突及外周血雌孕激素等,其中子宫内膜厚度检查以其操作简便、无创及可重复性等多种优势成为最为常用评价之一[6]。国外学者研究证实,子宫内膜厚度最少应>7 mm方可获得最佳妊娠效果,而子宫内膜厚度<6 mm者行胚胎移植妊娠率<1%[7];薄型子宫内膜厚度即指可获得妊娠最低子宫内膜厚度,但对于其定义尚未统一,本文采用子宫内膜厚度≤8 mm这一标准进行研究。
大部分学者认为雌激素水平异常、多囊卵巢综合征、子宫内膜创伤、供血不足及生长不良在薄型子宫内膜病情发展过程中发挥着重要作用[8],而临床针对以上可能机制采用包括激素补充、子宫内膜微创术、抗凝药物、促性腺激素释放激素激动剂及细胞集落刺激因子在内的多种措施以增加子宫内膜厚度,其中激素补充疗法应用最为广泛[9]。本研究结果显示,观察组治疗后子宫内膜厚度、子宫内膜容积及子宫内膜下血流类型均优于对照组及治疗前,用药剂量低于对照组,转化日雌二醇水平高于对照组。提示证实雌二醇/雌二醇地屈孕酮口服+阴道联合给药方案有助于促进子宫内膜厚度增加,改善子宫内膜容受性及减少药物用量。笔者认为这一优势与药物经阴道应用可避免肝脏首过效应,从而增加子宫局部药物浓度有关。已有研究显示[10-11],雌激素水平与子宫内膜上皮细胞增殖速度、血管内皮生长因子表达及内膜血流速率呈明显正相关。
子宫内膜较薄患者在行冻融胚胎移植技术前应用给予雌激素应用以实现人工周期内膜准备,保证子宫内膜厚度达到胚胎移植最低要求;同时药物应用也有助于临床医生更好掌握胚胎移植时机[12]。戊酸雌二醇是较为常用药物雌激素制剂之一,其经阴道给药基本无治疗效果,故仅能通过口服用药;而口服后肝脏可将超过90%雌二醇代谢为雌酮,导致生物利用度明显下降,且易加重肝脏负担,无法满足临床需要[13-14]。雌二醇/雌二醇地屈孕酮属于雌孕激素周期序贯制剂,主要活性成分为17β-雌二醇和地屈孕酮,近年来在国内外被逐渐作为子宫内膜准备辅助用药,在促进子宫内膜生长和提高子宫内膜容受性方面效果确切[15];其中雌二醇片中所含成分为微粒化雌二醇活性与戊酸雌二醇接近,且经阴道吸收效果更佳,无需肝脏代谢即可与雌激素受体结合[16];而阴道用药较口服用药可更快速有效增加子宫药物浓度,避免全身用药可能诱发乳房胀痛、内分泌紊乱及肝功能损伤等潜在不良反应[17]。本研究结果显示,观察组胚胎移植数、优质胚胎率、胚胎种植率、生化妊娠率及临床妊娠率均高于对照组,提示行冻融胚胎移植薄型子宫内膜患者阴道加用雌二醇/雌二醇地屈孕酮在提高胚胎种植效果和改善妊娠结局方面具有优势,这可能与子宫内膜容受性获得更佳改善效果有关。
综上所述,雌二醇/雌二醇地屈孕酮口服+阴道放置方案用于行冻融胚胎移植薄型子宫内膜患者可有效增加子宫内膜厚度,改善内膜容受性,减少药物用量,并有助于改善远期妊娠结局,效果优于单纯口服方案。
[]
[1] 黄春,陈自洪,周莉,等.地屈孕酮在冻融胚胎移植激素替代周期中的应用[J].中国现代医药杂志,2014,7(3):29-31.
[2] Chittawar P B, Kamath M S. Review of nonsurgical/minimally invasive treatments and open myomectomy for uterine fibroids [J].Curr Opin Obstet Gynecol, 2015,27(6): 391-397.
[3] Cholkeri-Singh A, Sasaki J. Hysteroscopy for infertile women: a review [J].J Minim Invasive Gynecol, 2015,22(3): 353-362.
[4] 史红珍,林琳,孙立娟,等.不同雌激素对薄型子宫内膜患者子宫内膜容受性的影响[J].山西医药杂志,2015,44(9):1050-1052.
[5] Akopians A L, Pisarska M D, Wang E T. The role of inflammatory pathways in implantation failure: chronic endometritis and hydrosalpinges [J].Semin Reprod Med, 2015,33(4): 298-304.
[6] 李华,李蓉,刘洋,等.芬吗通改善反复胚胎移植失败患者子宫内膜血流和提高妊娠率的研究[J].生殖医学杂志,2014,23(1):37-41.
[7] Chandra V, Kim J J, Benbrook D M,etal. Therapeutic options for management of endometrial hyperplasia [J]. J Gynecol Oncol, 2016,27(1): e8.
[8] Wanderley M D, Alvares M M, Vogt M F,etal. Accuracy of transvaginal ultrasonography, hysteroscopy and uterine curettage in evaluating endometrial pathologies [J]. Rev Bras Ginecol Obstet, 2016,38(10): 506-511.
[9] Demir B, Dilbaz S, Clinar O,etal. Estradiol supplementation in intracytoplasmic sperm injection cycles with endometrium [J]. Gynecol Endocrin, 2013,29(1): 42-45.
[10] Scoggin C F. Endometritis: nontraditional therapies [J]. Vet Clin North Am Equine Pract, 2016,32(3): 499-511.
[11] 方颖,洪黎明,杨晓葵,等.降调节联合激素替代周期方案在多次胚胎种植失败患者冻融胚胎移植周期中的应用[J].首都医科大学学报,2015,(4):544-547.
[12] 赵诗艺,刘英,杨晓葵,等.薄型子宫内膜冻融胚胎移植周期中应用雌二醇/雌二醇地屈孕酮的疗效观察[J].实用妇产科杂志,2015,31(4):270-273.
[13] Mikolajczyk M, Skizypczak J. Endometrial receptivity - can it be diagnosed and controlled? And why does it matter? [J]. Ginekol Pol, 2014,85(2): 149-153.
[14] 郭欢欢,孙蓬明,林元.薄型子宫内膜的临床处理进展[J].国际妇产科学杂志,2015,42(4): 417-420.
[15] Gleicher N, Kim A, Michaeli T,etal. A pilot cohort study of granulocyte colony-stimulating factor in the treatment of unresponsive thin endometrium resistant to standard therapies [J]. Hum Reprod, 2013,28(1): 172-177.
[16] 黎雪茹,王中海.薄型子宫内膜的研究进展[J].中华妇幼临床医学杂志:电子版,2015,11(1):113-116.
[17] Barad D H, Yu Y, Kushnir V A,etal. A randomized clinical trial of endometrial perfusion with granulocyte colony-stimulating factor in in-vitro fertilization cycles: impact on endometrial thickness and clinical pregnancy rates [J]. Fertil Steril, 2014,101(3): 710-715.
——MIYOTA薄型GL/N/M系列机心

