寒兰菌根的显微结构与菌根真菌的分离
李国平,杨鹭生,李 娟
(武夷学院 生态与资源工程学院,福建 武夷山 354300)
在自然条件下,兰科植物的根与土壤中的真菌共生形成典型的菌根结构。菌根真菌不仅在兰科植物的种子萌发过程发挥重要作用,而且为植株提供碳水化合物和矿物质,增加抗逆性,促进兰科植物的生长发育[1]。兰科菌根的形成可分为2个时期,一是在兰科植物种子萌发时,菌根真菌对种子的侵染;二是在胚芽形成幼根之后,菌根真菌对新根的侵染。相关研究表明[2-4],菌根真菌侵染新根有2种方式,一种情况是根被不具通道细胞,菌根真菌通过破坏根被细胞而直接侵入皮层组织,进而形成内生菌根,如墨兰和建兰;另一种是通过根被上的通道细胞侵入根皮层组织进而形成内生菌根,如春兰、密花石斛、西藏虎头兰等。但是,高瑾等[5]观察了春兰等4种地生兰的菌根形成过程,在春兰根被细胞中并未看到通道细胞,菌丝入侵的方式是通过破坏根被细胞而入侵的。
寒兰为兰科兰属植物,与春兰、建兰和墨兰等均属于我国国兰,主要分布于我国福建、浙江、江西、湖南、广东、广西、四川、贵州和云南等地[6],其叶姿飘逸,花亭与叶等高或高出叶,花色艳丽丰富,常有浓烈香气,花期常集中在10月至11月开花,深受国人喜欢。近年来,由于野生寒兰遭受乱采滥挖,资源急剧减少。寒兰的种子多且细小,发育不完全,种子育苗的难度极大。播种育苗过程中需要筛选适宜的菌根真菌与其共生,胚才能正常的发芽生长。寒兰的传统繁殖方式是分株繁殖,但繁殖系数低。理论上可利用组培技术进行寒兰的快速大规模繁殖[7],但要真正解决寒兰的快速繁殖还有许多问题需要解决,首要问题之一就是组培苗菌根化的问题,因其缺少共生菌根致使组培苗移栽成活率低,幼苗生长缓慢。目前,未见关于寒兰菌根结构及菌根真菌的研究报道。本研究以武夷山野生寒兰为材料,通过采用徒手切片法和苯胺蓝染色压片法,并借助光学显微镜对寒兰菌根进行观察,对其内生真菌进行分离培养、鉴定,以期为寒兰与其菌根真菌的共生关系研究和有益菌株的筛选奠定基础,为今后开展寒兰的快速繁殖和人工栽培技术研究提供参考依据。
1 材料与方法
1.1 材料
野生成年寒兰,带花果,采自武夷山山区。
1.2 方法
1.2.1 菌根显微结构观察
1.2.1.1 苯胺蓝染色压片的制作
参考乔元宝[8]方法观察菌根真菌侵染情况:选取寒兰健康的新鲜营养根,剪成3 cm的小段,加入10%KOH于85℃下水浴30 min,自然冷却后滴加30%H2O2溶液处理10 min,之后冲洗根样至流出的水无颜色,再以10%HCl溶液处理5 min,加0.05%苯胺蓝乳酸溶液染色30 min。根样保存于85%乳酸溶液中备用。观察时取出根样,制作成临时装片,于显微镜下观察并拍照。
1.2.1.2 徒手切片的制作
选取寒兰健康的新鲜营养根,洗净,徒手切片,不染色或经番红-固绿染色法染色后在光学显微镜下观察菌根的结构特点并拍照。
1.2.2 菌根真菌的分离与鉴定[9-11]
1.2.2.1 菌根真菌的分离纯化
剪切寒兰新鲜、健康营养根,清洗后在超净工作台上用0.1% 升汞处理3~5 min,无菌水荡洗5~6次,切成3~5 mm的薄片,接种到PDA平板上,每皿4~5片,37℃恒温避光培养,待接种后的平板上形成一定大小的菌落后,从其边缘挑取菌丝转接到新的PDA平板。重复以上操作,直至获得纯种菌落。将纯化菌株转接到PDA斜面上,25℃下培养48 h,置于4℃冰箱中保存。
1.2.2.2 内生真菌的鉴定
将分离到的纯种菌根真菌,挑取少量菌丝画线于新的PDA培养基平板上,25℃恒温避光培养,待菌落长好后,观察并记录菌落形状、大小、边缘、正背面颜色、色素、气味等特征,作为表型鉴定分类依据。
产孢结构诱导:将分离到的纯种菌根真菌,挑取适量菌丝接种于麦麸糖培养基上,用镊子夹起无菌的盖玻片45°斜插入培养基中,在25℃恒温暗培养,待菌丝长满平皿后,转移至4℃冰箱,待4~6个月后镜检。
插片培养法:将无菌的盖玻片斜插入PDA培养基内,待菌丝布满盖玻片时,取出直接镜检,或盖到滴加一滴乳酸酚棉蓝染色液的载玻片上,封片后镜检,可观察菌丝在自然生长状态下的特征。
2 结果与分析
2.1 寒兰菌根显微结构
寒兰根较粗壮,直径为0.3~0.7 cm。新生根为乳白色,根尖为白色,后逐渐变成棕褐色,无根毛,根表皮上有少数棕褐色的凹陷小孔。寒兰菌根结构从外到内依次是根被、皮层和中柱(维管柱)(图1);内皮层由单层细胞组成,细胞较小,近圆形,排列紧密整齐;中柱最外围具中柱鞘,韧皮部与木质部交替分布,中间为髓部(图2)。菌根的根被是由几层紧密排列的厚壁细胞组成(图 3)。

图1 寒兰菌根横切结构(×10)VE.根被;EX .外皮层;CO .皮层;ST.中柱;PE.中柱鞘;PI.髓Figure 1 Corrhizal microstructure of Cymbidium kanran(×10)VE.Velamen;EX.Exodermis;CO.Cortex;ST.Stele;PE.pericycle;PI.Pith
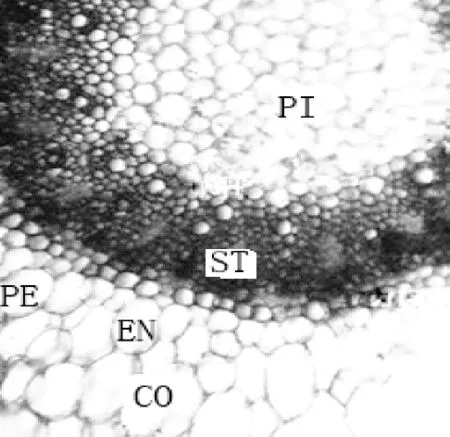
图2 寒兰菌根结构(×40)CO.皮层;EN.内皮层;PE.中柱鞘;ST.中柱;PI.髓Figure 2 Mycorrhizal microstructure of Cymbidium kanran(×40)CO.Cortex;EN.Endodermis;PE.pericycle;ST.Stele;PI.Pith

图3 寒兰菌根结构(×10),示根被VE.根被;CO .皮层Figure 3 Mycorrhizal microstructure of Cymbidium kanran,showing the velamen(×10)VE.Velamen;CO .Cortex
寒兰新根表面可观察到着色较深的部位,老根上有少数棕褐色的凹陷小孔,为菌根真菌的侵入点。根被层未观察到通道细胞,而通过苯胺蓝染色压片法观察发现,在根被细胞中有发达的菌丝团(图 4),菌丝具有明显的横隔(图5),观察结果表明:寒兰的菌根真菌的入侵的主要方式是破坏寒兰的根被组织,进而侵染皮层细胞,形成内生菌根。
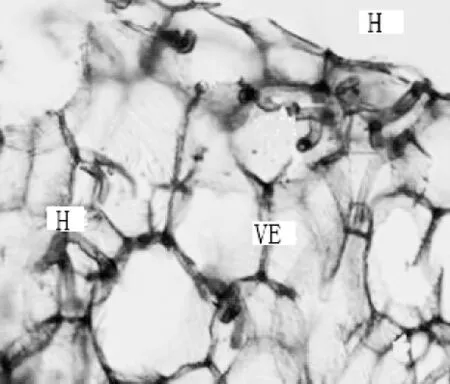
图4 菌根根被细胞中具菌丝(×40)H.菌丝;VE.根被Figure 4 Microscopic observation of hyphae in the velamen cell(×40)H.Hyphae;VE.Velamen
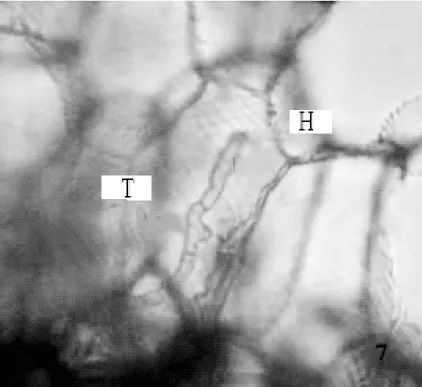
图5 示根被细胞内菌丝具横隔(×40)H.菌丝;T.横隔Figure 5 Showing the septate hypha of mycorrhizal fungi in the velamen cell(×40)H.Hyphae;T.Tabula
寒兰菌根皮层由二十层左右的排列不规则的薄壁细胞组成,占菌根横切面的一大部分。在老根皮层的薄壁细胞中,分布着大量的菌丝及菌丝团。在菌丝团形成之初,结构松散,菌丝较细,顶端呈触须状,可继续侵染下一个细胞(图6,7),菌丝团形成中后期,菌丝会继续膨大而形成的致密的菌丝团,结构也变得更为致密,几乎看不见菌丝(图8)。
在根尖中的皮层细胞中没有发现菌丝团,但在新生根的根被中有少量菌丝存在;在根被中仅有菌丝,没有成型的菌丝团;在维管柱中既没有成型的菌丝团,也没有松散的菌丝。

图6 示皮层细胞内菌丝团(×40)Figure 6 Showing the hypha group in the cortex cell(×40)
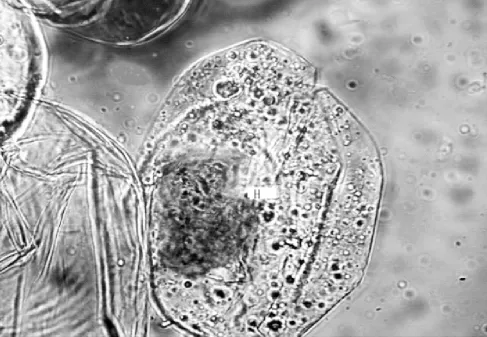
图7 示皮层细胞内菌丝团(×40)H.菌丝团Figure 7 Showing the hypha group in the cortex cell(×40)H.Hypha group
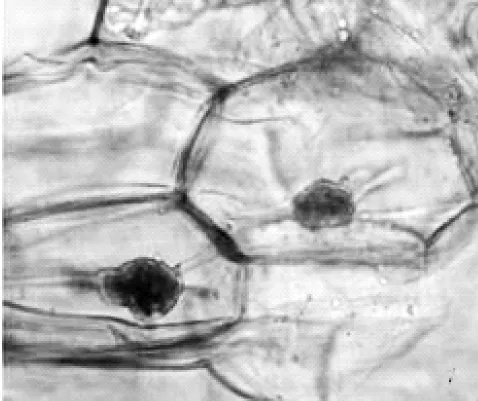
图8 示皮层细胞内致密的菌丝团(×40)Figure 8 Showing the compact hyphae in the cortex cell(×40)
2.2 寒兰菌根真菌分离结果
通过常规分离、纯化培养,自寒兰新鲜营养根中共分离到真菌菌株36个;依据其菌落形态和菌丝的显微形态特征进行初步鉴定,36个真菌菌株隶属于10个属,其中7个属为帚霉属(Eptographium)、丝核菌属 (Rhizoctonia)、丛梗孢属 (Monilia)、色二孢属(Diplodia)、 木 霉 属 (Trichoderma)、 镰 刀 菌 属(Fusarium )和角菌根菌属(Ceratorhiza)(图 9-15),其它3个属的分类位置尚不能确定。
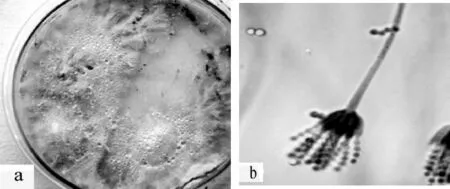
图9 帚霉属Eptographium sp.培养特征 a.菌落;b.菌丝F igure9 Colony characteristicsof Eptographium sp.a.Colony;b.hypha
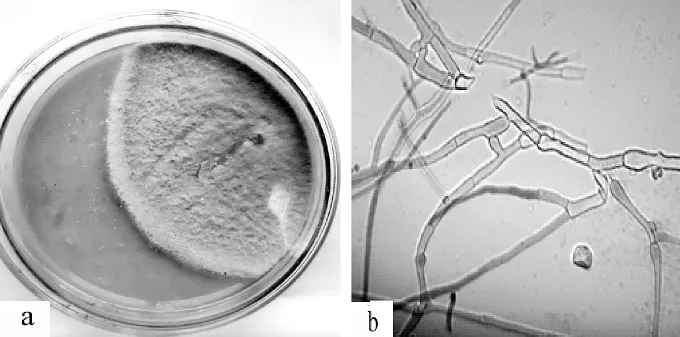
图10 丝核菌属Rhizoctonia sp.培养特征 a.菌落;b.菌丝F igure10 Colonycharacteristicsof Rhizoctonia sp.a.Colony;b.hypha
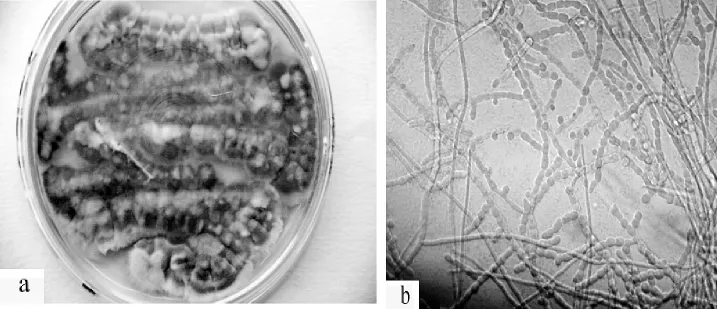
图11 丛梗孢属Monilia sp.培养特征 a.菌落;b.菌丝Figure 11 Colony characteristics of Monilia sp.a.Colony;b.hypha

图12 色二孢属Diplodia sp.培养特征 a.菌落;b.菌丝F igure12 Colony characteristicsof Diplodia sp.a.Colony;b.hypha
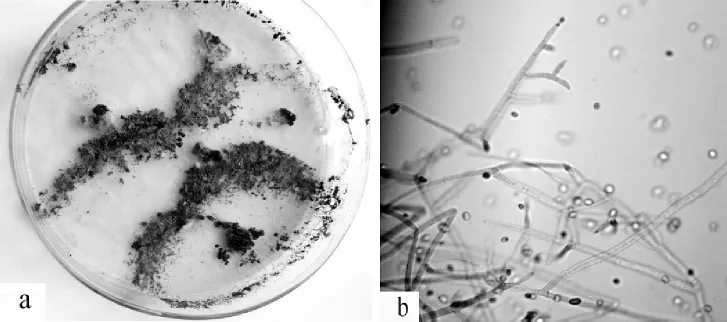
图13 木霉属Trichoderma sp.培养特征 a.菌落;b.菌丝Figure 13 Colony characteristicsof Trichoderma sp.a.Colony;b.hypha

图14 镰刀菌属Fusarium sp.培养特征 a.菌落;b.菌丝F igure14 Colony characteristicsof Fusarium sp.a.Colony;b.hypha
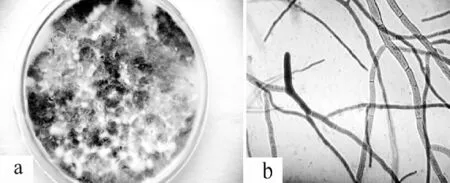
图15 角菌根菌属Ceratorhiza sp.培养特征 a.菌落;b.菌丝Figure 15 Colony characteristics of Ceratorhiza sp.a.Colony;b.hypha
3 讨论
通过组织切片法观察了寒兰根的显微结构,寒兰根横切结构从外到内依次是根被、皮层和中柱 (维管柱),具内皮层,中柱具中柱鞘和髓部,结果表明寒兰根的显微解剖特征为典型的兰科植物根结构,与春兰、建兰、墨兰及独花兰等兰科植物的根结构相似[2,12-14]。通过苯胺蓝染色方法观察了菌根真菌在寒兰根中的侵染和分布情况,在根被层和皮层细胞中可观察到菌丝团的分布,证明了寒兰在自然界是与菌根真菌共生的,而形成的典型菌根结构;新生根或者根尖细胞内无菌根真菌分布,成熟根的内皮层、中柱和中柱鞘细胞内亦未观察到有菌丝分布;根被层未观察到通道细胞,但有发达的菌丝团分布,由此可推测,寒兰菌根真菌入侵的主要方式是通过破坏寒兰的根被细胞,进而侵染皮层,在皮层细胞内定植,形成内生菌根。寒兰菌根真菌的侵染方式与墨兰[12]、建兰[13]以及扇脉杓兰[8]等的类似,同属于无通道细胞的兰根。有研究表明[2],与寒兰同属的春兰菌根则具有通道细胞,其菌根菌丝自外皮层薄壁通道细胞侵入皮层细胞。不过,真菌菌丝通过通道细胞侵染的方式多见于附生兰科植物,如密花石斛、卡特兰和西藏虎头兰等[3-4]。
研究采集寒兰新鲜营养根进行内生真菌的分离、纯化培养,依据形态特征归类后共得到36个真菌菌株纯培养,并根据菌落形态、菌丝特征和产孢结构进行初步鉴定,36个真菌菌株分属帚霉属、丝核菌属、丛梗孢属、色二孢属、木霉属、镰刀菌属、角菌根菌属等10个属。由于兰科植物菌根真菌多缺乏稳定的形态学和培养特征,产孢诱导又往往不易成功,有的真菌本身并没有产孢结构,故单从形态学方面很难准确鉴定。近年来,人们普遍采用真菌的分子特征作为分类依据,分子鉴定可以从遗传进化的角度对真菌的种类、系统地位以及相互间的亲缘关系等做出判定,有效地提高了真菌鉴定的科学性和准确性[15-16]。本研究主要采用了经典的形态学鉴定方法,所分离到的36个真菌菌株的确切分类位置有待利用分子生物学手段进行进一步的分子鉴定。
真菌在兰科植物的种子萌发阶段及其以后的生长发育中均发挥重要的作用。与兰科植物根共生的真菌具有专一性特点,同时,同一种兰科植物中的菌根真菌又具多样性[17]。由于寒兰野生资源日趋枯竭,开展寒兰组织培养和快速繁殖研究是保护寒兰种质资源的重要技术手段之一。为了提高寒兰组培苗的驯化移栽成活率,以后应加强寒兰菌根中内生真菌的分离鉴定以及有益菌株的筛选工作,以期为实现寒兰工厂化育苗目标奠定基础。
[1]陈瑞蕊,林先贵,施亚琴.兰科菌根的研究进展[J].应用与环境生物报,2003,9(1):97-101.
[2]吕梅,伍建榕,马焕成.春兰菌根的显微结构观察[J].西南林学院学报,2005,25(2):8-11.
[3]范黎,郭顺星,肖培根.密花石斛等六种兰科植物菌根的显微结构研究[J].植物学通报,2000,17(1):73-79.
[4]丁晖,韩素芬,王光萍,等.卡特兰与丝核菌共培养体系的建立及卡特兰菌根显微结构的研究[J].菌物系统,2002,21(3):425-429.
[5]高瑾,王芳,伍建榕.4种地生兰菌根的显微结构研究[J].西北农林科技大学学报(自然科学版),2014,42(10):133-139.
[6]吴应祥.中国兰花(2版)[M].北京:中国林业出版社,1993,116-117.
[7]朱国兵.寒兰快速繁殖技术及其试管成花的研究[D].南昌:南昌大学,2006.
[8]乔元宝.扇脉杓兰菌根显微结构与内生真菌多样性[D].重庆:西南大学,2011.
[9]范黎,郭顺星,徐锦堂.我国部分兰科植物菌根的内生真菌种类研究[J].山西大学学报 (自然科学版),1998,21(2):169-177.
[10]胡陶,李潞滨,杨凯,等.中国兰属植物菌根真菌的分离与鉴定[J].北京林业大学学报,2008,30(3):132-135.
[11]Currah R S,Smreciu E A,Hambleton S.Mycorrhizae and mycorrhizal fungi of boreal species of platanthera and coeloglossum(orchidaceae)[J].Can JBot.,1988(68):1171-1181.
[12]范黎,郭顺星,肖培根.墨兰菌根的结构及酸性磷酸酶定位研究[J].云南植物研究,1999.21(2):197-201.
[13]潘超美,陈汝民,叶庆生.野生建兰菌根的显微结构特征[J].广州中医药大学学报,2002,19(1):60-62.
[14]颜容,刘红霞,蔡怀頫,等.独花兰菌根的初步研究[J].北京林业大学学报,2006,28(2):112-117.
[15]王芝娜,李杰,张银杰.中国兰属植物菌根真菌的rDNA ITS分析[J].西北农林科技大学学报(自然科学版),2013,41(4):191-196.
[16]McCormick M K,Whigham D F,O'Neill J.Mycorrhizal diversity in photosynthetic terrestrial orchids[J].New Phytologist,2004,163(2):425-438.
[17]张辑.中国兰属植物内生菌多样性研究[D].北京:中国林业科学研究院,2012.

