参附方对颅脑损伤大鼠亚低温治疗期并发肺水肿的影响
郝万平,王冠,张伟,周之煜,李晓雯
1.天津中医药大学研究生院,天津 300050
2.天津中医药大学第二附属医院,天津 300150
3.天津实验动物中心,天津 300381
创伤性颅脑损伤(TBI)是神经外科常见疾病,是导致大部分中青年人死亡的主要原因之一,其具有高致残率、高致死率、预后差等特点[1],使得其急性期的治疗尤为重要,其中亚低温是一种重要治疗手段。大量研究证实,亚低温(MH)治疗可以降低脑代谢,减少脑耗氧量,降低颅内压,改善脑缺血缺氧,通过提高温度依赖蛋白冷休克蛋白的含量来保护脑组织[2~3]。有一部分国外文献表明,亚低温治疗会增加患者死亡风险,易发肺炎、肺水肿等不良反应[4]。因此如何降低亚低温的不良反应是亚低温更好应用于临床需首要解决的问题。有研究表明,中医药的应用对肺水肿的治疗有一定的疗效[5]。因此,本实验在亚低温治疗的同时加入参附方,以研究中药治疗对亚低温治疗时发生肺水肿的影响。
1 材料与方法
1.1 实验动物 选择清洁级健康SD大鼠120只,体质量200~250 g,雌雄不限;动物合格证号:11300223;所有实验动物由军事医学科学院实验动物中心提供,许可证号:SCXK(京)2012-0004,实验前所有大鼠在25℃和40%湿度下饲养,每天光照16 h。实验在天津医科大学实验中心完成。
1.2 药物与试剂 参附注射液(四川雅安三九药业有限公司,国药准字:Z51020664),经鼠尾静脉注射。白细胞介素-6(IL-6)ELISA试剂盒(瑞士Roche公司)、肿瘤坏死因子 -α(TFN-α)ELISA试剂盒(瑞士 Roche公司)。
1.3 模型制备 颅脑损伤模型[6]:将大鼠麻醉并固定于动物脑立体定位仪支架上,无菌条件下矢状位切开头皮,在右顶骨钻孔(距颅骨冠状缝3 mm、矢状缝右侧3 mm),开直径约3 mm骨窗,采用动物颅脑损伤模型液压打击装置进行颅脑损伤模型致伤,致伤打击力为200 kPa,打击后缝合头皮,致伤后即刻开始给予亚低温治疗。
1.4 分组及干预 按随机数字表法将造模成功大鼠分为以下4组:模型组、亚低温组、中药组、亚低温加中药组,每组30只。模型组和亚低温组大鼠尾静脉注射生理盐水,中药组和亚低温加中药组大鼠尾静脉注射参附注射液,剂量按药物说明书给予正常成人每日用药剂量(1 mL/kg)。亚低温组和亚低温加中药组予以亚低温治疗12 h(亚低温加中药组在亚低温治疗后注射参附注射液),将大鼠置于恒定低温实验冰毯上,保持肛温(31±0.5)℃。4组大鼠均尾静脉注射,每天1次,连用3天。1.5 观察各组大鼠出现肺水肿数量 分别于6 h、12 h、1天、2天、3天观察4组实验大鼠呼吸节律、唇舌黏膜是否发生改变,双肺是否出现湿啰音。通过观察大鼠是否出现呼吸频率、节律变快,出现呼吸困难,唇舌黏膜紫绀,双肺可闻及干湿啰音等情况判定,并记录各组大鼠出现肺水肿的数量。
1.6 标本采集及处理 治疗3天后,从4组中取出相等数量发生肺水肿的大鼠各10只并将其处死,取出大鼠的双肺,置于液氮中保存。大鼠的左肺用于测定干湿重比,右肺测定肺组织中IL-6、TFN-α的含量。
1.7 测定大鼠肺干湿比 取出大鼠左肺,用吸水纸吸干肺表面水分、血迹等,称湿重后置于烤箱中60℃,烘烤72 h后称干重,分别测定各组大鼠肺湿干比(肺组织湿重/干重)(Wet-weight/Dry-weight,W/D)来评估肺水肿程度。
1.8 大鼠肺组织炎性因子的测定 取出大鼠的右肺,按照ELISA法及说明书分别检测大鼠肺组织IL-6、TFN-α的含量。
1.9 统计学方法 使用SPSS20.0统计软件对实验结果进行统计学分析,计量资料以(±s)表示,采用t检验;计数资料以率(%)表示,采用χ2检验。
2 结果
2.1 各组大鼠肺水肿发生率比较 见表1。与模型组比较,亚低温组大鼠肺水肿发生率显著较高(P<0.05),中药组与亚低温加中药组无明显变化(P>0.05)。与亚低温组比较,中药组和亚低温加中药组大鼠肺水肿发生率显著降低,差异均有统计学意义(P<0.05)。

表1 各组大鼠肺水肿发生率比较
2.2 各组大鼠肺湿干重比(W/D)比较 见表2。与模型组比较,亚低温组大鼠肺湿重、肺湿干重比显著升高(P<0.05),中药组、亚低温加中药组则无显著差异(P>0.05)。与亚低温组比较,中药组和亚低温加中药组大鼠肺湿重显著降低,肺湿干重比显著降低,差均异有统计学意义(P<0.05)。
表2 各组大鼠肺湿干重比(W/D)比较(±s)
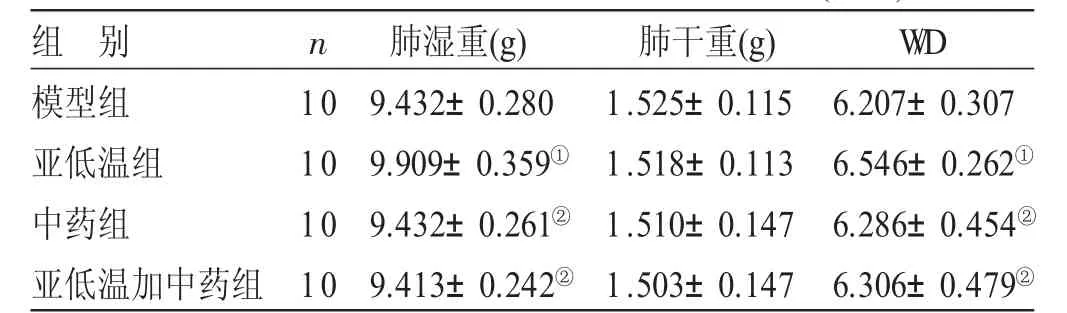
表2 各组大鼠肺湿干重比(W/D)比较(±s)
与模型组比较,①P<0.05;与亚低温组比较,②P<0.05
组 别模型组亚低温组中药组亚低温加中药组n 10 10 10 10肺湿重(g)9.432±0.280 9.909±0.359①9.432±0.261②9.413±0.242②肺干重(g)1.525±0.115 1.518±0.113 1.510±0.147 1.503±0.147 W/D 6.207±0.307 6.546±0.262①6.286±0.454②6.306±0.479②
2.3 各组大鼠肺组织中炎症因子含量比较 见表3。与模型组比较,亚低温组大鼠肺组织中IL-6、TFN-α含量显著升高(P<0.05),中药组、亚低温加中药组大鼠肺组织中IL-6、TFN-α含量无明显差异(P>0.05)。与亚低温组比较,中药组和亚低温加中药组大鼠肺组织中IL-6、TFN-α含量显著降低,差均异有统计学意义(P<0.05)。
表3 各组大鼠肺组织中炎症因子含量比较(±s)
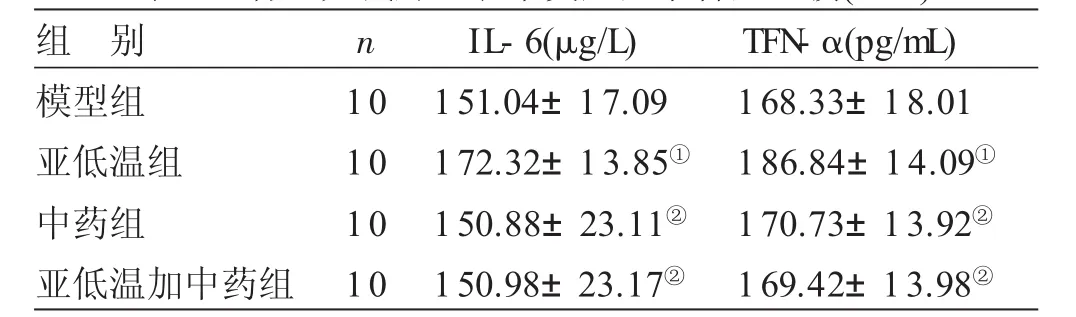
表3 各组大鼠肺组织中炎症因子含量比较(±s)
与模型组比较,①P<0.05,与亚低温组比较,②P<0.05
组 别模型组亚低温组中药组亚低温加中药组n 10 10 10 10 IL-6(μg/L)151.04±17.09 172.32±13.85①150.88±23.11②150.98±23.17②TFN-α(pg/mL)168.33±18.01 186.84±14.09①170.73±13.92②169.42±13.98②
3 讨论
亚低温是治疗颅脑损伤急性期的重要方法之一,但亚低温期并发肺水肿是影响亚低温治疗的主要不良反应。肺水肿是指体液在肺间质或肺泡内积聚而造成肺血管外液量增加的病理状态,肺毛细血管壁通透性增加及毛细血管内压力增加是其主要原因[7]。亚低温治疗后患者的肺炎、肺水肿发生率是常规治疗的2倍以上[8]。而且肺水肿作为临床急危症之一,同时会降低患者的生存率,因此如何降低TBI后MH治疗期肺水肿的发生率是研究的重点内容。肺水肿发生后需要及时救治,结合颅脑损伤患者的神经功能受到损伤、机体免疫功能下降等情况,西医治疗联合参附注射液能有效改善神经源性肺水肿的程度[9]。
本实验以亚低温治疗颅脑损伤后出现肺水肿为出发点,研究参附方对MH治疗后肺水肿的影响。结果显示,亚低温治疗后机体大多是处于神昏,形寒肢冷,面色苍白,口唇青紫,气短或促,咯白痰,痰稠,痰鸣漉漉,舌绛紫或胖淡,苔白腻,脉沉细或弦滑的寒、瘀、闭状态。参附方由人参、附子组成,具有温阳益气、回阳救逆等作用,刚好适用于亚低温治疗后的寒凝瘀闭状态[10~11],通过其温煦作用,发挥其对亚低温状态下发生肺水肿的影响。
本实验通过对各组肺水肿发生数量、肺水肿发生率,肺水肿严重程度,及炎症因子含量的测定比较可以推测:⑴亚低温治疗颅脑损伤大鼠后在一定程度上会增加肺水肿的发生率及肺水肿的严重程度。其可能的原因有:颅脑损伤后神经功能受到严重的损伤,在亚低温状态下,机体的整体免疫机制降低,机体吸入病原菌后易造成肺部感染[12]。同时有可能在低温状态下,大鼠全身血液循环较正常体温慢,减缓了肺内组织液的循环,加重肺部瘀血,导致发生肺水肿的机率较高。⑵亚低温加参附方治疗后,大鼠的肺水肿发生率较亚低温组降低显著,其可能的机制有:从中医角度讲,亚低温后肺水肿阶段机体处于阴寒凝滞、肺失宣降状态,采用具有温阳益气、扶正祛邪的参附方有助于改善亚低温后阴寒内侵的状态。参附方可能通过促进冷诱导RNA结合蛋白(CIRP)表达来降低细胞外信号调节激酶(ERK)表达,抑制继发的转录因子磷酸化启动信号转导,从而发挥其辅助亚低温治疗和抗凋亡作用[13~14],减少在亚低温时受损的中枢神经对肺的影响作用。⑶亚低温加中药组与模型组、中药组之间各项比较无显著差异,推测颅脑损伤后发生肺水肿的可能机制有:①血流动力学的改变导致肺动脉高压;②肺毛细血管渗透机制导致肺内α受体和β受体活性比例失调造成;③冲击学说即大脑受到损伤后引起的机体应激反应[15]。
本研究发现,参附方应用在TBI后MH治疗期,在一定程度上减轻了大鼠肺水肿发生率及肺水肿严重程度,有可能是参附方通过自身温阳益气作用拮抗了亚低温治疗时机体阴寒凝滞的状态,提高了机体的免疫力从而减轻MH后增加肺水肿发生率的副作用,为今后亚低温的研究提供了思路。在治疗上可以中西结合,发挥中医药在临床中的优势,减少亚低温的副作用,更好发挥亚低温的积极作用,但其具体作用机制尚不明确,有待今后的进一步研究。
[1]Winkler EA,Yue JK,Burke JF,et al.Adult sports-related traumatic brain injury in United States trauma centers[J].NeurosurgFocus,2016,40(4):E4.
[2]王冠,蔡英,郝万平,等.冷诱导RNA结合蛋白表达在颅脑损伤大鼠亚低温治疗中的作用及机制[J].山东医药,2016,56(42):9-13.
[3]Wang G,Zhang JN,Guo JK,et al.Neuroprotective effect of cold-inducible RNA-binding protein during mild hypothermia on traumatic brain injury[J].Neural Regen Res, 2016, 11(5):771-778.
[4]Cooper DJ,Nichol A,Presneill J.Hypothermia for Intracranial Hypertension after Traumatic Brain Injury[J].N Engl J Med,2015,373(14):1384.
[5]王国全.凉膈散对内毒素型急性肺损伤肺组织水液转运的影响及机制研究[D].广州:南方医科大学,2014.
[6]Oda Y,Gao G, Wei EP,et al.Combinational therapy using hypothermia and the immunophilin ligand FK506 to target altered pial arteriolar reactivity,axonal damage,and blood-brain barrier dysfunction after traumatic brain injury in rat[J].J Cereb Blood Flow Metab, 2011, 31(4): 1143-1154.
[7]王晓波,姜爽,王舒,等.肺水肿动物模型的研究进展[J].解放军药学学报,2013,29(1):69-71,74.
[8]Lyden P,Ernstrom K,Raman R.Determinants of Pneumonia Risk During Endovascular Hypothermia[J].Ther Hypothermia Temp Manag,2013,3(1):24-27.
[9]史新长.参附注射液治疗神经源性肺水肿的疗效观察[J].中西医结合心血管病杂志:电子版,2015,3(21):116-117.
[10]王冠,曹德晨,孙宏声,等.温阳益气法对重型颅脑损伤患者亚低温治疗期的辅助作用[J].中国中西医结合急救杂志,2015,22(5):449-452.
[11]王冠,郭家奎,曹德晨,等.重型颅脑损伤患者亚低温状态中医证候分析[J].辽宁中医杂志,2013,40(7):1391-1392.
[12]O'Phelan KH,Merenda A,Denny KG,et al.Therapeutic temperature modulation is associated with pulmonary complications in patients with severe traumatic brain injury[J].World J Crit Care Med,2015,4(4):296-301.
[13]王冠,蔡英,孙宏声,等.参附方对颅脑损伤大鼠亚低温期冷诱导RNA结合蛋白表达的影响[J].中国中西医结合急救杂志,2016,23(5):479-483.
[14]蔡英,郑君毅,王冠,等.冷诱导RNA结合蛋白在亚低温下的神经保护作用研究[J].中华老年心脑血管病杂志,2014,16(7):754-757.
[15]Chen J,Qian C,Duan H,et al.Melatonin attenuates neurogenic pulmonary edema via the regulation of inflammation and apoptosis after subarachnoid hemorrhage in rats[J].J Pineal Res,2015,59(4):469-477.

