鱼藤素诱导人胃癌SGC7901/VCR细胞程序性坏死的作用研究
陈立加,高卓维,林清,张双喜
广州中医药大学顺德医院,广东 顺德 528300
近几年,肿瘤细胞的程序性坏死备受关注,被认为是肿瘤细胞死亡的主要方式之一,尤其是耐药肿瘤细胞有可能通过程序性坏死被清除,程序性坏死有希望作为治疗耐药性肿瘤的新靶标。鱼藤素是近年来治疗肿瘤研究中比较热门的单体,而SGC7901/VCR细胞为常用的胃癌耐药实验细胞系[1~2],本研究团队前期预实验发现不同浓度的鱼藤素对胃癌SGC7901/VCR细胞活力有不同程度的抑制作用。为进一步探讨鱼藤素在胃癌SGC7901/VCR细胞耐药细胞中诱导程序性坏死的作用,本研究以胃癌耐药细胞株SGC7901/VCR为研究对象,进行下列实验。
1 材料与方法
1.1 细胞系 人胃癌SGC7901/VCR细胞,由仇志坤博士馈赠。于南方医科大学实验室冻存复苏、传代培养。
1.2 试验药物 鱼藤素由仇志坤博士馈赠,由瑞士ALEXIS公司生产(生产批号:ALX350-118-M025),纯度为95.6%。用二甲基亚砜(DMSO)溶解配成10 mmol/L的储存液,等量分装,-20℃保存,使用前用RPMI1640培养基稀释成各种浓度。
1.3 试剂和仪器 RPMI1640培养基、0.25%胰酶、胎牛血清(美国HyClone公司);H-7650型透射电镜(日本Hitachi公司)。
1.4 分组及给药 将人胃癌SGC7901/VCR细胞培养于体积分数为10%胎牛血清的RPMI1640培养基中,置37℃、5%CO2培养箱中培养。设置对照组(Control)、鱼藤素12 h组、鱼藤素24 h组,鱼藤素的浓度为250 μg/mL。
1.5 Hoechst/PI双染荧光显微镜观察胃癌细胞SGC7901/VCR的凋亡与坏死 将5×108个的胃癌SGC7901/VCR细胞种入6孔板,贴壁生长12 h后加入250 μg/mL浓度的鱼藤素,继续培养12 h或24 h,然后用冷PBS洗涤细胞2次,加入1 mL 4%多聚甲醛4℃固定细胞10 min。弃固定液,再用冷PBS洗2遍,滴加150 μL Hoechst33342工作液和75 μL PI工作液(原液稀释10倍),室温避光染色10 min,在相应波长激发荧光倒置显微镜下观察细胞核形态并拍照记录。蓝色荧光和红色荧光分别表示细胞凋亡和坏死。
1.6 透射电镜观察人胃癌SGC7901/VCR细胞的超微结构 将5×108个的人胃癌SGC7901/VCR细胞种入6孔板,贴壁生长12 h后加入250 μg/mL浓度的鱼藤素(根据前期预实验摸索出来的浓度),继续培养12 h或24 h,用PBS洗涤2次后,弃上清,加1 mL 2.5%戊二酸悬浮细胞,移入1.5 mL EP管中,室温下4 000 r/min离心15 min,固定细胞1 h;在PBS里漂洗1 h将戊二酸洗净,用1%的锇酸固定液固定30 min。梯度脱水:50%乙醇10 min,70%乙醇10 min,90%乙醇10 min,90%丙酮10 min,100%丙酮3次各10 min。丙酮与环氧树脂1∶1包埋2 h,再放入纯包埋剂过夜。置62℃烤箱2天,进行超薄切片,用醋酸铅铀双染法进行切片染色。在透射电子显微镜下观察细胞形态、细胞质及细胞核的变化,照相并记录实验结果。
1.7 流式细胞计数法检测人胃癌SGC7901/VCR细胞凋亡与坏死 将5×108个的人胃癌SGC7901/VCR细胞种入6孔板,贴壁生长12 h后加入加入250 μg/mL浓度的鱼藤素,继续培养12 h或24 h,使用0.25%胰酶消化细胞。调整细胞数为6×108个/mL,转移至离心管,1 500 r/min离心10 min。去上清,PBS漂洗、离心2次后,用150 μL结合缓冲液重悬细胞。加入10 μLAnnexin V-FITC和5 μL的碘化丙啶(PI)轻轻混匀,避光37℃反应15 min,加入200 μL结合缓冲液后,立即用流式细胞仪检测分析。
1.8 Western blot检测RIP1和RIP3蛋白表达 采用Western blot检测细胞坏死信号通路激活中关键蛋白RIP1和RIP3。将8×108的胃癌SGC7901/VCR细胞种入6孔板,贴壁生长12 h后加入250 μg/mL浓度的鱼藤素,继续培养12 h或24 h,用冰冷PBS洗涤2遍,加入100 μL冰冷的RIPA裂解液(含1 mmol/LPMSF),冰上震荡30 min,收集裂解液,4℃,10 000转离心10 min,收集上清。以BSA为标准,用Bradford法对上清进行蛋白定量。取30 μg蛋白样品,12%SDS-PAGE电泳,100 V转2 h至硝酸纤维素薄膜(0.45 μm PVDF),放入5%牛奶封闭液中封闭1 h;RIP3或RIP1抗体4℃过夜。反复洗膜3次,将膜与碱性磷酸酶(Alkaline phosphatase,ALP)标记的抗IgG抗体孵育,室温轻摇1 h,洗膜后,加入ECL发光液,凝胶成像系统中曝光,用图像分析测定各带吸光度(A)值作定量分析。
1.9 统计学方法 采用SPSS13.0统计软件包分析,计量资料以(±s)表示,组间两两比较采用Dunnett分析,多组间比较采用方差分析,计数资料采用χ2检验。
2 结果
2.1 Hoechst/PI双染色法荧光显微镜观察 见图1。与对照组比较,鱼藤素12h组、鱼藤素24 h组出现大量红色坏死细胞,鱼藤素组细胞坏死率明显高于对照组细胞,凋亡率无显著差异。

图1 各组胃癌SGC7901/VCR细胞不同时间点凋亡和坏死结果
2.2 透射电镜观察人胃癌SGC7901/VCR细胞超微结构的变化见图2。为了验证鱼藤素对人胃癌SGC7901/VCR细胞坏死的诱导作用,我们采用透射电镜检测了细胞的超微结构。对照组细胞形态无明显病理改变,鱼藤素处理组可见一些细胞胞体变小、胞浆致密化,胞质浓缩并呈空泡化,细胞核肿胀外突,或细胞核内吞,染色质凝聚成块,核膜周边聚集形成大量坏死小体,内质网变疏松,线粒体结构紊乱,细胞膜不完整。以上结果提示鱼藤素可诱导人胃癌SGC7901/VCR细胞出现程序性坏死。
2.3 各组胃癌SGC7901/VCR细胞凋亡与坏死的结果比较 见图3、表1。与对照组比较,鱼藤素12 h组、鱼藤素24 h组细胞凋亡率无显著差异;细胞坏死率显著升高(P<0.05);且随着时间梯度增加细胞坏死率逐渐增多(P<0.05)。
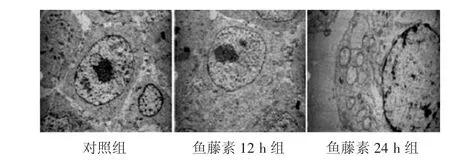
图2 各组胃癌SGC7901/VCR细胞超微结构

图3 鱼藤素250 μg/mL对人胃癌SGC7901/VCR细胞坏死的影响
表1 各组胃癌SGC7901/VCR细胞坏死的结果比较(±s)

表1 各组胃癌SGC7901/VCR细胞坏死的结果比较(±s)
与对照组比较,①P<0.05;与鱼藤素12 h组比较,②P<0.05
组 别对照组鱼藤素12 h组鱼藤素24 h组坏死比例(%)15.88±0.76 29.89±1.89①48.54±3.48①②
2.4 各组胃癌SGC7901/VCR细胞的RIP1、RIP3蛋白表达比较 见图4。与对照组比较,鱼藤素12 h组细胞中RIP1和RIP3的蛋白表达水平有所增加,鱼藤素24 h组显著上升,提示鱼藤素可能通过调控RIP1与RIP3的表达诱导胃癌SGC7901/VCR细胞坏死。
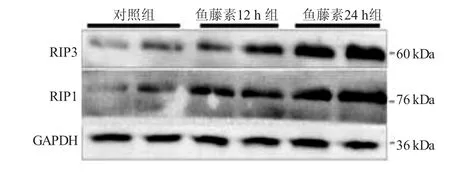
图4 250 μg/mL鱼藤素12 h、24 h对人胃癌SGC7901/VCR细胞RIP1和RIP3蛋白表达的影响
3 讨论
目前,胃癌是临床常见的恶性肿瘤之一,化疗是中晚期胃癌的重要治疗手段。但临床化疗的主要障碍是肿瘤耐药,它与细胞表面药泵蛋白高表达介导的多药耐药及细胞凋亡通路被阻断有关。而诱导肿瘤细胞发生程序性坏死是成为逆转多种肿瘤耐药的潜在途径[3]。程序性坏死是一种不依赖含半胱氨酸的天冬氨酸蛋白水解酶的可调控程序性细胞死亡途径,具有与坏死相同的形态学特征及与凋亡相似的分子生物学特点。程序性坏死可能加速肿瘤细胞死亡或增强肿瘤细胞对抗肿瘤治疗的敏感性,从而在肿瘤靶向治疗中发挥重要作用[4~6]。
细胞的程序性坏死由肿瘤坏死因子受体家族以及Toll-like的受体家族启动,并通过和受体蛋白互作的两个蛋白激酶RIP1和RIP3传递死亡信号[7~8]。受体相互作用蛋白1/3(receptorinteracting protein1/3,RIP1/3)是RIP家族的两个重要成员,是程序性坏死通路中的关键信号分子,该通路参与多种生理病理途径,包括生长发育、组织损伤、抗病毒免疫、炎症反应和免疫应答[9]。RIP可以通过激活核因子κB、肿瘤坏死因子等信号通路,调控细胞程序性坏死,是细胞坏死与凋亡相互转换的分子开关[10~11]。RIP1的磷酸化和泛素化修饰作用决定了RIP1在促进细胞存活和细胞死亡的信号通路中起枢纽作用,并且RIP1激酶活化后募集RIP3,通过RIP同型相互作用基序相互作用形成淀粉样信号复合物即坏死小体[12~14]。RIP1与RIP3的相互作用导致RIP3磷酸化,RIP3的二聚化也能使RIP3自磷酸化和MLKL活化导致细胞坏死[15],研究证明,细胞程序性坏死(necrosis)同肿瘤的发生、发展以及临床的治疗有着紧密的联系[16~18]。
细胞增殖活性的抑制作用是筛选肿瘤诱导分化剂的基本指标。因此笔者前期进行了预实验,筛选了不同药物,发现鱼藤素在不同浓度对胃癌SGC7901/VCR细胞活力有不同程度的抑制作用且呈时间和浓度依赖性。因此,本项目以鱼藤素为干预药物进行研究。结果显示,与对照组比较,鱼藤素组细胞可见大量坏死细胞,细胞凋亡率无明显差异,但坏死率显著升高(P<0.05)。透射电镜检测发现,鱼藤素组细胞可见细胞核肿胀外突,染色质染色质凝聚成块,核膜周边聚集形成大量坏死小体。Western blot检测发现鱼藤素能增加细胞中RIP1和RIP3的蛋白表达水平。综上所述,本研究提示鱼藤素作用于人胃癌SGC7901/VCR细胞后,可诱导其出现细胞程序性坏死。
[1]陈玲,陈凯,杨锡贵,等.HOXD10基因转染对人胃癌耐药SGC7901/VCR细胞增殖、凋亡及侵袭能力的影响[J].胃肠病学和肝病学杂志,2016,25(1):9-15.
[2]戴金锋,吕宾,俞瑾,等.温郁金正丁醇提取物逆转胃癌SGC7901/VCR细胞多药耐药性的研究[J].中华中医药杂志,2014,29(11):3623-3626.
[3]邓秀文,邹文.诱导程序性坏死以规避肿瘤细胞耐药的研究进展[J].临床肿瘤学杂志,2014,19(5):460-464.
[4]Horita H,Frankel AE,Thorburn A.Acute Myeloid Leukemia-Targe ted Toxin Activates Both Apoptotic and Necroptotic Death Mechanisms[J].PLoS One,2008,3(12):836.
[5]Han W,Ling L,Shuang Q,et al.Shikonin circumvents cancer drug resistance by induction of a necroptotic death[J].Molecular Cancer Therapeutics,2007,6(5):1641-1649.
[6]Nehs MA, Lin CI, Kozono DE, et al.Necroptosis is a novel mechanism of radiation-induced cell death in anaplastic thyroid and adrenocortical cancers[J].Surgery, 2011, 150(6):1032-1039.
[7]He S,Wang L,Miao L,et al.Receptor interacting protein kinase-3 determines cellular necrotic response to TNF-alpha[J].Cell,2009,137(6):1100-1111.
[8]Zhang DW, Shao J, Lin J, et al.RIP3, an Energy metabolism regulator that switches TNF-Induced cell death from apoptosis to necrosis[J].Science, 2009, 325(5938):332-336.
[9]Meylan E,Tschopp J.The RIP kinases:crucial integrators of cellular stress[J].Trends in Biochemical Sciences,2005,30(3):151-159.
[10]Moriwaki K,Chan FK.Necrosis-Dependent and Independent Signaling of the RIP kinases in Inflammation[J].Cytokine&Growth Factor Reviews,2014,25(2):167-174.
[11]Khan N,Lawlor KE,Murphy JM,et al. More to life than death:molecular determinants of necroptotic and nonnecroptotic RIP3 kinase signaling[J].Current Opinion in Immunology,2014,26:76-89.
[12]Zhang D,Lin J,Han J.Receptor-interacting protein(RIP)kinase family[J].Cellular&Molecular Immunology,2010,7(4):243-249.
[13]Chavezvaldez R, Martin LJ, Northington FJ.Programmed necrosis:a prominent mechanism of cell death following neonatal brain injury[J].Neurology Research International,2012,2012:257563.
[14]Li J, Mcquade T, Siemer AB, et al.The RIP1/RIP3 Necrosome Forms a Functional Amyloid Signaling Complex Required for Programmed Necrosis[J].Cell,2012,150(2):339-350.
[15]Cook WD,Moujalled DM,Ralph TJ,et al.RIPK1-and RIPK3-induced cell death mode is determined by target availability[J].Cell Death&Differentiation,2014,21(10):1600-1612.
[16]Horita H,Frankel AE,Thorburn A.Acute myeloid leukemiatargeted toxin activates both apoptotic and necroptotic death mechanisms[J].PLoS One,2008,3(12):836.
[17]Han W,Ling L,Shuang Q,et al.Shikonin circumvents cancer drug resistance by induction of a necroptotic death[J].Molecular Cancer Therapeutics,2007,6(5):1641-1649.
[18]Nehs MA, Lin CI, Kozono DE, et al.Necroptosis is a novel mechanism of radiation-induced cell death in anaplastic thyroid and adrenocortical cancers[J].Surgery, 2011, 150(6):1032-1039.

