静脉血平均血小板体积对慢性阻塞性肺疾病急性加重恢复期患者的诊断价值
曹亮,赵建清,钱海红,马力丰,侯海军,刘建华,陈丽萍,冯平
(河北北方学院附属第一医院,河北张家口075000)
慢性阻塞性肺疾病(COPD)是由多种炎性细胞、炎性介质及细胞因子介导的慢性炎症反应性疾病, 包括气道炎症及全身炎症,而急性加重期(AECOPD)是导致患者住院治疗和死亡的重要原因。寻找与COPD急性加重相关的潜在炎性标志物,对病情进行评估、提前干预,乃至避免COPD急性发作是目前COPD研究的热点。血小板平均体积(MPV)是血样中血小板的平均体积大小。有相关研究表明,MPV作为心血管的独立危险因素之一,在急性心肌梗死、高胆固醇血症以及高血压等具有指导意义,此外,可以预示糖尿病和阻塞性睡眠呼吸暂停综合征的预后情况及不良结局,成为国内外研究的热点[1,2]。COPD特别是AECOPD的患者,由于肺血管收缩、血流减慢, 常存在缺氧、感染、酸中毒等症状,导致肺血管内皮细胞受损,暴露内皮下胶原,使得血小板活化,从而导致血小板平均体积变化[3]。然而,MPV是否可以监测AECOPD疾病变化并预示AECOPD病情严重程度,目前相关研究较少。因此,本研究通过对比MPV在AECOPD恢复期及健康人群中的变化,探讨其对AECOPD恢复期患者诊治的临床应用价值。
1 资料与方法
1.1 临床资料 选择2016年9月~2017年12月河北北方学院附属第一医院就诊的处于AECOPD恢复期患者80例(病例组),男47例、女33例,年龄(71.89±11.85)岁。AECOPD按照疾病严重程度分级:Ⅰ级组23例,Ⅱ级组33例,Ⅲ级组24例。纳入标准:①纳入患者疾病符合2017年COPD诊治专家组制定的AECOPD诊治中国专家共识(2017年更新版)[4];②患者入院前4周内均未用过血液制品、免疫调节剂、华法林、肝素类、阿司匹林等抗凝药物;③患者处于AECOPD恢复期。排除标准:①患者除患有AECOPD还伴随有糖尿病、恶性肿瘤、系统性红斑狼疮、肺栓塞、阻塞性呼吸暂停综合症、肺源性心脏病、支气管扩张、支气管哮喘、严重的烧伤或冠心病等疾病;②抑郁症、躁狂症、精神分裂等精神疾病患者。对照组选择同期我院体检健康者80例,男48例、女32例,年龄(72.15±10.91)岁,均除外高血压、糖尿病、高脂血症及冠心病患者。两组性别、年龄比较差异均无统计学意义(P均>0.05)。本研究通过我院伦理委员会审查,所有纳入患者签署研究知情同意书。
1.2 静脉血细胞及MPV检测 抽取两组晨间空腹静脉血3~5 mL置于EDTA抗凝的塑料管中,充分混匀,采用迈瑞BC3000CT全自动血细胞分析仪及原装配套试剂检验白细胞计数、中性粒细胞百分比、血小板计数、MPV。
1.3 肺动脉收缩压(PASP)及肺功能测定 AECOPD患者入院后,采用心脏彩色多普勒超声诊断仪观察当三尖瓣出现反流时测量三尖瓣收缩期的最高反流速度,然后通过计算转换为跨瓣压差,加上收缩期右房压即为PASP。采用全套德国肺功能仪测定AECOPD患者肺功能指标,包括第1秒用力呼气量(FEV1)、FEV1占预计值百分比(FEV1/ pred %)和FEV1/用力肺活量 (FVC)值。
1.4 血气指标检测 AECOPD患者入院后安静环境卧床休息3~5 min,不吸氧或停止吸氧30 min 后,取桡动脉或股动脉血1 mL。血标本严格隔绝空气,标本20 min 内送检,采用西门子Rapidlab1245系列血气分析仪检测动脉血二氧化碳分压(PaCO2)、动脉血氧分压(PaO2)。

2 结果
2.1 两组血液细胞及MPV比较 两组白细胞计数、中性粒细胞百分比、血小板计数及MPV比较差异均有统计学意义(P均<0.05)。见表1。
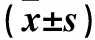
表1 两组血液细胞及MPV比较
注:与对照组相比,aP<0.05。
2.2 不同严重程度AECOPD恢复期患者血液细胞及MPV比较 AECOPDⅠ、Ⅱ、Ⅲ级患者白细胞计数和中性粒细胞百分比差异无统计学意义(P均>0.05),血小板计数及MPV差异有统计学意义(P均<0.05)。Ⅱ级、Ⅲ级患者血小板计数比较差异有统计学意义(P<0.05),Ⅰ级、Ⅱ级及Ⅲ级两两比较MPV差异均有统计学意义(P均<0.05)。见表2。
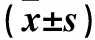
表2 不同严重程度AECOPD患者血液细胞及MPV比较
注:与I级相比,aP<0.05;与Ⅱ级相比,bP<0.05。
2.3 不同严重程度AECOPD恢复期患者肺功能、PASP、血气指标比较 AECOPDⅠ、Ⅱ、Ⅲ级患者FEV1/ FVC、PaO2、PASP比较差异有统计学意义(P均<0.05)。见表3。
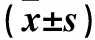
表3 不同严重程度AECOPD患者肺功能、PASP、血气指标比较
注:与I级相比,aP<0.05;与Ⅱ级相比,bP<0.05。
2.4 MPV与FEV1/ FVC、PaO2、PASP的关系 Pearson 相关分析显示,AECOPD恢复期患者MPV与FEV1/ FVC、PaO2呈正相关(r分别为0.61、0.51,P均<0.05),与PASP呈负相关(r=-0.62,P<0.05)。
2.5 AECOPD恢复期患者病情加重的风险因素 将影响AECOPD恢复期患者病情加重风险的多种因素进行Cox风险回归分析,显示年龄>60岁、男性、吸烟、肺部感染、伴其他脏器损伤、MPV降低提示AECOPD恢复期患者存在病情加重风险。见表4。
3 讨论
COPD是由多种炎性细胞、炎性介质及细胞因子介导的疾病,尤其好发于老年男性患者。该疾病特征为持续存在的气流受限,气流受限与有害颗粒或气体(如吸烟、雾霾)所致气道和肺的慢性炎症反应不断加重有关[5]。AECOPD最常见因素为感染,是导致COPD患者病情进展甚至死亡的一个重要因素,因此及时预测AECOPD的发生及正确评估患者病情严重程度十分重要。目前,血气分析、肺功能及PASP测定是评估AECOPD患者病情严重程度的重要实验室检查项目,但许多基层医院由于条件所限无法开展[6,7]。因此,需要寻找一种操作简便、费用低廉的检查方法评估AECOPD患者的病情严重程度。
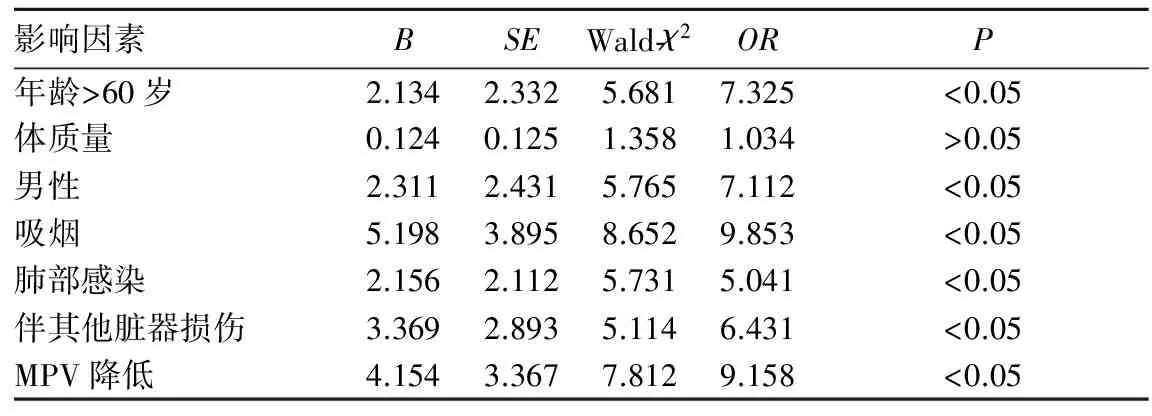
表4 AECOPD恢复期患者病情加重因素Cox风险回归分析
有研究显示,AECOPD恢复期患者淋巴细胞过度凋亡,而中性粒细胞凋亡减少,导致两者出现不平衡,中性粒细胞百分比增高。由于呼吸不畅、低氧等因素的影响,AECOPD恢复期患者血液趋化因子水平升高,血小板生成增多[8]。在AECOPD感染早期阶段,血小板对凝血机制的激活、炎症反应等过程均发挥着重要的作用。此阶段血小板受到刺激后发生活化,功能及结构均发生变化,因此通过检测血小板功能及结构能够反映AECOPD疾病进展情况。MPV是简单易得的生物标志物,是衡量血小板体积大小的常用指标,可体现血小板活化程度,评价骨髓中巨核细胞的状态和血小板生成情况。MPV变化可反映不同慢性病患者体内的炎症反应程度,对感染性疾病、炎症性疾病、免疫系统疾患、心血管疾病及恶性肿瘤患者的预后评价具有重要价值[9~11]。
目前,AECOPD恢复期患者血液MPV的变化存在一定争论。既有AECOPD恢复期患者MPV减低的报道[12,13],也有AECOPD恢复期患者MPV高于健康对照组的结论[14]。本研究显示,随着AECOPD恢复期患者病情加重,MPV降低,并且MPV可反映患者病情严重程度。相关性分析显示,MPV与FEV1/ FVC、PaO2呈正相关,与PASP呈负相关。此机制可能为:①肺功能越差,PASP越高,肺组织释放炎症介质越多;②肺功能越差,缺氧越严重,炎症反应越严重;③下呼吸道发生细菌感染时,细菌脂多糖介导的促炎症反应加重;④循环中大量产生的炎症因子及炎症介质(如中性粒细胞、C反应蛋白等),通过抑制巨核细胞的增生,刺激骨髓释放小体积的血小板,MPV下降[15]。然而,在多因素Cox风险回归分析中发现,年龄>60岁、男性、吸烟、肺部感染、合并其他脏器损伤、MPV降低等因素均提示AECOPD恢复期患者存在病情加重风险,因此MPV对AECOPD恢复期患者评估病情具有一定的参考意义,采用MPV评估AECOPD恢复期患者病情变化时应同时考虑是否合并其他干扰因素。
综上所述,AECOPD恢复期患者MPV低于健康者,且随着AECOPD恢复期患者病情加重,MPV进一步降低。MPV对AECOPD恢复期患者病情严重程度的评估具一定的临床指导意义。
参考文献:
[1] Kim CH, Kim SJ, Lee MJ, et al. An increase in mean platelet volume from baseline is associated with mortality in patients with severe sepsis or septic shock[J]. PLos One, 2015,10(3):e0119437.
[2] Akyüz A, Akkoyun D, Oran M, et al. Mean platelet volume in patients with obstructive sleep apnea and its relationship with simpler heart rate derivatives[J]. Cardiol Res Practice, 2014,2014:454701.
[3] Malerba M, Nardin M, Radaeli A, et al. The potential role of endothelial dysfunction and platelet activation in the development of thrombotic risk in COPD patients[J]. Exp Rev Hematol, 2017,10(9):821-832.
[4] 慢性阻塞性肺疾病急性加重(AECOPD)诊治专家组.慢性阻塞性肺疾病急性加重(AECOPD)诊治中国专家共识(2017年更新版)[J].国际呼吸杂志, 2017,37(14):1041-1057.
[5] Barker BL, Haldar K, Patel H, et al. Association between pathogens detected using quantitative polymerase chain reaction with airway inflammation in COPD at stable state and exacerbations[J]. Chest, 2015,147(1):46-55.
[6] Oliver P, Buno A, Alvarez-sala R, et al. Clinical, operational and economic outcomes of point-of-care blood gas analysis in COPD patients[J]. Clin Biochem, 2015,48(6):412-418.
[7] Mekov EV, Slavova YG, Genova MP, et al. Diabetes mellitus type 2 in hospitalized COPD patients: impact on quality of life and lung function[J]. Folia Med, 2016,58(1):36-41.
[8] Echevarria C, Steer J, Gibson GJ, et al. S29prognostic value of platelet count in patients admitted with an acute exacerbation of COPD (AECOPD) [J]. Thorax, 2014,69(2):A17.
[9] Banerjee S, Kumar A, Ganguly S, et al. A comparative analysis of Mean Platelet Volume in COPD patients vs. healthy controls[J]. Iosr J Dental Med Sci, 2016,15(9):146-150.
[10] Alahdab Y, Abacar K, Karakaya G, et al. Mean platelet volume as an inflammatory marker in inflammatory bowel disease[J]. J Crohn Colitis, 2015,9:S130.
[11] Wodarczyk M, Kasprzyk J, Sobolewska A, et al. Mean platelet volume as a possible biomarker of tumor progression in the rectal cancer[J]. Cancer Biomarkers, 2016,17(4):1-7.
[12] 蒋玉洁,罗维贵,许建国,等.慢性阻塞性肺疾病患者外周血中性粒细胞/淋巴细胞比值变化及其与全身炎症反应的关系[J].右江医学,2015,43(3):265-269.
[13] 李广生,李月川.血小板平均体积及中性粒细胞/淋巴细胞比率联合检测在老年AECOPD近期预后中的临床价值[J].实用医学杂志, 2017,33(6):928-932.
[14] 金兵.血小板平均体积在慢性阻塞性肺疾病急性加重期的变化[J].中国老年学,2015,35(24):7103-7105.
[15] Wood LG, Shivappa N, Berthon BS, et al. Dietary inflammatory index is related to asthma risk, lung function and systemic inflammation in asthma[J]. Clin Experimental Allergy, 2015,45 (1):177-183.

