黄芩对高血压大鼠肾损害的治疗作用及其机制
李亚芹,王乾一 ,徐占稳 ,康世鑫 ,马竞
(河北大学附属医院,河北保定071000)
黄芩始载于《神农本草经》, 不论是单味黄芩或黄芩与多味中药组成的复方制剂均有悠久的使用历史,黄芩因具有清热解毒、燥湿泻火、止血安胎的功效,主要用于治疗发热烦躁、肺热咳嗽、泻痢热淋、湿热黄疸、胎动不安、痈肿疮毒等。目前国内外关于黄芩的研究多局限于黄芩的抗肿瘤、抗病毒、保肝和体外抗氧化作用[1,2]。有研究显示黄芩可通过减轻肾脏自由基代谢紊乱、抑制肾小球高滤过等机制来改善糖尿病大鼠的肾脏病变[3],高中洪等[4]研究显示黄芩的有效成分黄芩茎叶总黄酮对羟自由基引起的大鼠脑皮质线粒体脂质过氧化有一定的抑制作用;Cui等[5]研究显示黄芩水提取物对急性肺损伤大鼠的有保护作用。国内外尚无黄芩对高血压肾损害影响的研究,因此2016年1月~2017年12月本研究拟通过给予自发性高血压病大鼠不同剂量的黄芩治疗,探讨黄芩对高血压大鼠肾损害的治疗作用。
1 材料与方法
1.1 实验动物、药品及仪器 14周龄的自发性高血压大鼠50只,14周龄的普通Wister大鼠10只,体质量(257±10)g,清洁级,由河北医科大学实验动物中心提供,合格证编号805108。动物喂养在河北大学医学部实验中心动物房进行,相对湿度50%~60%,温度18~25 ℃,昼夜明暗交替12 h。黄芩(上海药物研究所植物化学研究室),贝那普利(深圳信立泰药业有限公司),氧化物歧化酶(SOD)(南京建成生物制品有限公司),丙二醛(MDA)(南京建成生物制品有限公司);大鼠尾动脉血压测定仪(澳大利亚AD Instrument公司);水浴恒温振荡器SHA-BA型(金坛市杰瑞尔电器有限公司);漩涡混匀器IKA-MSZ型(IKA公司);低速台式离心机TDL-5-A型(上海安亭科学仪器厂),超级恒温器(上海实验仪器厂),Stat-Fax-2100酶标仪(Awareness 科技公司);高速冷冻离心机GL-16G-Ⅱ型(上海安亭科学仪器厂);电子分析天平DM203型(上海安亭科学仪器厂);动物解剖器械与实验台。
1.2 大鼠分组及处理 14周龄雄性自发性高血压大鼠50只,随机分为模型组、贝那普利组、黄芩低剂量组、黄芩中剂量组、黄芩高剂量组各10 只,另选取10只普通Wister雄性大鼠为空白组,贝那普利组给予贝那普利5 mg/kg每天1次灌胃,黄芩低、中、高剂量组分别给予黄芩17.5、35、70 mg/kg每天1次灌胃,模型组及空白组给予0.9%氯化钠溶液2 mL每天1次灌胃,连续灌胃8周,喂食标准饲料并自由饮水。
1.3 收缩压测定 采用尾动脉容积法。将大鼠尾部在40 ℃水中预热15 min后测定收缩压(在清醒与非激惹状态下),压力信号经处理系统直接同步记录,连续进行3次测量,取其均值作为该样本的收缩压。
1.4 肾组织SOD及MDA水平测定 采用酶联免疫吸附法。用3%戊巴比妥钠将大鼠麻醉后,固定在解剖台后剖开胸部,取出肾脏,在生理盐水中预冷,用预冷的生理盐水洗干净,然后用清洁滤纸吸干水分,准确称取湿重,将各组大鼠肾组织匀浆后测定SOD及MDA水平。具体的操作步骤按试剂盒说明书。
1.5 肾组织结构观察 取各组少许肾组织,经10%甲醛固定,48 h后0.01 mmol/L的磷酸盐缓冲液冲洗3次,70%~100%乙醇常规浓度梯度脱水,二甲苯中透明2次,石蜡包埋,将修好的蜡块固定于石蜡切片机上切片,厚度7 μm,常规苏木素-依红染色后用显微镜观察各组肾组织结构的变化。
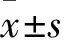
2 结果
2.1 各组大鼠治疗前后收缩压及肾组织MDA、SOD水平比较 治疗前模型组、黄芩低、中、高剂量组及贝那普利组大鼠收缩压及肾组织MDA水平均高于对照组,肾组织SOD水平均低于对照组(P均<0.05),治疗前模型组、黄芩低、中、高剂量组及贝那普利组大鼠收缩压及肾组织MDA、SOD水平比较无统计学差异(P均>0.05);治疗后对照组、模型组、黄芩低剂量组大鼠收缩压及肾组织MDA、SOD水平与治疗前比较均无统计学差异(P均>0.05);治疗后黄芩中、高剂量组及贝那普利组收缩压及肾组织MDA水平较治疗前降低,肾组织SOD水平较治疗前升高(P均<0.05);治疗后黄芩中、高剂量组及贝那普利组大鼠收缩压及肾组织MDA水平均低于模型组及黄芩低剂量组,SOD水平均高于模型组及黄芩低剂量组(P均<0.05);治疗后模型组与黄芩低剂量组大鼠收缩压及肾组织MDA、SOD水平比较差异无统计学意义(P均>0.05),黄芩中、高剂量组及贝那普利组大鼠收缩压及肾组织MDA、SOD水平比较差异无统计学意义(P均>0.05),模型组、黄芩低、中、高剂量组及贝那普利组大鼠收缩压及肾组织MDA水平均高于对照组,肾组织SOD水平均低于对照组(P均<0.05)。见表1。
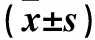
表1 各组大鼠治疗前后收缩压及肾组织MDA、SOD水平比较
2.2 各组肾组织结构改变比较 对照组大鼠肾组织切片显示肾小球上皮细胞排列紧密,无纤维化组织增生及萎缩,肾小管官腔通畅;模型组大鼠肾组织切片中肾小球萎缩,组织充血、肾小管管腔上皮细胞变性;经贝那普利治疗后大鼠肾组织结构有所恢复;黄芩高剂量组肾组织肾小管管腔较模型组通畅,但肾小球结构变化不明显;黄芩低剂量组肾小球有明显的充血,肾小球及肾小管结构与模型组相比无明显变化;黄芩中剂量组肾小球、肾小管结构改善最明显。见图1。

图1 各组肾组织结构改变比较
3 讨论
高血压造成的心脑肾等靶器官损害是高血压病致残的主要原因。中医学认为高血压发病由肝肾亏虚、精血不足引起[5]。黄芩性寒味苦,归肺脾肝胆大肠小肠经,有清热燥湿泻火解毒以及止血安胎的作用;黄芩有效成分主要是黄酮类化合物,对免疫、心脑血管等系统有保护作用。谭安雄等[6]的研究显示高血压大鼠的心室重构机制主要与胶原纤维化有关,同时高血压患者的血压过度波动会加速心室重构的进展[7],高血压大鼠的心室重构与氧化应激及下调的炎性因子如SOD有关[8],螺内酯及贝那普利对氧化应激引发的高血压大鼠的心室重构有抑制作用[9],其机制可能与通过抑制炎症因子的释放,减少细胞凋亡及纤维化有关[10],与纤维化及心室重构有关的这些炎症因子中作用比较明确的是MDA及SOD[11]。本研究结果提示,给予黄芩治疗后,中剂量和高剂量组收缩压均较治疗前降低,同时肾组织中的SOD有明显的升高,MDA有明显降低,低剂量组上述变化不明显。各组大鼠肾组织切片可显示:与对照组相比,自发性高血压大鼠模型中肾组织有明显的损害,表现为肾小球毛细血管上皮细胞及肾小管上皮细胞变性,肾小球有不同程度的充血,经贝那普利及中、高剂量黄芩治疗后上述病变有明显改善,验证了其对高血压造成的肾损害有一定的改善作用。
黄芩通过降低血压改善肾损害的机制探讨如下:高血压肾损害的病理基础是肾小球动脉粥样硬化,动脉粥样硬化的主要原因是血管内皮细胞功能损伤;血管内皮细胞功能是调节血管张力、维持凝血和纤溶系统之间平衡[12]。它调节血管张力的作用是通过分泌内皮源性舒张因子来实现的,SOD可以催化过氧化氢和超氧离子反应,阻止一氧化氮的灭活,是维护血管内皮细胞功能的关键酶,所以动脉硬化时SOD水平可降低[13]。氧自由基能攻击生物膜中的多不饱和脂肪酸, 引起脂质过氧化作用, 造成血管内皮功能损伤。MDA是一种脂质过氧化物, 脂质过氧化可以造成血管内皮细胞损伤, 测定血清中MDA水平可以反映脂质过氧化程度, 本研究显示黄芩能升高高血压大鼠肾组织中SOD水平,降低MDA水平,间接影响血管内皮细胞功能,降低大鼠血压,改善肾损害。大量研究表明,血管的炎症反应与血管损伤关系密切,祝双来等[14]的研究表明,黄芩中黄酮类化合物还可能通过抗氧化、影响免疫调节、活性氧、脂质过氧化物、细胞间粘附分子粘附因子等机制发挥抗炎作用,故黄芩的降压作用可能与其影响血管炎症反应有关。还有研究表明,黄芩的抗氧化作用与其抑制核因子-κB途径有密切关系[15]。
本实验研究表明, 中、高剂量的黄芩能降低自发性高血压大鼠的收缩压, 改善高血压引起的肾功能损害,黄芩成分具有抗氧化作用,如黄芩素可预防氧自由基引起的成纤维细胞的损伤,抑制大鼠脑皮质线粒体脂质过氧化,使细胞免受氧自由基诱导的损伤,黄芩苷、黄芩素等黄酮成分,都能抑制线粒体的氧化损伤,其具体作用机制尚待进一步研究。
参考文献:
[1] 王晓渝,龙汉安.黄芩及黄酮类成分防治肿瘤作用的研究进展[J].华西医学,2011,26(2):297-299.
[2] 康辉,李强,王丽.黄芩提取物抗氧化和保肝作用[J].中医研究,2010,4(23):27-29.
[3] Chen L, Liu XC. Effects of scutellaria baicalensis georgi on renal lesions in diabetic rats[J]. China J Diabetes, 2013,11(6):433-435.
[4] 高中洪,黄开勋.黄芩黄酮对自由基引起的大鼠脑线粒体损伤的保护作用[J].中国药理学通报,2012,16(1):81-83.
[5] Cui R, Meng XL. Correlation between protection of Scutellaria baicalensis extract on rats acute lung injury and cholinergic anti-inflammatory pathway[J]. Rong C, Meng X L, Ping W, et al. Correlation between protection of Scutellaria baicalensis extract on rats′ acute lung injury and cholinergic anti-inflammatory pathway[J]. Chinese Traditional & Herbal Drugs, 2012,43(2):321-326.
[6] 谭安雄,李金成,栗顺善,等.阿托伐他汀改善自发性高血压大鼠心室重构的机制[J].中华高血压杂志,2007,5(6):497-500.
[7] 王金明,张爱元.高血压患者的动态血压变异性与心室重构的相关性[J].中华高血压杂志,2011,10(5):486-487
[8] 林佳,冯瑞儿,吕俊华,等.代谢综合征-高血压大鼠心室重构中糖基化-氧化应激及下调炎性细胞因子的作用[J].中华药理与临床,2011,8(6):13-17.
[9] 杨巍,李雪斌,杨育嘉.螺内酯对高血压性心脏病心室重构的价值[J].重庆医学,2010,8(21):2963-2965
[10] 李凡,白纪红, 梁志清,等.NLRP3炎性小体在肝纤维化形成中的作用的研究进展[J].山东医药,2018,58(8):98-100.
[11] 徐振宇, 杨立明,李广平,等.慢性心衰患者血清miR-133a,miR-133b水平与心功能和心室重构的关系[J].山东医药,2018,58(4):82-84.
[12] 郑京, 梁文娜, 邵丹,慢性肾小球疾病的中医药治疗[J].中西医结合肾病杂志,2007,9(9):537-538
[13] Lin QB, Liao SR. The research progress of SOD[J]. Chemical World, 2006,5 (5):78.
[14] 祝双来,黄红林.黄芩黄酮类化合物抗炎作用机制研究进展[J].江西中医学院学报,2011,22 (3):97-99.
[15] Li M, Cheng WQ. Baicalin on lipopolysaccharide induced macrophage NF-κB activation and inflammatory factor expression[J].Mod Biom Pro, 2010,9(22):4219-4221.

